子宫静脉内平滑肌瘤病51例临床特点及诊治
赵欣宇,冯子懿,刘岿然
(1.中国医科大学附属盛京医院,沈阳 110000;2.中国医科大学,沈阳 110000)
静脉内平滑肌瘤病(intravenous leiomyomatosis,IVL)又称血管内平滑肌瘤病,IVL是一种特殊类型的子宫肌瘤,1896年由Hirschfeld首次报道[1],起病隐匿,无临床特异性。在病理学上IVL虽属良性肿瘤,却有类似恶性肿瘤的侵袭性及复发性,生物学行为特殊,造成循环系统障碍时,如未及时诊治,可引起晕厥甚至猝死。本文回顾性分析我院51例IVL患者的临床资料,总结该病特点,并探讨诊治策略。
1 资料与方法
选取2012年6月至2020年11月于中国医科大学附属盛京医院行手术治疗且术后病理证实为IVL的患者51例,回顾分析其孕产史、手术史、症状及体征、影像学异常表现及肿瘤标记物、手术方式及其他辅助治疗、预后等,针对IVL疾病特点及诊治策略进行归纳总结。
2 结 果
2.1 一般资料 患者年龄26~65岁,平均(43.92±7.50)岁。26~35岁患者7例,占13.72%,36~55岁患者41例,占80.4%(41/51),56~65岁患者3例,占5.88%。6例患者已绝经,1例患者未婚未孕。21例(41.2%)患者有子宫肌瘤病史,病史达1个月~16年。6例患者曾行子宫肌瘤剔除术,其中经阴/腹腔镜4例,经宫腔镜2例。
2.2 临床表现及体征 患者首发症状包括月经量增多[13例(25.5%)],月经不规律/经期延长[4例(7.8%)],腹部包块/腹胀[5例(9.8%)],阴道大量流血[4例(7.8%)],腹痛[3例(5.9%)],尿频、尿急、血尿[5例(9.8%)],痛经加重[2例(3.9%)],阴道异常流液[1例(2.0%)]。月经异常改变患者共17例,约占33.3%。余14例患者无明显自觉症状(27.5%),因近期三维超声结果异常就诊,包括:子宫肌瘤较前明显增大、附件区占位、宫腔占位等。患者均无头晕头痛、心慌心悸、胸闷甚至下肢肿胀等不适。入院后均行妇科专科检查,除2例未发现明显异常外,余患者均可及子宫不同程度增大或宫区、宫旁肿物,子宫形态不规则。
2.3 辅助检查 51例患者入院后均行阴式超声检查,提示宫区和(或)宫旁肿物,34例提示子宫增大,最大为13.8cm×12.0cm×9.6cm。3例术前超声诊断子宫静脉内平滑肌瘤,其中1例较典型(图1),1例超声可见后壁回声粗糙,其内呈条状、簇状及结节状交错分布。14例患者行MRI检查,提示宫区或宫旁肿物,形态不规则,强化不均匀。10例患者行全腹计算机断层扫描CT,其中1例术前诊断IVL,2例提示宫旁血管或盆底静脉迂曲扩张。24例患者术前进行心脏超声检查,未见明显占位。35例患者术前完善肿瘤标记物检查,其中7例CA125高于正常上限值2倍以上,最高达166.8U/mL。
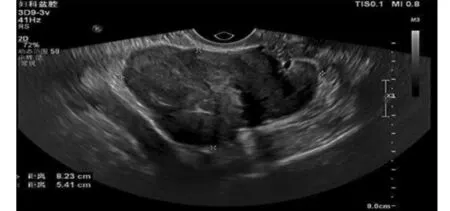
图1 超声诊断右侧宫旁实性肿物,走行迂曲,似沿盆底静脉血管走行,形态不规整,边界较清,CDFI可检出血流信号
2.4 治疗方法 患者均进行手术治疗。38例行经腹手术,7例经腹腔镜手术,2例行阴式手术,4例行宫腔镜手术;29例患者行全子宫切除术,其中15例患者同时行双侧附件切除术,2例同时行单侧附件切除术;余22例患者仅行肌瘤核除术及盆腔病灶切除术,术后2例接受促性腺激素释放激素激动剂(GnRH-a)补充治疗,共6针。
2.5 术中探查 33例(64.7%)患者子宫不同程度不对称增大,所有病例均可见宫区多发肌瘤样结节伴/不伴宫旁肿物,累及部位包括阔韧带、子宫颈峡部、髂外静脉、卵巢静脉及髂总静脉等;26例(51.0%)病灶呈质软、囊性变或囊实混合、多个病灶融合、变性或部分变性等;22例(43.1%)病灶形态较典型,肌瘤样肿物延血管走形,形态各异,不规则,如串珠样、条索样等,质软或部分质软,最远累及右侧髂总静脉,见图2。其中1例术中经腹腔镜探查见病灶与髂外静脉管壁有少许融合,将肿物与髂外静脉小心分离后,见髂外静脉管壁有长约1cm破口,立即改为开腹手术修补髂外静脉,术中出血约800mL。
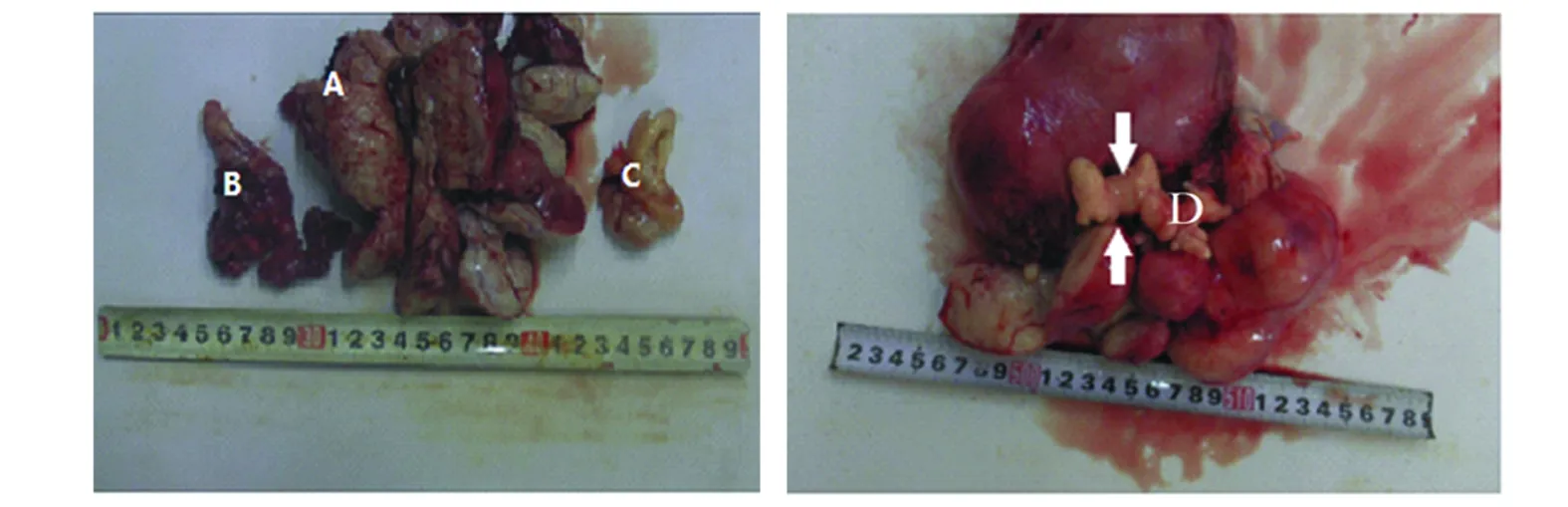
图2 手术标本A:全子宫,宫颈内膜光滑,肌壁间及浆膜下结节0.3~4cm多个,白韧;肌瘤部分位于脉管内;B:右附件,卵巢3cm×2cm×2cm,卵巢旁见肌瘤组织位于脉管内,6cm×0.8cm;C:血管内肌瘤,11cm×3cm×1cm,粉白质韧;D:肌壁间见肌瘤结节0.5~8cm多个,粉白质中,宫颈管处管壁内见肌瘤结节,可抽动,粉白质韧
2.6 病理结果及随访 患者均行术中冰冻病理检查,24例(47.1%)术中诊断IVL,27例术中回报良性,石蜡病理诊断IVL,见图3。6例患者失访;2例于病灶切除术后进行GnRH-a治疗,共6针,其中1例于术后2年后成功自然受孕,足月剖宫产娩出一健康活婴。3例患者复发,1例44岁患者于术后4个月后检查发现子宫肌瘤,直径约1cm,现定期复查中;2例患者均行经腹全子宫切除术:1例于术后3年复发,累及心脏,外院行胸腹联合手术切除病灶及双侧附件;1例患者术后10个月复发,于我院再次手术,行经腹双侧卵巢切除术+盆腔病灶切除术,病灶最远累及一侧髂外静脉,随访至今,未再复发。其余患者于术后每3~6个月进行盆腔超声检查,术后至今均未产生心悸、晕厥、呼吸困难、下肢水肿等不适。
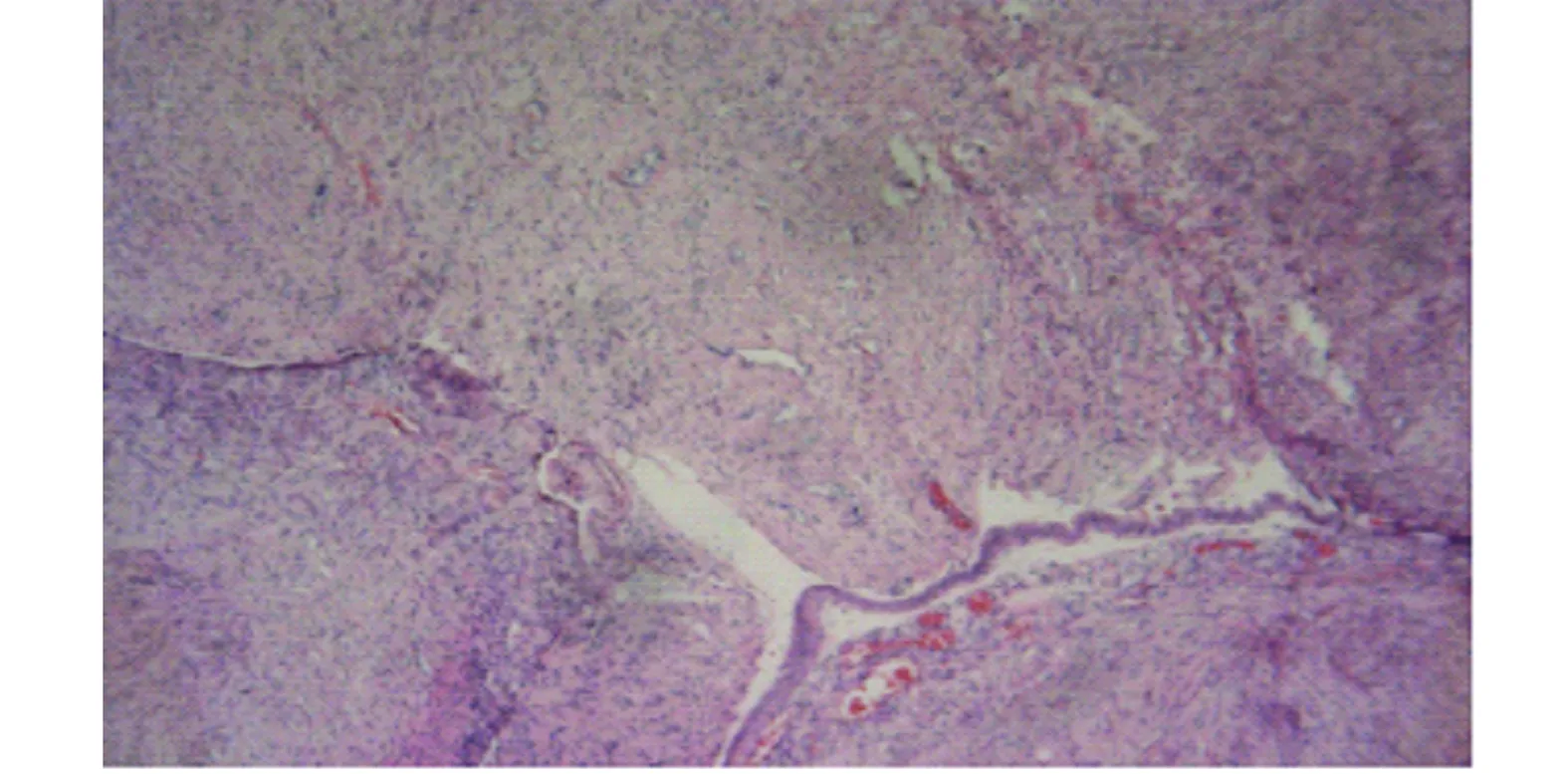
图3 瘤细胞梭形,束状排列,部分位静脉内(HE×50)
3 讨 论
子宫IVL十分罕见,暂无确切发病率,其组织学表现良性,可生长至盆腔静脉、下腔静脉、右心房、右心室甚至肺动脉而导致流出道梗阻,增加发病及死亡风险。迄今为止,全球英文文献报道的子宫IVL不到400例[2]。
3.1 病因 IVL的病因尚不清楚,目前有两种理论:Knauer等[3-4]认为IVL来源于静脉平滑肌组织增生并沿静脉腔内生长;Sitzenfry[5]认为子宫肌瘤沿脉管播散。近年越来越多的研究结果倾向后者:(1)Li等[6]报道,83.5%的IVL患者合并子宫肌瘤或有子宫切除术、子宫肌瘤剔除术史。部分学者认为,前次子宫相关手术造成血管损伤,导致平滑肌瘤隐匿于脉管系统中并沿脉管内逐渐生长[7];(2)IVL肿瘤细胞的雌、孕激素受体阳性,而受累血管平滑肌细胞雌、孕激素受体为阴性;(3)范玉龙等[8]研究中,8例患者术中发现瘤体根部均位于子宫,并沿血管走行。本研究中49例(96.1%)均未涉及髂静脉、下腔静脉甚至心脏,更倾向于支持第二种说法。
据报道,IVL为一种激素依赖性疾病,分析其原因:(1)国内外报道IVL发病年龄21~80岁,多为绝经前女性[9],平均年龄40岁左右,本研究病例平均年龄(43.92±7.50)岁,为激素依赖性疾病的好发年龄;(2)瘤组织中雌激素受体(ER)及孕激素受体(PR)表达明显高于正常组织;(3)病例常发生在多孕产史患者。
肿瘤生长途径可分为2种:沿子宫静脉-髂内静脉-髂总静脉-下腔静脉-心脏走行,或沿右卵巢静脉-下腔静脉-心脏/左卵巢静脉-左肾静脉-下腔静脉-心脏生长,前者较后者更为常见[10]。本研究中出现1例累及一侧髂外静脉,不除外病灶起源于髂外静脉平滑肌组织的可能。
3.2 临床表现 IVL的临床表现缺乏特异性,临床上根据病情进展分为四期[11]:I期,病灶局限于盆腔,临床症状与子宫平滑肌瘤相似,表现为月经异常改变、腹部包块、腹胀、贫血甚至阴道大量流血导致失血性休克等,以及盆腔脏器压迫症状,如排尿困难、尿潴留等;II期,病变累及腹腔,但未达肾静脉水平,可造成下肢水肿等;III期,病灶超过肾静脉水平,延伸至右心房、右心室;IV期,累及肺动脉甚至转移至肺部。临床上以I期及II期多见,本研究49例患者均属I期,多因月经异常改变、阴道大量流血等妇科症状就诊,产生心血管系统症状时患者往往已达III~IV期,因呼吸困难、晕厥、心悸等就诊于心血管外科,严重时IVL可造成猝死。本研究中无症状病例达25.5%。Roman等[12]报道了1例43岁妇女除晕厥外而无其他症状,猝死后尸检发现自肾静脉延伸至右心室IVL肿瘤病灶。因此,尽早发现IVL并合理治疗对于减少IVL不良结局至关重要。
3.3 诊断 因IVL缺乏典型临床表现,结合子宫肌瘤病史及影像学检查提高术前诊断率具有重要意义。超声可提示肿瘤位置、大小、分布及血流动力学改变,相关文献提到子宫IVL超声表现为子宫或受累静脉条索样低回声肿物,血流信号丰富[13],且肿物多有变性。本研究51例患者术前均进行盆腔超声检查,仅3例术前提示IVL,可见超声诊断价值有限。超声心动图有助于评估心内受累和瓣膜以及心脏功能,IVL患者应结合心脏超声,以判断病情进展。患者心脏超声出现以下表现应注意IVL累及心脏的可能性:(1)右心房肿块伴下腔静脉受累;(2)血管内或心内肿块不附着在血管内皮或心内膜上,且可自由移动[14]。因术前未考虑IVL诊断可能性,术前仅24例患者因高血压、高龄、心电图异常等原因行心脏超声及心肌酶谱检查,均未见明显异常。CT和MRI是评估静脉内平滑肌瘤病进展的最有价值的成像方法。典型的CT表现包括血管内充盈缺损的低密度肿块和相关的子宫平滑肌瘤[15-17]。MRI的特征是静脉内流空信号消失,代之以静脉内软组织信号。本研究中14例行盆腔MRI检查的患者中2例较为特殊,1例为增粗动脉伴粗大静脉,1例为液性区内延续性肿物。计算机断层静脉造影(CTV)重建类似血管造影,可为制定详细的手术方案提供提供重要依据。肿瘤标记物如CA125等的升高对于IVL的诊断、随诊监测是否具有指导意义仍需大样本数据进一步研究。
明确诊断IVL有赖于病理学检查。对于具有子宫肌瘤病史的育龄期妇女,术中肉眼观子宫不规则增大、多发肌瘤样结节,伴/不伴宫外肿物,且以阔韧带肿物为主,表面血管怒张、血运丰富,形态不规则,呈条索状、树枝样等,多伴有变性、质软,病灶常沿血管走行,应高度怀疑IVL。所有病例均应行术中冰冻病理检查,以指导改良手术方案。对于镜下IVL,有学者提出,取材不应局限于子宫肌瘤范围,周围的子宫平滑肌组织及腹膜反折下的子宫下段因血管极丰富,均应取材镜检[3,18-19]。
3.4 治疗 目前IVL的治疗方法主要为手术,因IVL为激素依赖性疾病,建议将全子宫及双侧附件、其余病灶尽量一同切除[2],彻底切除病灶可显著降低其复发率[20]。对于I期IVL患者,有学者主张根据年龄及生育要求决定手术方案[8],对于有生育要求的年轻患者及术中未能彻底切除病灶的患者,术后应用促性腺激素释放激素类似物和抗雌激素治疗可能有效[21-22]。对于II~IV期IVL患者,需联合多学科进行一期手术或分期手术治疗。一期手术指将静脉内病灶完全切除同时行全子宫及双侧附件切除术。分期手术是指前期切除肾静脉以上瘤体,后期切除肾静脉以下瘤体,手术相隔时间4~6周,主要适用于:(1)患者一般状态较差,难以耐受胸腹联合手术;(2)肿瘤和血管壁广泛粘连;(3)急诊手术应先行胸部手术。两次手术之间的间隔不应太长[2],同时应注意前次手术部位病灶复发以及肿瘤脱落造成栓塞等风险。术后是否进行激素相关治疗仍存争议,主要包括三类:GnRH-a,孕酮,芳香化酶抑制剂。研究表明,他莫昔芬[23]及孕酮[24]对于已接受根治性切除的IVL患者几乎无作用。Li等[6]对194例病例分析得出术后抗雌激素治疗不能防止肿瘤复发。另一些学者认为,激素治疗可缩小病灶,减少复发甚至消除隐匿性病灶[25]。
此外,因IVL累及静脉系统,病灶分布部位、大小、数目、质地各异,与血管内膜及邻近脏器关系密切程度,均增加手术的难度,如肿物致密黏附于血管壁,不可盲目暴力拖拽,否则血管撕裂,出血汹涌,危及患者生命安全。术中注意评估患者失血量,避免盲目补液,加重心脏负担。有学者指出[25],术时应先结扎瘤栓的血管末端,防止肿瘤转移、残留,完整切除病灶;如无法完全切除者,应结扎累及血管近心端,防止瘤栓进入下腔静脉,甚至危及生命。
3.5 复发 IVL易复发,根治性切除几乎没有复发[7],部分切除5年复发率为33.3%[7]。本研究中除失访患者外,仅3例患者复发,复发率6.7%,考虑49例IVL患者均为I期,发现较早,诊治及时,预后较好。
虽然组织学研究对于诊断至关重要,但影像学检查在病变定位、术前分期指导手术及监测中起着关键性作用。针对临床资料提示子宫肌瘤病史及盆腔肿物的女性患者,临床及影像学医生均应警惕本病的可能,如术中探查病灶符合IVL特点,均应行术中冰冻病理检查,制定个体化治疗方案,且术后需完善心脏超声明确病情进展程度。因本病十分罕见,临床认识不足,未进行针对本病的系统性治疗及密切监测,易造成漏诊、复发等。根据本病的独特性,应告知患者本病复发甚至进展造成猝死的可能,建议术后患者密切随访。此外,肿瘤标记物水平与本病的联系、术后是否辅助激素治疗,仍需更大样本资料进行研究。

