氨基胍对肺纤维化大鼠MMP-13、TIMP-1及转化生长因子-β1/Smads信号通路的影响①
穆亚敏 黄希 宋志勇(湘潭医卫职业技术学院,湘潭410004)
肺脏纤维化(pulmonary fibrosis,PF)是累及肺间质、肺泡及肺血管的进行性疾病。临床上PF常伴有限制性通气功能受损,导致患者气体交换障碍,呼吸困难,诱发低氧血症,甚至导致患者出现呼吸衰竭,危及生命。PF病理机制尚未阐明,尚无根治手段。研究证实,肺部细胞外基质(extracellular matrix,ECM)骤然大量降解,过度积累,导致间质纤维化[1]。基质金属蛋白酶(matrix metalloproteinases,MMPs)及其天然抑制剂组织基质金属蛋白酶抑制物(tissue inhibitors of metalloproteinase,TIMPs)表达失衡是ECM合成与降解失衡的主要原因[2]。WU等[3]研究表明,调节大鼠肺组织TIMP-1表达有助于改善PF症状。转化生长因子β1(transforming growth factor-β1,TGF-β1)是器官纤维化病变中公认的关键调控因子。信号转导分子(sma and mad homologues,Smads)是TGF-β1与相应细胞表面的丝/苏氨酸激酶受体结合后,负责将胞膜信号传递至胞核下游重要的介导分子。LEBRUN等[4]研究表明,TGF-β1信号分子被激活是PF的标志性事件。氨基胍是一种具有亲核性能的肼类小分子,可抑制体内蛋白糖基化修饰,是临床上针对糖基化终末产物确切的抑制剂。YOON等[5]研究证实,氨基胍在糖尿病肾病小鼠模型明显抑制肾小球及肾间质纤维化。但氨基胍对PF作用的报道较少。本研究通过建立大鼠PF模型,观察大鼠肺组织中MMP-13及TIMP-1表达,基于TGF-β1/Smads信号通路探讨氨基胍对PF大鼠肺组织的保护作用,为氨基胍临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级8~10周龄SD雄性大鼠120只,体重200~220 g,购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2016-0011,依照我院实验动物管理办法,室温下标准饲料喂养,自由饮水,分笼(4笼)适应性饲养1周后用于后续实验。本研究经我院实验动物管理伦理委员会批准(2019-032)。
1.1.2 主要试剂氨基胍(20 mg,美国Sigma公司,生产批号:L39964);博莱霉素(15 mg/只,日本化药株式会社,生产批号:H20090885);地塞米松(0.75 mg,广东华南药业);p-Smad2、p-Smad7、MMP-13、TIMP-1抗体、兔抗GAPDH抗体(美国Santa公司);Western blot试剂盒(德国Rebstock公司);免疫组化试剂盒、Masson染色试剂盒(南京建成生物有限公司);HE试剂盒(上海碧云天公司);蛋白浓度测定试剂盒、化学发光试剂盒(美国Forma公司)。
1.1.3 主要仪器LIOOS600T生物显微镜(日本尼康公司);Bio-Rad凝胶成像系统(美国Bio-Rad公司);-80℃冰箱(德国维根斯公司);Leica RM2135组织切片机(德国Leica公司);高速低温离心机(北京六一仪器厂)。
1.2 方法
1.2.1 造模与分组处理适应性喂养1周后,将大鼠随机分为4组:正常组、模型组、氨基胍干预组(实验组)、阳性对照药地塞米松干预组(对照组),每组30只。模型组、实验组、对照组大鼠一次性气管滴注4 mg/ml博莱霉素氯化钠(0.9%)溶液构建PF模型(1.25 ml/kg)[6],正常组大鼠滴注等剂量等浓度氯化钠溶液。滴注完毕后实验组、对照组大鼠每日分别腹腔注射1 ml氨基胍溶液(20 mg/kg)和1 ml地塞米松溶液(20 mg/kg),正常组、模型组分别腹腔注射等剂量生理盐水。注射完毕后,所有大鼠正常饮食,自由饮水。药物干预28 d后心脏穿刺处死大鼠,打开胸腔无菌取出肺组织,-80℃保存待测。
1.2.2 各组大鼠支气管灌洗液(BALF)标本采集药物干预28 d后,麻醉大鼠,心脏穿刺处死大鼠,分离完整气管,并在左主支气管进行气管插管,丝线结扎,PBS冲洗3次,收集各组大鼠BALF,离心,取上清,-80℃保存待测。细胞沉淀经PBS缓冲液重悬,均匀铺于载玻片,Wright Giemsa染色,显微镜下观察总细胞和嗜中性粒细胞数。
1.2.3 肺组织湿重/干重(W/D)比例测定取各组10%大鼠肺组织,肉眼观察各组大鼠肺组织解剖病理变化,无菌清洗,无菌吸水纱布吸干。称重(湿重W),60℃烘箱中放置48 h,称重(干重D),计算W/D。
1.2.4 HE染色观察各组大鼠肺组织病理学改变取各组10%肺组织标本,多聚甲醛固定24 h,包埋,切片,HE染色,光镜下观察各组肺组织病理变化。
1.2.5 Masson染色观察各组大鼠肺组织纤维化改变取各组大鼠10%肺组织,生理盐水冲洗10 min,中性甲醛溶液固定,石蜡切片,常规脱蜡,无菌水清洗10 min,Masson复合液染色15 min,0.2%醋酸溶液清洗,5%磷钨酸漂洗10 min,0.2%醋酸溶液清洗3次,2%苯胺蓝复染5 min,无水乙醇脱水,二甲苯透明,中性树胶固定,倒置荧光显微镜下观察肺组织标本形态学变化。Masson染色后,肺肌细胞、红细胞被染成红色,而分布在细胞间隙的胶原纤维被染成蓝色,胞核呈蓝褐色[7]。
1.2.6 qRT-PCR检测各组大鼠肺组织TGF-β1、Smad2、Smad7 mRNA表达取各组大鼠10%肺组织,常规提取肺组织细胞总RNA,测定RNA浓度,同时进行RNA完整性测定[8]。采用多基因梯度进行qRT-PCR反应,设计目标蛋白mRNA引物序列,反应过程以及条件:75℃预变性120 s;90℃变性5 min;60℃退火60 s;72℃延伸30 s;40个循环。以U6为内参,U6 F:5′-GATCTGCTATCCCACGGA-3′,R:5′-CTGACCAGCCATAGCCAGA-3′,TGF-β1 mRNA F:5′-GGAGCACTGAACGCACAGA-3′,R:5′-CTACGGAGATTCAAACTCGTG-3′,Smad2 mRNA F:5′-ATGCCGAGGAACAGATATCTA-3′,R:5′-CGACCATATCGCACGAGTGCA-3′,Smad7 mRNA F:5′-ATATCGGCCTATACTCGAT-3′,R:5′-CAGGATGCTAGTCGTAATGTA-3′。以2-ΔΔCt表示目的基因相对表达。
1.2.7 免疫组化检测各组大鼠肺组织MMP-13和TIMP-1表达取各组大鼠10%肺组织,10%甲醛固定,包埋,切片,脱蜡,PBS缓冲液修复2 h,室温下3%过氧化氢浸泡,封闭,分别加一抗(1:1 000)4℃孵育过夜,次日PBS洗涤,分别加二抗(1:1 000),室温孵育30 min,PBS洗涤。加适量DAB孵育5 min,去离子水终止反应,苏木素复染5 min,无菌水冲洗,梯度乙醇脱水2 h,无菌滤纸吸净表面残存液体,中性树胶封片,显微镜下观察并拍照,随机取3个区域,计数视野中总细胞数以及阳性染色细胞数。目标蛋白表达率(%)=阳性染色细胞数/视野中总细胞数×100%。
1.2.8 Western blot检测各组大鼠肺组织TGF-β1、p-Smad2和p-Smad7表达取各组大鼠10%肺组织,常规裂解,冰浴5 min,离心,取上清,BCA测定蛋白浓度,凝胶电泳分离蛋白,转至PVDF膜,5%TBST液室温封闭2 h,加入一抗稀释液(1:1 000)4℃孵育过夜。次日冲洗干净,加入二抗(1:10 000)室温孵育,DAB显色,以GAPDH为内参,E-Gel Imager凝胶成像仪检测,计算目的蛋白相对表达。
1.3 统计学分析采用SPSS16.0软件进行统计学分析,采用Graphpad5.01软件作图,组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠、BALF中嗜中性粒细胞、总细胞数以及肺组织W/D比较与正常组相比,模型组大鼠BALF中嗜中性粒细胞和总细胞数及肺组织W/D明显升高(P<0.05),与模型组相比,实验组、对照组大鼠BALF中嗜中性粒细胞和总细胞数以及肺组织W/D明显降低(P<0.05),实验组和对照组差异无统计学意义(P>0.05,图1)。
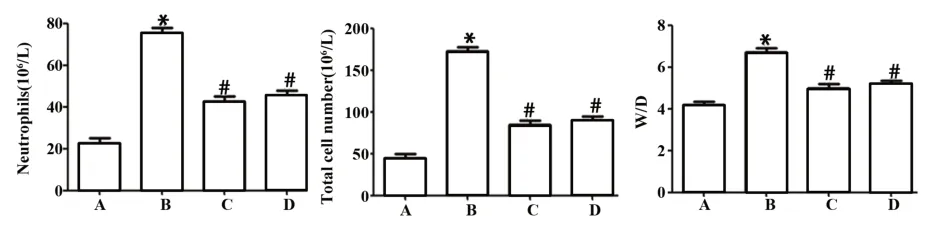
图1 各组大鼠BALF中嗜中性粒细胞和总细胞数及肺组织W/DFig.1 Number of neutrophils and total cell number in BALF and W/D of lung tissues of rats in each group
2.2 各组大鼠肺组织解剖学、组织病理学及纤维化比较各组大鼠肺组织解剖学改变结果显示,正常组大鼠肺组织颜色呈粉红色,表面光滑,质地柔软、饱满富有弹性,肺组织表面无出血点,无斑点,被膜无紧张,切面无渗出;模型组大鼠肺组织表面皱缩严重,取出肺组织时有泡沫样黏液流出,肺组织明显肿大,肺组织呈灰白色,表面有片状淤血,出血点较多,触摸时有明显结节,同时被膜明显僵硬,切面有渗出;实验组、对照组大鼠肺组织较模型组有明显好转,出血点和淤血区域明显减少。HE染色结果显示,正常组大鼠肺组织结构完整,无充血、扩张及出血现象,肺泡腔结构清晰,肺泡壁厚度均匀,无增宽、渗出等,肺泡间隔及各级支气管管腔内无水肿、无分泌物渗出、无炎症细胞浸润等。与正常组相比,模型组大鼠肺泡出现弥漫性病理实变,肺泡壁厚度不均一,明显变小,间隔明显增宽,腔内大量炎症细胞填充,肺间质中出现大量成纤维细胞。实验组、对照组大鼠肺组织病理症状有所缓解,肺泡大小均一,腔内少量水肿液填充,炎症细胞明显减少,间质内成纤维细胞数有所减少。Masson染色结果显示,正常组大鼠肺组织结构清晰,视野内未见蓝绿色胶原纤维沉积出现。与正常组相比,模型组大鼠肺组织间质中可见成片蓝绿色胶原纤维沉积,分布均匀。实验组、对照组大鼠肺组织间质中蓝绿色胶原纤维沉积分布区域明显减少(图2)。
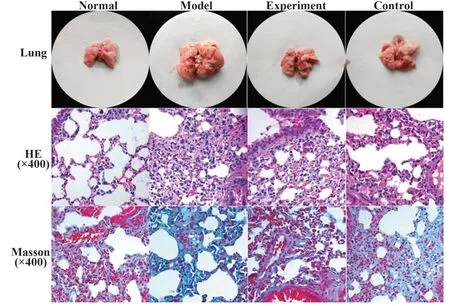
图2 肺组织病理变化Fig.2 Pathological changes of lung tissue
2.3 免疫组化检测各组大鼠肺组织MMP-13和TIMP-1表达免疫组化结果显示,与正常组相比,模型组大鼠肺组织TIMP-1表达明显升高,MMP-13表达明显降低(P<0.05),与模型组相比,药物干预后,实验组、对照组大鼠肺组织TIMP-1表达明显降低,MMP-13表达明显升高(P<0.05)。实验组和对照组差异无统计学意义(P>0.05,图3)。
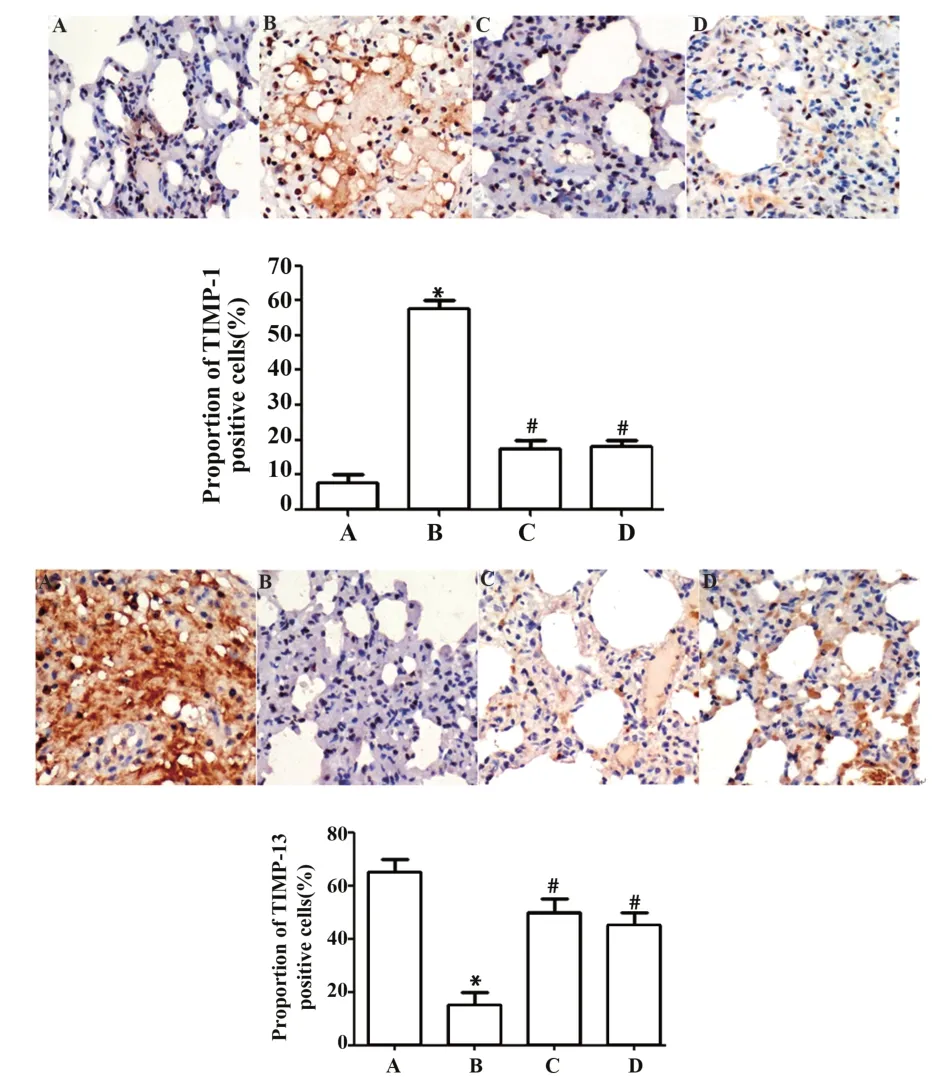
图3 免疫组化检测TIMP-1、MMP-13表达(×400)Fig.3 Immunohistochemistry detection of expressions of TIMP-1 and MMP-13(×400)
2.4 qRT-PCR检测各组大鼠肺组织TGF-β1、p-Smad2和p-Smad7 mRNA表 达RT-PCR检 测 结 果显示,与正常组相比,模型组大鼠肺组织TGF-β1、Smad2 mRNA表达明显升高(P<0.05),Smad7 mRNA表达明显降低(P<0.05),与模型组相比,药物干预后,实验组、对照组大鼠肺组织TGF-β1、Smad2 mRNA表达明显降低(P<0.05),Smad7 mRNA表达明显升高(P<0.05);实验组和对照组差异无统计学意义(P>0.05,图4)。

图4 qRT-PCR检测TGF-β1、Smad2和Smad7 mRNA表达Fig.4 TGF-β1,Smad2 and Smad7 mRNA expressions detected by qRT-PCR
2.5 Western blot检测各组大鼠肺组织中TGF-β1、p-Smad2和p-Smad7表达Western blot结果显示,与正常组相比,模型组大鼠肺组织TGF-β1、p-Smad2表达明显升高,p-Smad7表达明显降低(P<0.05),与模型组相比,实验组和对照组大鼠肺组织TGF-β1、p-Smad2表达明显降低,p-Smad7表达明显升高(P<0.05);实验组和对照组差异无统计学意义(P>0.05,图5)。
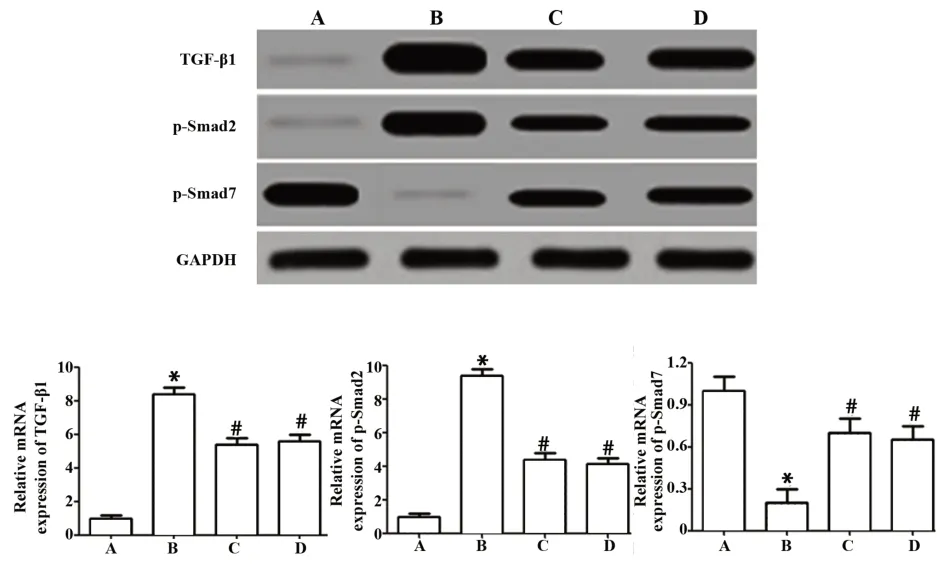
图5 各组大鼠肺组织中TGF-β1、p-Smad2和p-Smad7表达Fig.5 Expressions of TGF-β1,p-Smad2 and p-Smad7 in lung tissues of rats in each group
3 讨论
PF是一种弥漫性致死率极高的肺间质疾病,其基本病理实质为多种因素(肿瘤、持续性辐射、放疗与化疗等)诱发的肺部损伤导致肺部细胞ECM过度积累,肺组织结构被破坏,影响患者肺功能,尚无快速有效的治疗手段[9]。因此阐明PF的分子机制,及时降解ECM,对临床治疗PF具有重大意义。
氨基胍分子式为CH6N4,是一种肼类小分子,具有1个亲核羰基基团,可导致多种氧化还原酶失活,在糖尿病肾病及心脏移植中广泛应用。近年研究发现,氨基胍对器官纤维化病变中具有良好的抑制作用。MAGDALENO等[10]研究发现,糖尿病小鼠模型中氨基胍可通过抑制ERK/Smad通路传导抑制胶原纤维合成,保护心脏免受纤维化损伤。YAO等[11]研究表明,氨基胍预处理可明显减轻自发性高血压大鼠心肌纤维化。AHMAD等[12]研究证实,氨基胍可抑制阿米卡星诱导的氧化应激作用。LV等[13]研究证实,氨基胍可降低肾小球细胞中MMP-9表达,抑制肾间质纤维化历程,保护糖尿病肾病大鼠肾脏。本研究通过气管滴注博莱霉素构建大鼠PF模型,结果表明,与模型组相比,实验组大鼠肺组织W/D明显降低,解剖学和PF组织病理明显改善,胶原沉积区域明显减小,肺组织中MMPs/TIMPs表达趋于平衡,表明氨基胍对PF治疗效果良好。
TGF-β1/Smads是国际公认的致器官纤维化关键信号通路。TGF-β1被认为是最重要的肺脏致纤维化作用因子之一[14]。研究表明,TGF-β1高表达是PF形成的中心环节,尤其是在肺成纤维细胞中[15]。张丹等[16]研究证实,TGF-β1可明显促进新生大鼠成纤维细胞体外增殖,促进其纤维化转换。Smads蛋白在肺间质纤维化细胞外基质形成中发挥重要作用。Smad2是TGF-β1的受体蛋白,可将信号转移至核内启动胶原基因表达;Smad7是丝氨酸/苏氨酸激酶(serine/threonine kinase,STK)的拮抗蛋白,阻止激活型Smad2磷酸化。LI等[17]研究证实,抑制Smad2磷酸化可明显减轻由二氧化硅诱导的肺纤维化。LUO等[18]研究证实,抑制TGF-β1表达,抑制Smad2磷酸化,增强Smad7磷酸化水平可明显抑制博来霉素诱导的大鼠PF历程。ZHANG等[19]研究报道,抑制TGF-β1/Smad2通路可有效保护博来霉素诱导的大鼠PF。NAMGUNG等[20]研究证实,氨基胍可明显抑制TGF-β1/Smad通路,抑制纤维化,保护糖尿病肾病大鼠肾脏组织。本研究发现,与模型组相比,实验组大鼠肺组织中TGF-β1和p-Smad2 mRNA和蛋白表达明显降低,p-Smad7 mRNA和蛋白表达明显升高。因此推测氨基胍对博来霉素诱导的大鼠PF的保护作用可能与调控TGF-β1/Smads信号通路表达有关。
综上所述,氨基胍可保护博来霉素诱导的PF大鼠肺组织,可能通过调控TGF-β1/Smads信号通路,抑制TGF-β1和p-Smad2表达,增强p-Smad7表达发挥抗纤维化作用。但氨基胍是否通过其他通路影响PF进程有待进一步研究。

