影响息肉状脉络膜血管病变抗VEGF治疗后OCTA指标变化的房水靶细胞因子分析
徐青 乔磊 宫朝举 冯瑞芳 刘亚鲁 孙永承 张翼鹏 李甦雁
徐州医科大学附属徐州市立医院眼科 徐州市第一人民医院 徐州市眼病防治研究所 221116
息肉状脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)多发生于50岁以上亚洲人群,其特征是脉络膜血管末端息肉样病变,伴或不伴有异常分支血管网(branching vascular network,BVN)[1-2]。PCV可诱导慢性复发性视网膜下出血及渗出,导致反复性黄斑区浆液性或出血性视网膜色素上皮脱离(pigment epithelial detachment,PED)及视网膜水肿,其中PED是临床诊断PCV的重要眼底征象[2-3],若诊疗不当最终发生脉络膜视网膜萎缩或盘状瘢痕,导致患者视力不可逆丧失[4]。目前吲哚青绿血管造影(indocyanine green angiography,ICGA)是诊断PCV的金标准,但ICGA为有创检查方法,且存在受检者对造影剂发生变态反应风险,而光相干断层扫描血管成像(optical coherence tomography angiography,OCTA)在显示PCV息肉、PED及双层征征象方面敏感性和特异性好,且具有高分辨率、无创、可量化分析等优点,逐渐用于PCV的诊断和病情的监测[1,5-6]。目前PCV的发病机制尚未完全阐明,有研究发现,PCV眼房水中血管内皮生长因子(vascular endothelial growth factor,VEGF)含量显著升高,血管生成和炎症反应过程在PCV的发病过程中发挥重要作用[7]。抗VEGF药物玻璃体腔注射已成为PCV的一线治疗方法,能有效减少视网膜下液(subreinal fluid,SRF)、降低黄斑中心凹厚度(central macular thickness,CMT),改善患者视功能并稳定视力[8-10]。然而,临床工作中发现PCV患者对抗VEGF治疗的反应却不相同。了解PCV患眼抗VEGF治疗后影响CMT和SRF变化的靶细胞因子无疑对分析药物的作用机制和患者对治疗的应答具有重要意义,目前尚缺乏能够预测PCV患眼对抗VEGF治疗后针对OCTA指标变化的靶因子研究。本研究拟探讨影响PCV患者康柏西普治疗后OCTA指标变化的房水靶细胞因子,为加深PCV病理机制的理解及治疗靶点的选择提供参考依据。
1 资料与方法
1.1 一般资料
采用横断面研究方法,纳入2017年7月至2020年7月于徐州市第一人民医院眼科确诊为PCV的患者20例20眼作为PCV组,其中男10例,女10例;年龄51~81岁,平均(69.35±8.99)岁;右眼6眼,左眼14眼。纳入同期在徐州市第一人民医院眼科接受白内障超声乳化摘出术的单纯白内障患者16例16眼作为白内障对照组,其中男7例,女9例;年龄45~86岁,平均(68.13±12.49)岁;右眼10眼,左眼6眼。PCV组与白内障组间患者年龄、性别构成比及眼别构成比比较差异均无统计学意义(t=-0.342,P=0.734;P=0.749;P=0.091)。PCV患者中,ICGA检查显示息肉样病灶位于中心凹者9眼,位于中心凹外者11眼;病灶呈单发者16眼,呈簇状者4眼;息肉样病灶最大直径平均为[506.50(322.50,1 157.75)]μm,面积平均为[0.22(0.13,1.13)mm2];病灶总面积平均为[25.32(11.46,34.05)mm2];有或无BVN分别为16眼和4眼,BVN面积平均为(4.35±2.75)mm2。OCTA影像显示PCV患眼存在视网膜内液4眼、多发PED18眼、指状PED8眼、PED切迹9眼。PCV组患者纳入标准[2]:(1)年龄>50岁;(2)经荧光素眼底血管造影、ICGA、OCTA等检查确诊,且同时存在黄斑区视网膜水肿、SRF及PED者;(3)出现视力下降;(4)双眼发病患者选病情严重一侧眼。排除标准:(1)既往有PCV治疗史者,包括糖皮质激素应用、抗VEGF药物玻璃体内注射、光动力疗法、视网膜格栅激光光凝、玻璃体切割术等;(2)合并其他可能影响视力或引起眼底新生血管的眼部疾病者,如糖尿病视网膜病变、病理性近视、年龄相关性黄斑变性、黄斑前膜、青光眼、视网膜静脉阻塞、脉络膜炎或葡萄膜炎等。(3)屈光间质混浊、固视不良、眼底大量出血影响成像者;(4)严重心脑血管疾病、全身性免疫疾病患者;(5)有手术史、外伤史或药物变态反应史患者。白内障组患者排除标准:(1)有任何其他眼部疾病;(2)有严重心脑血管疾病、全身性免疫疾病患者。本研究遵循《赫尔辛基宣言》,经徐州市第一人民医院伦理委员会审核批准(批文号:xyyll[2020]27号),所有患者均了解本研究的方法和目的并自愿签署知情同意书。
1.2 方法
1.2.1康柏西普玻璃体腔注射方法 所有手术均由同一位有经验的医师完成。所有患者均接受3+PRN康柏西普治疗方案,即每月注射1次,连续注射3个月。玻璃体腔注射前3 d均嘱患者用0.5%左氧氟沙星滴眼液(中国参天制药公司)点眼,4次/d。术眼常规消毒铺巾,用盐酸丙美卡因滴眼液(美国爱尔康眼药厂)点眼3次行表面麻醉,用聚维酮碘溶液冲洗眼部、结膜囊3次,采用30号一次性无菌注射针头于颞下方距角膜缘3.5 mm处睫状体平坦部垂直进入玻璃体腔,注射康柏西普(中国康弘制药公司)0.5 mg/0.05 ml,术毕消毒棉签轻压针口10 s;结膜囊涂氧氟沙星眼膏(沈阳兴齐制药公司),术眼包扎。术后左氧氟沙星滴眼液点眼3 d,4次/d。
1.2.2房水细胞因子质量浓度测定 分别于首次和第3次玻璃体注药前用带30G针头的胰岛素注射器在PCV患眼角膜缘内1 mm处行前房穿刺,无菌抽取房水100 μl,置入0.5 ml灭菌Eppendorf管中,-80 ℃保存。白内障组术眼手术前以相同方法采集等量房水。采用Luminex平台测定血管生成及炎症因子试剂盒(HAGPIMAG-12K-13,美国默克公司)中的13种细胞因子水平,包括炎性因子白细胞介素8(interleukin-8,IL-8),促生长相关因子表皮生长因子(epidermal growth factor,EGF)、骨形成蛋白9(bonemorphogeneticproteins 9,BMP-9)、瘦素、肝细胞生长因子(hepatocyte growth factor,HGF)、肝素结合表皮生长因子(heparin-binding EGF-like growth factor,HB-EGF)、成纤维细胞生长因子2(fibroblast growth factor-2,FGF-2),血管生成相关因子血管生成素2(angiopoietin-2,Ang-2)、细胞膜糖蛋白、内皮素1、卵泡抑制素、胎盘生长因子(placental growth factor,PLGF)、VEGF-A。利用Luminex内置的xPONENT Flex MAP 3D系统读取数据,采用Milliplex Analyst 5.1软件、通过五参数曲线拟合算法分析数据。
1.2.3眼科检查 所有PCV患眼分别于治疗前和第3次玻璃体腔注射前均行眼科检查。采用国际标准视力表测量BCVA并转换为LogMAR视力;采用非接触眼压计(TX-20,日本佳能公司)测量眼压。采用Spectralis HRA+OCT设备(德国Heidelberg公司)进行荧光素眼底血管造影(fundus fluorescein angiography,FFA)及ICGA检查,以评估息肉样病灶位置(中心凹/中心凹外)、息肉类型(单发/簇状)、息肉数量(单个/多个),测量息肉样病灶最大直径、面积和病灶总面积,记录患眼是否存在BVN及其面积,确定PCV患眼基线眼部特征。采用OCTA(美国Optovue公司)gride模式和angio retina 6 mm×6 mm模式对病灶周围进行扫描,判断是否存在SRF、视网膜内液、PED、多发PED、指状PED、PED切迹,获得黄斑中心凹1 mm直径范围内CMT、扫描区域内SRF高度(SRF height,SRFH)、PED高度(PED height,PEDH)及PED直径(PED diameter,PEDD)。CMT由计算机软件自动测量,其他参数均由2位经验丰富的眼科医生手动测量3次,取平均值。

表1 治疗前PCV组与白内障组房水中细胞因子质量浓度比较(pg/ml)Table 1 Comparison of the cytokine concentrations in aqueous humor between PCV group and control group before treatment (pg/ml)组别眼数IL-8(mean±SD)aEGF[M(Q1,Q3)]b瘦素[M(Q1,Q3)]bHGF(mean±SD)aHB-EGF(mean±SD)a白内障组162.68±1.661.03(0.88,1.12)57.08(52.21,60.56)482.67±300.871.23±0.41PCV组2011.27±4.861.07(0.94,1.15)67.37(57.95,84.89)853.49±300.251.46±0.44t/Z值-7.391-0.29-2.347-3.679-1.636P值<0.0010.7730.0180.0010.111组别眼数FGF-2[M(Q1,Q3)]bAng-2(mean±SD)a内皮素1(mean±SD)aPLGF(mean±SD)aVEGF-A(mean±SD)a白内障组1623.67(15.46,31.52)15.21±7.975.90±2.951.34±0.57136.72±65.84PCV组2038.40(31.52,66.71)35.92±18.6310.54±4.061.52±0.67222.28±88.07t/Z值-2.907-4.485-3.828-0.846-3.230P值 0.003<0.0010.0010.4030.003 注:(a:独立样本t检验;b:Mann-Whitney U检验) PCV:息肉状脉络膜血管病变;IL-8:白细胞介素8;EGF:表皮生长因子;HGF:肝细胞生长因子;HB-EGF:肝素结合的表皮生长因子;FGF-2:成纤维细胞生长因子2;Ang-2:血管生成素2;PLGF:胎盘生长因子;VEGF-A:血管内皮细胞生长因子A Note:(a:Independent t test;b:Mann-Whitney U test) PCV:polypoidal choroidal vasculopathy;IL-8:interleukin-8;EGF:epidermal growth factor;HGF:hepatocyte growth factor;HB-EGF:heparin-binding EGF-like growth factor;FGF-2:fibroblast growth factor-2;Ang-2:angiopoietin-2;PLGF:placental growth factor;VEGF-A:vascular endothelial growth factor-A
1.2.4评价指标 (1)PCV组与白内障组上述各细胞因子质量浓度比较;(2)PCV组治疗前后上述各细胞因子质量浓度变化;(3)治疗前后患眼相关临床特征变化,包括BCVA、眼压、CMT、SRFH、PEDH和PEDD,其中CMT定义为以黄斑中央凹为中心的1 mm直径范围内的内界膜(inner limiting membrane,ILM)层至视网膜色素上皮(retinal pigment epithelium,RPE)层平均视网膜厚度,由计算机软件自动获得;PEDH和PEDD分别定义为PED顶部到RPE层的最大距离和PED病变两端的最大距离;SRFH为整个扫描区域内SRF的最大高度[11-12];除CMT外,所有参数均由两位经验丰富的眼科医生手动测量3次,取平均值;(4)影响抗VEGF疗效的细胞因子筛选:分析细胞因子基线水平与治疗前后OCTA相关指标变化值的关系;(5)影响OCTA指标变化的靶细胞因子:以CMT和SRFH作为因变量,以相关分析中概率值<0.05的因子VEGF-A、内皮素-1、IL-8、HGF作为自变量,采用逐步法行多重线性回归分析。
1.3 统计学方法
采用SPSS 19.0统计学软件进行统计分析。计量资料经Shapiro-Wilk检验接近正态分布的数据表资料以mean±SD表达,偏态分布的数据资料以M(Q1,Q3)表达。计数资料以频数和百分数表达,计数资料差异比较采用Fisher精确概率法。PCV组与对照组间正态分布的计量指标差异比较采用独立样本t检验,偏态分布计量指标差异比较采用Mann-Whitney U检验;PCV组患眼治疗前后房水细胞因子质量浓度差异比较依照是否满足正态分布分别采用配对t检验和Wilcoxon符号秩检验;关于PCV组房水细胞因子水平与OCTA临床相关指标测量值的关系评估,正态分布计量指标采用Pearson直线相关分析,偏态分布计量指标采用Spearman秩相关分析,对相关系数进行t检验,将P<0.05的细胞因子纳入影响OCTA临床相关指标测量值的自变量。以CMT和SRFH变化值作为因变量,以房水VEGF-A、内皮素1、IL-8、HGF质量浓度作为自变量,采用逐步多重线性回归模型评估影响治疗前后OCTA指标变化值的靶因子,对偏回归系数进行假设检验。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前PCV组与白内障组房水中细胞因子水平比较
与白内障组比较,治疗前PCV组患眼房水中IL-8、瘦素、HGF、FGF-2、Ang-2、内皮素1、VEGF-A质量浓度明显升高,差异均有统计学意义(均P<0.05);各组间EGF、HB-EGF、PLGF质量浓度比较差异无统计学意义(均P>0.05),2个组间BMP-9、细胞膜糖蛋白、卵泡抑制素质量浓度均低于检测限,均未检出(表1)。
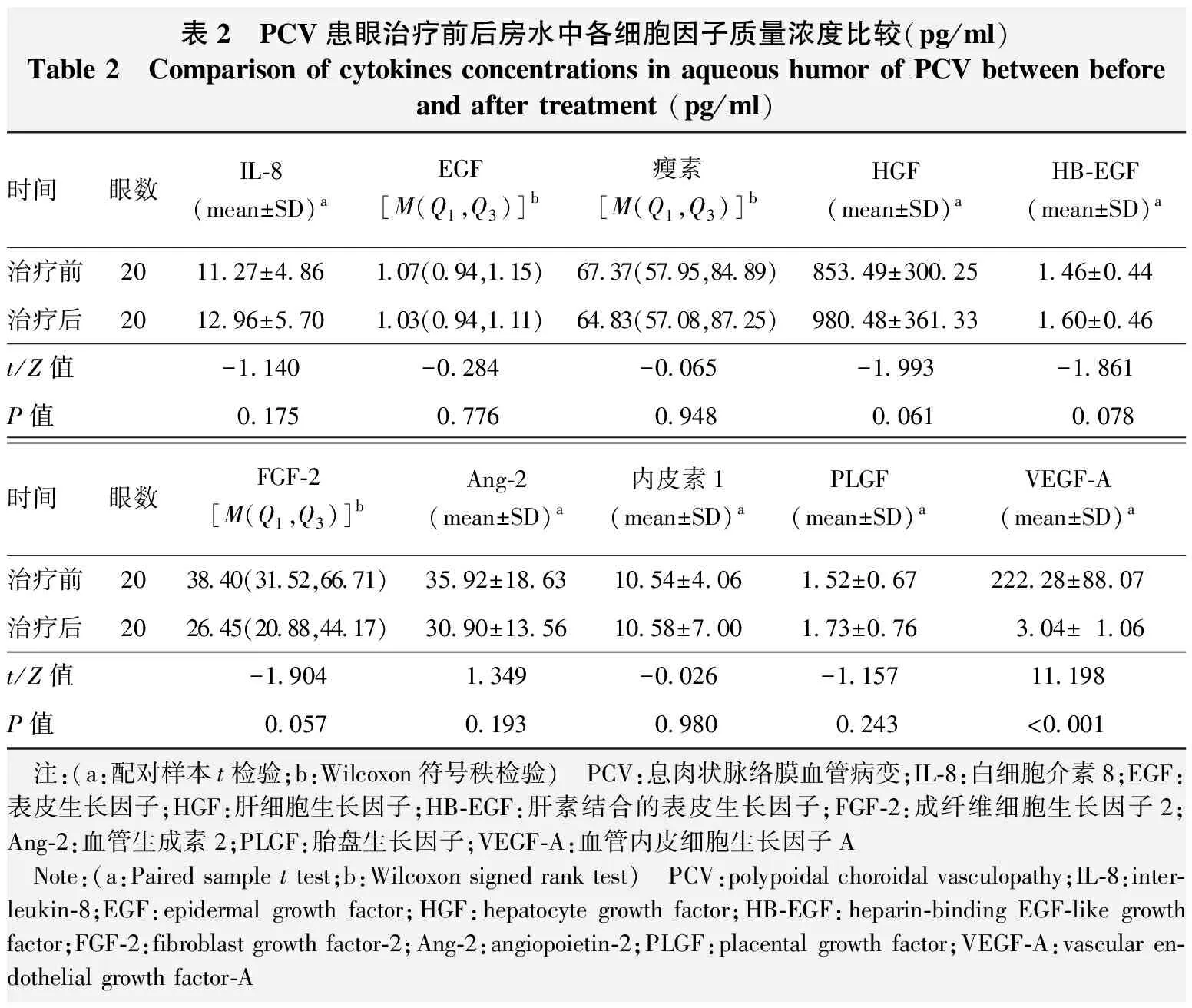
表2 PCV患眼治疗前后房水中各细胞因子质量浓度比较(pg/ml)Table 2 Comparison of cytokines concentrations in aqueous humor of PCV between before and after treatment (pg/ml)时间眼数IL-8(mean±SD)aEGF[M(Q1,Q3)]b瘦素[M(Q1,Q3)]bHGF(mean±SD)aHB-EGF(mean±SD)a治疗前2011.27±4.861.07(0.94,1.15)67.37(57.95,84.89)853.49±300.251.46±0.44治疗后2012.96±5.701.03(0.94,1.11)64.83(57.08,87.25)980.48±361.331.60±0.46t/Z值-1.140-0.284-0.065-1.993-1.861P值0.1750.7760.9480.0610.078时间眼数FGF-2[M(Q1,Q3)]bAng-2(mean±SD)a内皮素1(mean±SD)aPLGF(mean±SD)aVEGF-A(mean±SD)a治疗前2038.40(31.52,66.71)35.92±18.6310.54±4.061.52±0.67222.28±88.07治疗后2026.45(20.88,44.17)30.90±13.5610.58±7.001.73±0.763.04±1.06t/Z值-1.9041.349-0.026-1.15711.198P值0.0570.1930.9800.243<0.001 注:(a:配对样本t检验;b:Wilcoxon符号秩检验) PCV:息肉状脉络膜血管病变;IL-8:白细胞介素8;EGF:表皮生长因子;HGF:肝细胞生长因子;HB-EGF:肝素结合的表皮生长因子;FGF-2:成纤维细胞生长因子2;Ang-2:血管生成素2;PLGF:胎盘生长因子;VEGF-A:血管内皮细胞生长因子A Note:(a:Paired sample t test;b:Wilcoxon signed rank test) PCV:polypoidal choroidal vasculopathy;IL-8:inter-leukin-8;EGF:epidermal growth factor;HGF:hepatocyte growth factor;HB-EGF:heparin-binding EGF-like growth factor;FGF-2:fibroblast growth factor-2;Ang-2:angiopoietin-2;PLGF:placental growth factor;VEGF-A:vascular en-dothelial growth factor-A
2.2 PCV组患眼治疗前后房水中细胞因子质量浓度比较
与治疗前相比,治疗后PCV患眼房水中VEGF-A质量浓度明显降低,差异有统计学意义(P<0.001),PCV患眼治疗前后房水中IL-8、EGF、瘦素、HGF、HB-EGF、FGF-2、Ang-2、内皮素1、PLGF质量浓度比较差异无统计学意义(均P>0.05)(表2)。
2.3 PCV组患眼治疗前后相关临床指标比较
与治疗前比较,治疗后PCV患眼BCVA显著提高,CMT、SRFH、PEDH、PEDD值均明显下降,差异均有统计学意义(均P<0.05);65%(13/20)的患眼SRF完全吸收;治疗前后眼压比较差异无统计学意义(P>0.05)(表3)。
2.4 影响OCTA相关指标变化值的细胞因子分析
相关分析结果显示,PCV患眼房水中内皮素1质量浓度与CMT变化值呈负相关(r=-0.485,P<0.05),VEGF-A质量浓度与CMT变化值呈正相关(r=0.592,P<0.05);房水中IL-8和HGF质量浓度与SRFH变化值均呈正相关(r=0.492、0.466,均P<0.05);HGF质量浓度与PEDH变化值呈正相关(rs=0.489,P<0.05);其他检测的细胞因子与OCTA形态学指标变化值均无明显相关性(均P>0.05)(表4)。多重线性回归分析显示,内皮素1对CMT变化值无明显影响(P>0.05);治疗前房水VEGF-A质量浓度高者CMT变化值较大,回归方程为CMT变化值=24.400-0.836×VEGF-A,基线VEGF-A每增加1 pg/ml,CMT值降低0.836 μm,差异有统计学意义(P=0.006)。HGF对SRFH变化值无明显影响(P>0.05);治疗前房水IL-8质量浓度高者SRFH变化值较大,回归方程为SRFH=-52.122-12.522×IL-8,基线IL-8每增加1 pg/ml,SRFH值降低12.522 μm,差异有统计学意义(P=0.028)(表5),表明PCV患眼治疗前房水VEGF-A和IL-8质量浓度较高者CMT和SRFH对抗VEGF治疗敏感。

表4 PCV患眼房水中细胞因子质量浓度与OCTA相关指标变化值相关性Table 4 Relationship between cytokine concentration in aqueous humor and changes of OCTA parameters before and after treatment细胞因子质量浓度CMT变化值SRFH变化值PEDH变化值PEDD变化值r/rs值P值r/rs值P值rs值P值rs值P值IL-8-0.0700.769a0.4920.028a0.1490.531b-0.0010.999b瘦素-0.0770.747b0.2040.387b0.1380.562b0.0410.865bHGF0.0490.838a0.4660.038a0.4890.029b0.1140.631bFGF-2-0.1750.460a-0.1890.424a-0.3800.099b-0.2990.201bAng-2-0.1510.526a0.3600.119a0.1890.425b-0.0920.700b内皮素1-0.4850.030a0.1820.441a0.1410.552b-0.1430.548bVEGF-A0.5920.006a-0.0340.887a-0.0240.920b-0.0560.816b 注:(a:Pearson相关分析;b:Spearman秩相关分析) PCV:息肉状脉络膜血管病变;OCTA:光相干断层扫描血管成像;CMT:黄斑中心凹视网膜厚度;SRFH:视网膜下液高度;PEDH:视网膜色素上皮脱离高度;PEDD:视网膜色素上皮脱离直径;IL-8:白细胞介素-8;HGF:肝细胞生长因子;FGF-2:成纤维细胞生长因子2;Ang-2:血管生成素2;VEGF-A:血管内皮生长因子-A Note:(a:Pearson correlation analysis;b:Spearman rank correlation analysis) PCV:polypoidal choroidal vasculop-athy; OCTA:optical coherence tomography angiography;CMT:center macular thickness;SRFH:subretinal fluid height;PEDH:pigment epithelial detachment height;PEDD:pigment epithelial detachment diameter;IL-8:interleukin-8;HGF:hepatocyte growth factor;FGF-2:fibroblast growth factor-2;Ang-2:angiopoietin-2;VEGF-A:vascular endothe-lial growth factor-A
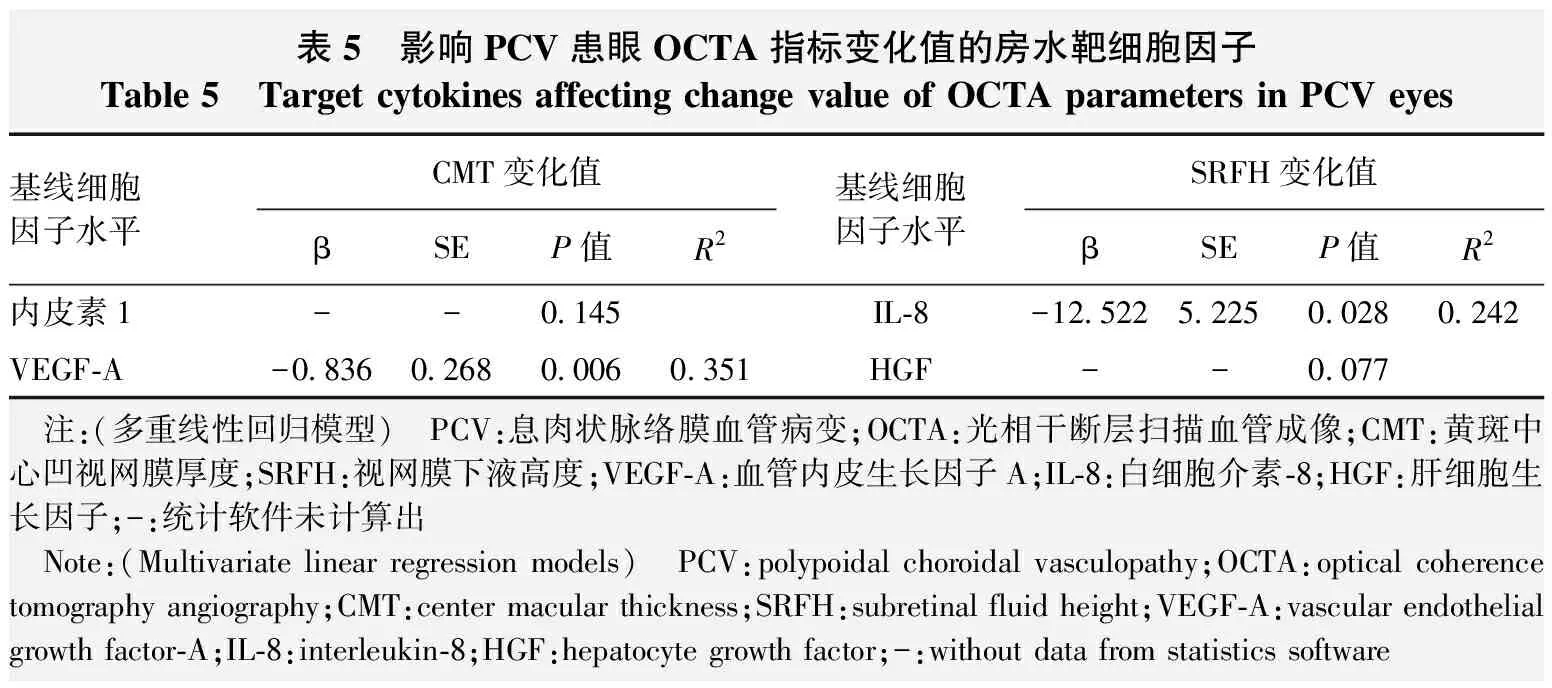
表5 影响PCV患眼OCTA指标变化值的房水靶细胞因子Table 5 Target cytokines affecting change value of OCTA parameters in PCV eyes基线细胞因子水平CMT变化值βSEP值R2基线细胞因子水平SRFH变化值βSEP值R2内皮素1--0.145IL-8-12.5225.2250.0280.242VEGF-A-0.8360.2680.0060.351HGF--0.077 注:(多重线性回归模型) PCV:息肉状脉络膜血管病变;OCTA:光相干断层扫描血管成像;CMT:黄斑中心凹视网膜厚度;SRFH:视网膜下液高度;VEGF-A:血管内皮生长因子A;IL-8:白细胞介素-8;HGF:肝细胞生长因子;-:统计软件未计算出 Note:(Multivariate linear regression models) PCV:polypoidal choroidal vasculopathy;OCTA:optical coherence tomography angiography;CMT:center macular thickness;SRFH:subretinal fluid height;VEGF-A:vascular endothelial growth factor-A;IL-8:interleukin-8;HGF:hepatocyte growth factor;-:without data from statistics software
3 讨论
本研究结果显示,PCV组患者房水中IL-8、瘦素、HGF、FGF-2、Ang-2、内皮素-1和VEGF-A等因子质量浓度较白内障组显著升高,康柏西普玻璃体注射治疗后房水中仅VEGF-A质量浓度显著降低,其他细胞因子均无显著变化,提示这些具有显著差异的细胞因子可能均参与了PCV的发病机制,而康柏西普治疗的主要靶点是VEGF-A,抑制或下调其他细胞因子是否对PCV的治疗发挥作用有待进一步研究。
研究表明玻璃体腔注射抗VEGF药物能够抑制新生血管的生长,达到减少出血和血管渗漏风险的目的,是治疗PCV的有效方法[8-14]。本研究采用OCTA对玻璃体腔注射康柏西普前后的视网膜形态学指标进行定量检测,发现治疗后PCV眼CMT、SRFH、PEDH和PEDD值均显著下降,患眼视力显著提高,眼压无显著变化,与之前的报道一致[2,8]。故康柏西普治疗可以有效提高患者视力,减轻黄斑水肿程度,促进SRF的吸收。
本研究结果显示,PCV患者治疗前房水中HGF质量浓度与治疗前后PEDH变化值呈正相关。有研究表明,HGF是RPE屏障功能的主要调节因子,RPE细胞中HGF过表达能够诱导脉络膜慢性炎症及慢性、浆液性视网膜脱离[15],提示HGF可能通过引起PCV患者RPE屏障功能障碍参与PED的发生机制。此外,本研究结果显示房水中内皮素1、VEGF-A质量浓度与抗VEGF治疗前后CMT变化量相关,VEGF-A是CMT变化值的影响因素,表明基线房水VEGF-A质量浓度可预测PCV患者对抗VEGH治疗的应答,即基线房水中VEGF-A质量浓度高者治疗后CMT改善更明显。Hillier等[16]研究发现,糖尿病黄斑水肿(diabetic macular edema,DME)患者基线VEGF-A质量浓度越高,抗VEGF治疗恢复CMT的改变越不理想,与本研究结果不一致,可能与DME和PCV的发病机制不同有关,值得进一步探讨[4,17]。
SRF的产生与新生血管形成、血管通透性增加、视网膜下反复出血渗出有关[18]。SRF作为一种视网膜病理特征,其对PCV治疗效果的影响目前仍存在争议[9,19]。有研究表明,基线SRF质量浓度对抗VEGF治疗后患眼视力的恢复无明显影响,SRF的复发与视力下降有一定的关联[20-22];也有研究表明SRF的消退与视力改善有关,能够反映PCV病情的严重程度[11],SRF与PCV患者长期视力结果的关系仍需进一步验证。IL-8是一种由缺血的视网膜内皮细胞和胶质细胞产生的促炎和促血管生成因子,主要参与视网膜脉络膜的炎性过程,IL-8水平升高能够促进血管内皮细胞的增生、血管的生成及血管通透性的增加[15,17]。有临床研究表明,IL-8在PCV的发病过程中发挥重要作用[7,23]。本研究结果显示,基线房水IL-8质量浓度明显影响PCV患者抗VEGF治疗的SRFH变化值,治疗前房水中IL-8质量浓度高者治疗后SRFH的改善更明显,提示IL-8可能通过促进血管生成和炎症反应参与SRF的形成。
本研究结果提示VEGF-A和IL-8对PCV眼抗VEGF药物治疗后OCTA形态学指标变化有较好的预测作用,这两种细胞因子的基线房水水平高者患眼治疗后CMT和SRF的改善更好,对PCV治疗预后评估有重要意义。本研究的局限性在于本研究仅为横断面研究且纳入的样本量较小,未对PCV患者采用抗VEGF治疗后患眼房水细胞因子变化对相关临床指标变化的影响进行动态地、长期地观察。PCV是一种易复发性疾病,本研究结果尚不足以说明抗VEGF治疗过程中各种房水细胞因子对疾病变化的影响是否发生变化,因此有待大样本量及长期随访观察研究或设计良好的前瞻性研究对本研究结果加以验证。此外,本研究尚未对脉络膜及息肉消退情况进行观察,有待进一步研究。
利益冲突所有作者均声明不存在利益冲突

