miR-625在胃癌患者血清中的表达及与胃蛋白酶原水平的相关性*
王 伟,郑水平,罗 琴
(荆门市中医医院 1.脾胃一科;2.脾肺病科,荆门 448000)
胃癌是一种起源于胃黏膜细胞的常见恶性肿瘤,发病率男性高于女性,且多发于中老年人群。由于人们不良生活习惯和生活环境影响,近年来胃癌发病率呈逐年升高趋势[1]。胃癌早期症状与其他胃部疾病相似,不具有典型特征,导致大部分胃癌在早期难以被诊断而进展至中晚期,中晚期胃癌患者生存率极低[2]。探寻胃癌生物标志物、提高早期诊出率是改善患者预后重要手段。研究表明,胃蛋白酶原(Pepsinogen,PG)对慢性胃炎患者胃黏膜损伤具有一定诊断价值[3]。血清胃蛋白酶原Ⅰ(PepsinogenⅠ,PGⅠ)、胃蛋白酶原Ⅱ(Pepsinogen Ⅱ,PGⅡ)及胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(Pepsinogen rate,PGR)可用于胃癌大规模筛查,提高胃癌早期诊断率[4]。Zhang 等[5]研究发现,人脑胶质瘤组织和细胞中miR-625表达水平低于正常脑组织和人星形胶质细胞,其可能通过影响癌细胞周期和凋亡发挥抑癌作用,或许可作为胶质瘤诊断靶点和预后标志物。胃癌组织中miR-625 表达水平及其与PG 相关性如何目前少见相关报道,本研究旨在分析miR-625 与PGⅠ、PGⅡ、PGR 水平相关性及其在胃癌中的诊断价值。
1 对象与方法
1.1 研究对象
选取2016 年2 月至2019 年2 月荆门市中医医院收治的246例胃部疾病患者作为研究对象。经胃镜检查和病理切片检查,根据中华医学会消化病学分会《中国慢性胃炎共识意见》[6]和国际抗癌联盟TNM分期第7版[7],将入组患者分为胃癌组84例,慢性萎缩性胃炎组73例,慢性非萎缩性胃炎组89例。胃癌组中男49 例,女35 例,年龄35~79 岁,平均(63.24±18.37)岁;慢性萎缩性胃炎组中男40 例,女33 例,年龄32~75 岁,平均(61.59±16.13)岁;慢性非萎缩性胃炎组中男52例,女37例,年龄34~76岁,平均(62.05±16.68)岁。纳入标准:①所有入组患者均行胃镜检查和病理切片检查,确诊为相应疾病。②临床及病理资料完整。③近1个月内未服用抗生素类、质子泵抑制剂类药物。排除标准:①合并患有其它部位恶性肿瘤者。②合并患有全身严重感染性疾病者。③心、肾、肝脏功能严重不足者。④有胃部手术史。另选取同期本院体检的89 例健康者作为健康对照组,其中男54例,女35例,年龄31~74岁,平均(61.84±17.95)岁。各组年龄、性别比例比较差异无统计学意义(P>0.05)。本研究经本院伦理委员会批准同意,患者及家属均对本研究知情并签署知情同意书。
1.2 主要仪器和试剂
实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(型号:7900,美国ABI公司)、qRT-PCR试剂盒(货号:RR820A,大连宝生物公司)、总RNA提取试剂盒(货号:KL073,上海康朗生物科技有限公司)、反转录试剂盒(货号:205311,德国Qiagen公司)、PGⅠ酶联免疫吸附(ELISA)试剂盒(货号:JK-(a)-1667,上海晶抗生物工程有限公司)、PGⅡELISA试剂盒(货号:JK-00116,上海晶抗生物工程有限公司)。
1.3 方法
1.3.1 样本采集
所有入组患者和健康者分别于入组时和体检时清晨(7:00~9:00)空腹状态下采集外周静脉血5 mL,4 ℃、3 000 r/min离心20min后,取上清液分装于无菌EP管中,于-80 ℃条件下保存。
1.3.2 血清miR-625表达水平检测
采用qRT-PCR 法检测miR-625 表达水平。Trizol 法提取总RNA 后,反转录获得cDNA,用于qRT-PCR 实验。20 μL 反应体系:10µL Mix Taq II,0.8µL 上游引物,0.8µL 下游引物,2µL cDNA,0.4µL ROX,6.0µL ddH2O。具体反应步骤:95 ℃、35 s,1 循环;95 ℃、5 s;64 ℃、35 s,40 循环。每个样本重复3次,用2-ΔΔCT法计算miR-625表达水平,所用引物如表1所示。

表1 qRT-PCR引物序列
1.3.3 血清PGⅠ、PGⅡ、PGR水平检测
采用ELISA 法检测血清PGⅠ、PGⅡ表达水平并计算PGR 水平,严格按照试剂盒说明书进行操作。
1.4 统计学方法
采用SPSS 23.0 软件进行数据分析,计量资料以均数±标准差()表示,组间比较用t检验;计数资料用百分率(%)表示,组间比较用χ²检验。采用Pearson 法进行相关性分析,采用Logistic 回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清miR-625、PGⅠ、PGⅡ及PGR水平比较
胃癌组、慢性萎缩性胃炎组、慢性非萎缩性胃炎组PGⅡ水平比较差异无统计学意义(P>0.05)。胃癌组、慢性萎缩性胃炎组、慢性非萎缩性胃炎组血清miR-625、PGⅠ及PGR水平均显著低于健康对照组(均P<0.05);胃癌组血清miR-625、PGⅠ及PGR 水平均显著低于慢性萎缩性胃炎组和慢性非萎缩性胃炎组(均P<0.05);慢性萎缩性胃炎组血清miR-625、PGⅠ及PGR水平均显著低于慢性非萎缩性胃炎组(均P<0.05),见表2。

表2 各组血清miR-625、PGⅠ、PGⅡ及PGR水平比较
2.2 血清miR-625、PGⅠ、PGⅡ及PGR水平与胃癌患者临床病理特征关系
血清miR-625、PGⅠ、PGⅡ及PGR 水平在不同年龄、性别、肿瘤直径、浸润深度胃癌患者之间比较,差异无统计学意义(P>0.05)。另外,血清PGⅡ水平在分化程度、TNM 分期、淋巴结转移情况之间比较,差异无统计学意义(P>0.05)。与肿瘤分化程度为高中分化、TNM分期为Ⅰ~Ⅱ期、无淋巴结转移胃癌患者相比,肿瘤分化程度为低分化、TNM 分期为Ⅲ~Ⅳ期、有淋巴结转移的胃癌患者血清miR-625、PGⅠ、PGR水平较低(P<0.05),见表3。

表3 血清miR-625、PGⅠ、PGⅡ及PGR水平与胃癌患者临床病理特征关系
2.3 胃癌患者血清miR-625 与PGⅠ、PGR 水平相关性
胃癌患者血清中miR-625 与PGⅠ水平呈正相关关系(r=0.422,P=0.000),与PGR 呈正相关(r=0.501,P=0.000),见图1、图2。
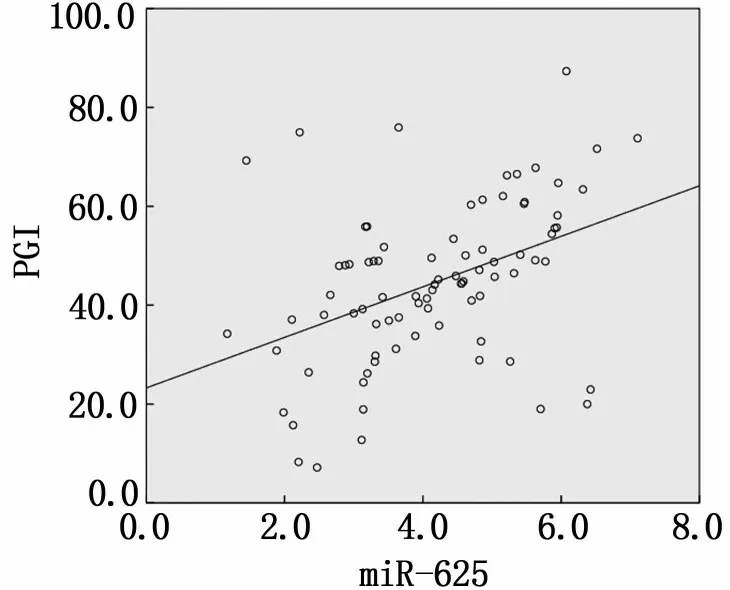
图1 胃癌患者血清中miR-625与PGⅠ水平相关性

图2 胃癌患者血清中miR-625与PGR水平相关性
2.4 胃癌发生危险因素分析
以胃癌是否发生为因变量,TNM 分期、淋巴结转移、PGⅠ水平、PGR 水平及miR-625 水平为自变量进行logistic回归模型分析,结果发现有淋巴结转移、PGⅠ低水平、PGR 低水平及miR-625 低水平是影响胃癌发生的独立危险因素(均P<0.05),见表4。
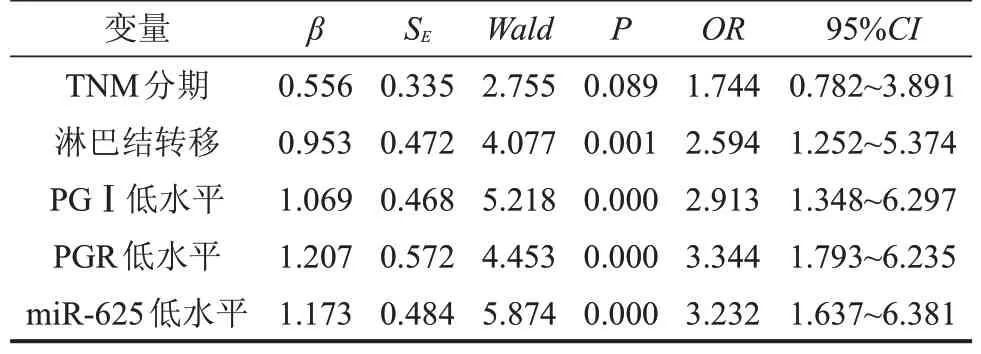
表4 胃癌发生危险因素分析
2.5 血清miR-625、PGⅠ及PGR联合检测对胃癌诊断效能
血清miR-625 预测胃癌敏感度为71.60%,特异度为85.70%,曲线下面积为0.849(图3)。PGⅠ预测胃癌敏感度为66.60%,特异度为84.50%,曲线下面积为0.784(图4)。PGR预测胃癌敏感度为79.70%,特异度为67.90%,曲线下面积为0.769(图5)。三者联合检测预测胃癌敏感度为97.60%,特异度为82.40%,曲线下面积为0.947(图6)。
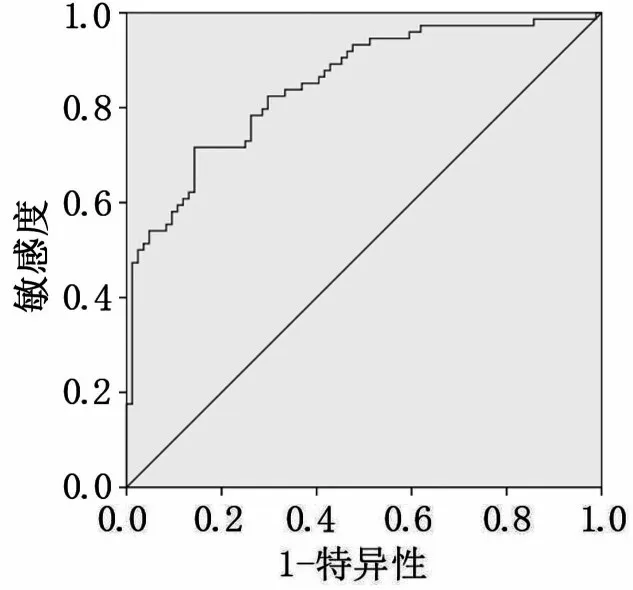
图3 血清miR-625对胃癌诊断效能
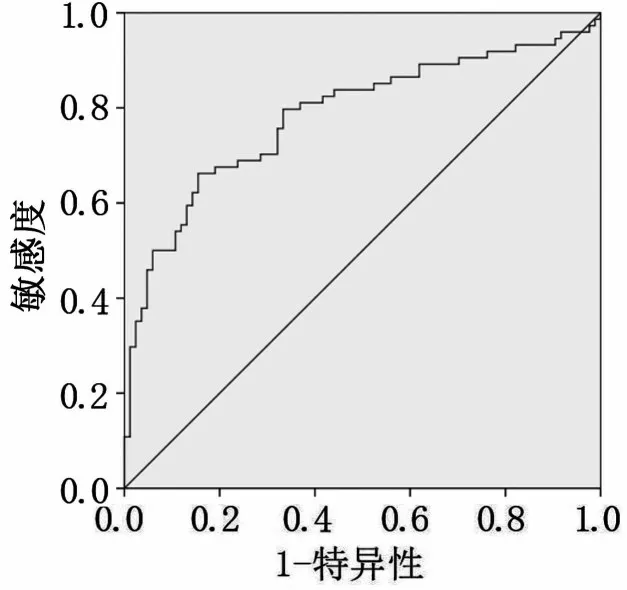
图4 血清PGⅠ对胃癌诊断效能

图5 血清PGR对胃癌诊断效能
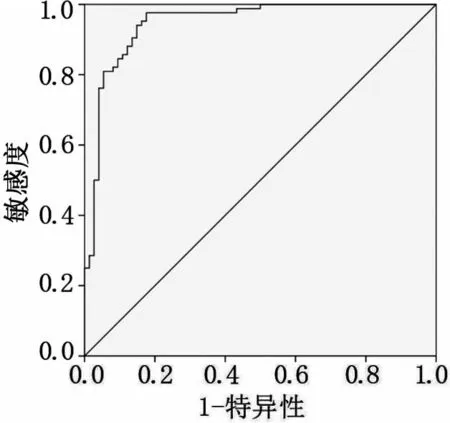
图6 血清miR-625、PGⅠ和PGR联合检测对胃癌诊断效能
3 讨论
PG 是胃蛋白酶前体,由泌酸腺主细胞合成,可反映胃黏膜形态和功能。PGⅠ水平升高与胃酸分泌增多有关,水平降低可能预示胃黏膜腺体萎缩等发生[3]。Su 等[8]研究发现,低PGR 值是萎缩性胃炎发生危险因素。本研究结果显示,血清PGⅠ、PGR在胃癌组、慢性萎缩性胃炎组、慢性非萎缩性胃炎组水平均明显低于健康对照组,提示血清PGⅠ及PGR水平可能与胃部疾病发生有关。本研究中,PGⅡ在各组中水平比较差异无统计学意义,可能原因是PGⅡ成熟腺细胞分泌,来源广泛不具特异性,而PGⅠ主要来源于胃主细胞和粘液细胞,能反映胃黏膜病变水平。
有研究表明,PG对检测胃癌癌前风险病变有一定价值,PGⅠ可能作为早期胃癌诊断标志物[9]。研究报道,血清PGⅠ及PGR水平在对照组、萎缩性胃炎组、胃癌组中逐渐降低[10]。本研究结果显示,与慢性萎缩性胃炎组和慢性非萎缩性胃炎组相比,胃癌组患者血清中PGⅠ、PGR水平均明显降低,与黄喜顺等[10]研究结果相似,提示低水平的血清PGⅠ、PGR水平可能与胃癌发生有关。有研究证实,晚期胃癌组与早期胃癌组患者PGⅠ水平比较,差异显著[11]。徐娟等[12]研究发现,不同TNM分期胃癌患者PGR差异有统计学意义,PGR对胃癌患者病情和预后评估有一定帮助。本研究结果发现,与肿瘤分化程度为高中分化、TNM分期为Ⅰ~Ⅱ期、无淋巴结转移胃癌患者相比,肿瘤分化程度为低分化、TNM 分期为Ⅲ~Ⅳ期、有淋巴结转移的胃癌患者血清PGⅠ、PGR 水平较低,与前人[11-12]研究结果相似,提示胃癌病情进展可能影响血清PGⅠ、PGR水平。
Zhou 等[13]研究报道,肝细胞癌中miR-625 低表达与肿瘤高TNM分期、淋巴结转移、远处转移及总生存期短有关。本研究结果显示,健康对照组、慢性非萎缩性胃炎组、慢性萎缩性胃炎组、胃癌组中miR-625 表达水平依次显著降低,提示miR-625 的表达异常可能与胃癌及不同类型胃炎的发生相关。费玲等[14]研究发现,非小细胞肺癌患者血浆miR-625 表达水平远低于肺良性疾病者,其表达变化与肿瘤的临床分期有关,且可作为临床诊断非小细胞肺癌的分子标记物。有研究证实,miR-625 在胃癌组织中表达水平下调,且低表达miR-625 患者的淋巴结转移、远处转移及总体生存率明显低于高表达miR-625 患者[15]。本研究结果显示,肿瘤分化程度为低分化、TNM分期为Ⅲ~Ⅳ期、有淋巴结转移的胃癌患者血清miR-625水平较低明显低于肿瘤分化程度为高中分化、TNM分期为Ⅰ~Ⅱ期、无淋巴结转移患者,提示miR-625 低表达可能与胃癌发展有关。
幽门螺旋杆菌是影响胃癌发病的主要因素之一,有研究发现,血清PGR 在幽门螺旋杆菌感染患者治疗后水平升高,可作为幽门螺旋杆菌根除治疗成功的评价标准[16]。梁艺钟等[17]研究发现,随着幽门螺杆菌根除率升高,慢性胃炎患者血清PGⅠ水平升高,提示PGⅠ和PGR 水平与幽门螺杆菌感染有关。有研究表明,IL-10基因多态性与幽门螺杆菌阳性患者消化性溃疡风险增加有关。Dong 等[18]研究报道,哮喘患儿血浆miR-625表达水平明显下降,可能通过靶向炎症细胞因子IL-10,导致哮喘发作,提示miR-625 可能通过IL-10 影响幽门螺杆菌感染水平。本研究结果发现,胃癌患者血清中miR-625 与PGⅠ、PGR表达水平呈正相关,提示miR-625与PGⅠ、PGR 之间可能存在相互作用,通过影响患者幽门螺杆菌感染,参与胃癌进展。但具体机制尚需进一步深入研究证实。
进一步研究发现,有淋巴结转移、PGⅠ低水平、PGR低水平及miR-625低水平是影响胃癌发生独立危险因素,进一步提示血清miR-625、PGⅠ、PGR低水平与胃癌发生有关,可能作为生物标志物,对预测胃癌发生有一定意义。本研究还发现,血清miR-625、PGⅠ、PGR 水平均对胃癌有一定诊断价值,但灵敏度或特异度较低,三者联合检测时的敏感度均比三者单独检测时高,提示三者联合检测对胃癌诊断效能较高,可能作为临床胃癌诊断指标。
综上所述,与健康对照组、慢性非萎缩性胃炎组、慢性萎缩性胃炎组相比,胃癌组患者血清中miR-625 表达水平明显降低,与PGⅠ、PGR 水平呈正相关,且与肿瘤分化程度、TNM分期、淋巴结转移有关。miR-625、PGⅠ、PGR低水平是胃癌发生独立危险因素。血清miR-625、PGⅠ、PGR 联合检测对胃癌诊断具有一定价值。但由于本研究样本量较少,研究方法较为单一,具体机制尚需大量实验进一步深入研究。
- 广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*

