下调miR-155通过抑制HIF-1α/VEGF通路增强人结直肠癌细胞的放射敏感性*
刘 黎,杨 帆,张 匠,冷 娇,刘雪梅,王晓华,梁 龙,董华琼△
(1.四川省遂宁市中心医院,遂宁 629000;2.四川省肿瘤医院,成都 610041)
结直肠癌(colorectal cancer,CRC)是临床最常见的消化道恶性肿瘤之一,近期资料显示,在全球范围内,随着社会经济的发展,人们生活方式、饮食结构的改变,CRC的发病率和致死率呈逐年上升趋势[1-2]。CRC 占恶性肿瘤第3 位,其主要的致死因素是复发和转移[3]。尽管早期的CRC患者通过外科手术后5 年内的生存率有所提高,但是中晚期的CRC患者往往预后较差,长期生存率较低[4]。目前,放射治疗是CRC的主要治疗方式之一,但是治疗过程中放疗抵抗的存在,严重的影响了放疗效果。因此,进一步探索CRC 的发生发展、侵袭转移机制,从而寻找抑制放疗抵抗的新的治疗靶点至关重要。miRNAs 是一类22~25 nt 内源性的非编码的单链小分子RNA,通常在转录后水平调节基因的表达来发挥生物学作用[5]。miRNAs与恶性肿瘤密切相关,可调控肿瘤的发生发展以及转移[6]。近年来研究发现miRNA-155在多种肿瘤中发挥重要作用,并且miRNA-155在CRC组织中的表达相比于癌旁组织显著上升,提示可能参与CRC 的发生发展过程[7]。但是目前尚未见研究报道阐明miRNA-155 的异常表达对CRC细胞放射敏感性的影响。因此,本研究主要探究miRNA-155对CRC细胞SW620放射敏感性的影响及其作用机制,旨在为临床研究提供理论依据。
1 材料与方法
1.1 主要材料
CRC 细胞SW620(中国科学院细胞库);RPMI 1640培养基和胚牛血清(美国Hyclone公司);CCK8试剂盒(上海碧云天生物技术有限公司);LipofectamineTM2000(美国Invitrogen 公司);anti-miRNA-155 and anti-miRNA-155 negative control(吉玛生物技术有限公司);qRT-PCR 试剂盒(大连宝生物工程有限公司);BCA试剂盒(上海碧云天生物技术有限公司);HIF-1、VEGF 山羊抗兔二抗(中国赛默飞世尔科技有限公司);细胞凋亡检测试剂盒(中国赛默飞世尔科技有限公司);细胞培养箱(苏州净化设备制造厂);医用高能电子直线加速器(美国Varian 公司);凝胶成像仪(美国Bio-Rad 公司);实时荧光定量PCR 仪(德国SensoQuest Lab Cycler 公司);流式细胞仪(BECKMAN)。
1.2 细胞培养
采用RPMI 1640培养基(包含10%胚牛血清和1%青霉素/链霉素)于37 ℃,5%CO2恒温细胞培养箱中培养SW620细胞。每隔24 h换液1次,细胞融合度达到80%时,进行传代培养。所有实验均取对数生长期的细胞。
1.3 细胞转染
采用对数生长期SW620 细胞接种于6 孔板中(2×105个/每孔),培养至细胞密度为70%~80%时,参照LipofectamineTM2000 说明书将anti-miRNA-155、anti-miRNA-155 NC 转染至SW620 细胞中,并标记为anti-miR-155 组和NC 组。转染6 h 后,更换新鲜培养液继续培养24 h,收集各组细胞采用qRTPCR 检测细胞中miRNA-155 的表达用来评价细胞转染效率。
1.4 细胞电离辐射
转染后的SW620 细胞用6 MV-X 射线,医用高能电子直线加速器进行照射,照射源距离为100 cm,剂量率为2 Gy/min,给予剂量为4.0 Gy。细胞培养瓶下方加1 cm厚的有机玻璃板,上方覆盖1 cm厚的胶体。
1.5 CCK8分析检测细胞活力
将100 μL 转染后的SW620 细胞悬液(5×104个/mL)接种于96孔板,于37 ℃,5%CO2恒温细胞培养箱中孵育,待细胞完全贴壁,6 MV-X 射线处理细胞。处理后各组细胞正常条件下培养0 h、24 h、48 h、72 h,每孔加入10 μL CCK8 溶液,混匀后放入恒温培养箱继续培养1 h。使用酶标仪测定450 nm处各孔的吸光度(OD值)。
1.6 qRT-PCR分析
按照总RNA 提取试剂盒说明书步骤提取SW620细胞的总RNA,根据反转录试剂盒说明书将RNA逆转录为cDNA。miRNA-155、内参U6引物由武汉金开瑞生物工程有限公司合成,序列如下:miRNA-155 上游引物为5’-GTCGTATCCAGTGCAGGGTCCGAGG-3’,下游引物为5’-TATTCGCACTGGATACGACCCCCTA-3’;内参U6 上游引物为5’-GCGCGTCGTGAAGCGTTC-3’,下游引物为5’-GTGCAGGGTCCGAGGT-3’。取PCR 上、下游引物(10 μmol/L)各1 μL,模板cDNA 1 μL,2×Taq Master Mix 10 μL,RNase free water 7 μL 配置成总体积为20 μL的反应体系。实时荧光定量PCR仪进行PCR 扩增,两步法程序为:94 ℃2 min(预变性),94 ℃10 s(变性)、60 ℃30 s(退火)、72 ℃30 s(延伸),共35 个循环。用2-△△CT检测miRNA-155 的表达水平。
1.7 克隆形成实验检测放射生物学参数
转染后的SW620 细胞用胰蛋白酶消化,重悬,细胞浓度稀释至5×103个/mL接种于6孔板中,37 ℃培养过夜。以0 Gy、2 Gy、4 Gy、6 Gy、8 Gy的6 MVX射线垂直照射各组细胞,照射结束后,于恒温培养箱中继续培养10~15 d,至出现肉眼可见的克隆时,终止培养。弃去培养基,用4%甲醛固定15 min,姬姆萨染液染色30 min,弃去染液后显微镜下观察,并以细胞集落≥50 作为有效克隆。克隆形成率(PE)以(克隆数/接种细胞数)×100%表示,各组细胞的存活分数(SF)根据公式:存活分数(SF)=克隆数/(PE×接种细胞数)进行计算。根据GraphPad Prime7.0 软件构建多靶单击模型拟合细胞剂量存活曲线,计算放射生物学参数:平均致死量(D0)、准阈剂量(Dq)、照射剂量2 Gy下细胞存活分数(SF2)和放射增敏比(SER)。
1.8 细胞划痕实验
将转染后的SW620细胞电离辐射,用胰蛋白酶消化后重悬,稀释至细胞浓度为5×105个/mL,吸取1 mL接种于6孔板中,放置在37 ℃培养箱中继续培养。待细胞长满后,用无菌的200 μL枪头在6孔板中央轻轻划过,接着用灭菌的PBS 清洗细胞,加入1 mL 无血清培养基,放入培养箱中继续培养。取0 h、24 h分别在光学显微镜下进行观察并拍照。
1.9 Transwell小室检测细胞侵袭
将转染后经电离辐射的SW620 细胞用胰酶消化,加入无血清的RPMI 1640 培养基制备成浓度为3×105个/mL的细胞悬液,吸取200 μL细胞悬液加入Transwell 上室,下室每孔加入600 μL 含10% FBS的RPMI 1640 培养基,放入37 ℃5%CO2细胞培养箱中继续培养24 h。取出Transwell小室,用棉签擦去上层未迁移的细胞,灭菌的PBS 清洗3 次,4%多聚甲醛固定20 min,结晶紫染色15 min。显微镜下观察,每孔随机选取5个视野拍照并计数,这些视野中细胞的平均值为Transwell 小室细胞迁徙的细胞数目。
1.10 流式细胞术检测细胞凋亡
SW620 细胞转染anti-miRNA-155 和anti-miRNA-155 NC后,使用6 MV-X射线照射细胞,正常条件下继续培养24 h。胰酶消化,用2 mL1×Banding Buffer 稀释成细胞密度为1×106个/mL 的细胞悬液。取100 μL 加入灭菌的1.5 mL EP 管中,然后加入5 μL AnnexinⅤ-FITC 和10 μL PI,室温下避光温育15 min。使用流式细胞仪检测各组样品,分析并统计细胞凋亡数。
1.11 双荧光素酶报告基因检测
采用双荧光素酶报告基因分析,进一步证实了miR-155与目标基因HIF-1α 3’-UTR的结合。将含有HIF-1α的3’-UTR的野生型或突变型片段克隆到psiCHECKTM-2 载体(美国Promega)中,形成Luc-WT-3’-UTR载体或Luc-MUT-3’-UTR载体。然后,将miR-155mimics 或其对照(mimics NC)和荧光素酶报告载体共转染到SW620细胞中。转染24 h后检查荧光素酶活性。
1.12 Western blotting检测
用RIPA 裂解液提取转染后放射处理的SW620细胞的总蛋白,BCA试剂盒测定蛋白浓度。将变性蛋白以40 μg/每孔上样至10%SDS-PAGE凝胶中进行电泳分离蛋白,将分离的蛋白样品电转至聚偏二氟乙烯(PVDF)膜上。转膜后,将PVDF 膜放入含5%脱脂奶粉的封闭液中封闭2 h,接着加入稀释好的GAPDH、HIF-1α、VEGF 一抗(1∶1 000),4℃孵育过夜。然后再加入稀释的山羊抗兔二抗(1∶4 000)室温下孵育1 h。按照ECL试剂盒说明书配制发光液,用Bio-Rad成像仪显影。
1.13 统计学方法
采用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 转染后SW620细胞中miRNA-155的表达下调
SW620 细胞转染anti-miRNA-155 和anti-miRNA-155 NC后,用qRT-PCR检测miRNA-155的表达水平。转染anti-miRNA-155 后SW620 细胞中miRNA-155的表达水平(0.35±0.11)相比于NC组(0.98±0.05)显著降低(t=9.13,P<0.05);而对照组与NC组相比,miRNA-155的表达水平无明显变化(P>0.05),见图1。
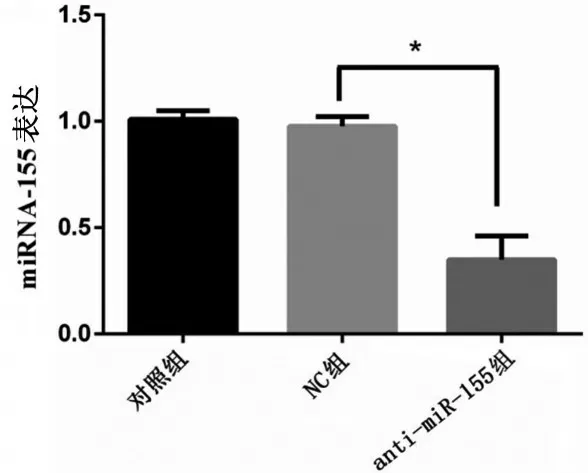
图1 各组细胞中miRNA-155的表达水平比较
2.2 放射线照射后miRNA-155对SW620细胞放射生物学参数的影响
使用6MV-X射线对转染后的SW620细胞进行放射处理,克隆形成实验检测各组细胞放射生物学参数,其相关参数,见表1。与NC组相比,anti-miRNA-155 组细胞的D0值、Dq值、SF2值显著降低(P<0.05),放射增敏比SER 为1.67±0.75。克隆形成实验结果显示,下调miRNA-155能明显增强结直肠癌SW620细胞的放射敏感性。
表1 各组SW620细胞放射生物学参数比较
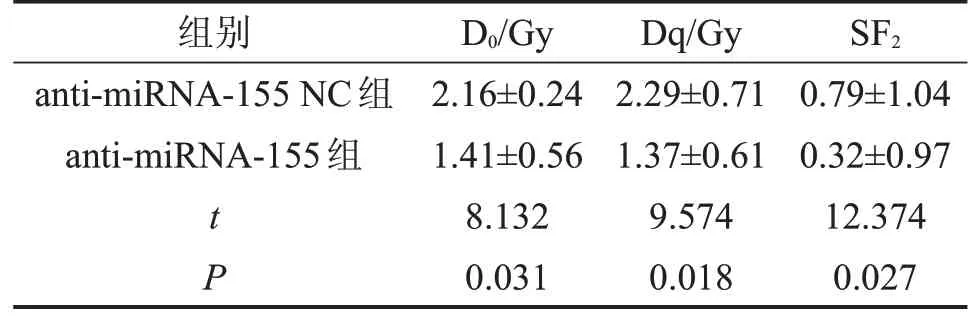
表1 各组SW620细胞放射生物学参数比较
2.3 下调miRNA-155对放射线照射后SW620细胞的增殖能力的影响
CCK8 检测结果显示,anti-miRNA-155 组直肠癌SW620细胞增殖能力在各时间点均显著低于NC组(t24h=3.319、t48h=5.124、t72h=8.141,P<0.05),见图2。
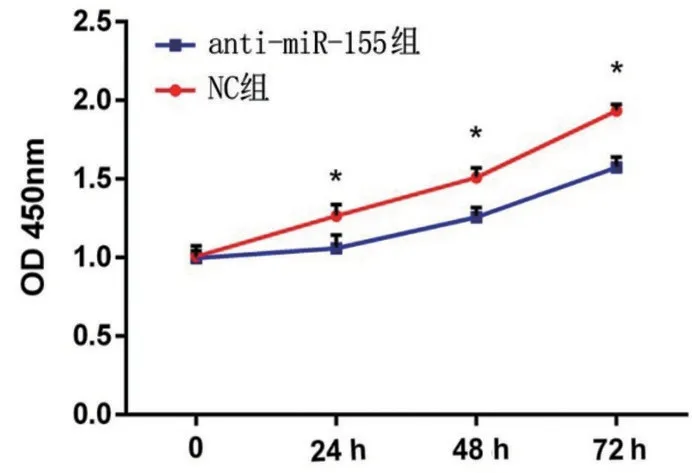
图2 anti-miRNA-155对SW620细胞增殖能力的影响
2.4 下调miRNA-155对放射线照射后SW620细胞的迁移能力的影响
划痕愈合实验检测放射线照射后SW620 细胞的迁移能力。结果显示,与NC 组相比,anti-miRNA-155 组SW620 细胞愈合率显著降低(t=4.708,P<0.01),见图3。
2.5 下调miRNA-155对放射线照射后SW620细胞的侵袭能力的影响
使用Transwell 小室法检测放射线照射后SW620 细胞的侵袭能力。与NC 组相比,anti-miRNA-155 组SW620 细胞穿越Matrigel 胶的能力受到抑制,细胞侵袭数量明显减少(t=6.007,P<0.01),见图4。

图4 下调miRNA-155对SW620细胞侵袭能力的影响
2.6 下调miRNA-155促进放射线照射后的SW620细胞凋亡
通过流式细胞术检测下调miRNA-155 对电离辐射处理的SW620 细胞凋亡的影响。放射线照射后anti-miRNA-155组和NC组中细胞的凋亡率分别为(8.96±0.39)%和(2.28±0.16)%,见图5A。与NC 组相比较,anti-miRNA-155组SW620细胞凋亡率显著上升(t=15.73,P<0.01),见图5B。
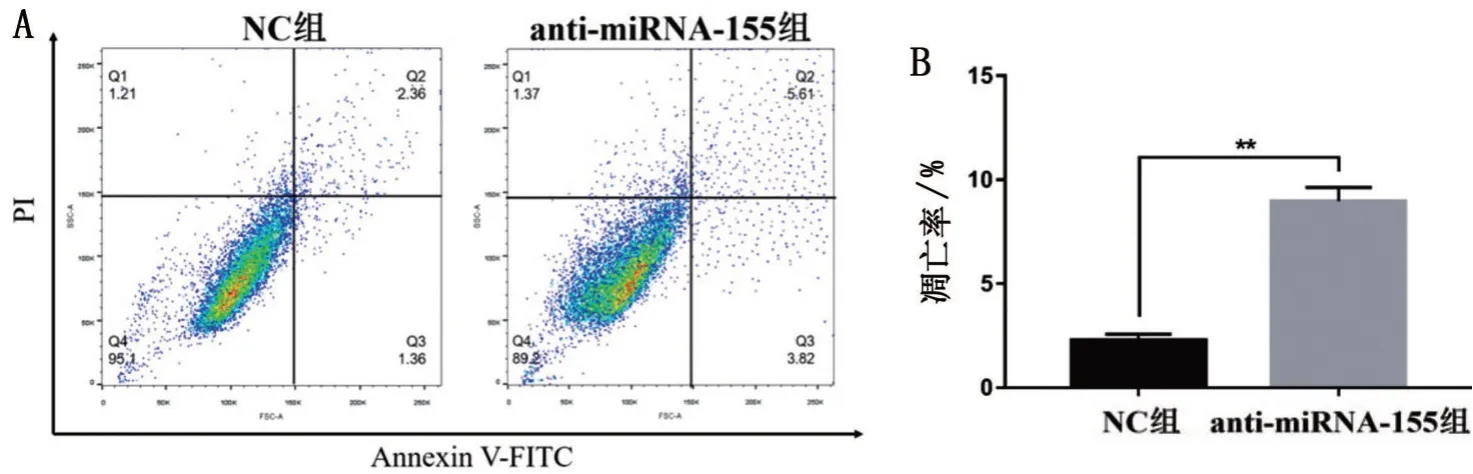
图5 下调miRNA-155对SW620细胞凋亡的影响
2.7 miRNA-155靶向调节HIF-1α的表达
通过生物信息学软件预测,发现miRNA-155与HIF-1α的3’-UTR存在结合位点,见图6A。双荧光素酶报告基因试验结果表明,miRNA-155mimics显著降低HIF-1α 的WT-3’-UTR 的荧光素酶活性,但不降低突变型的,图6B。
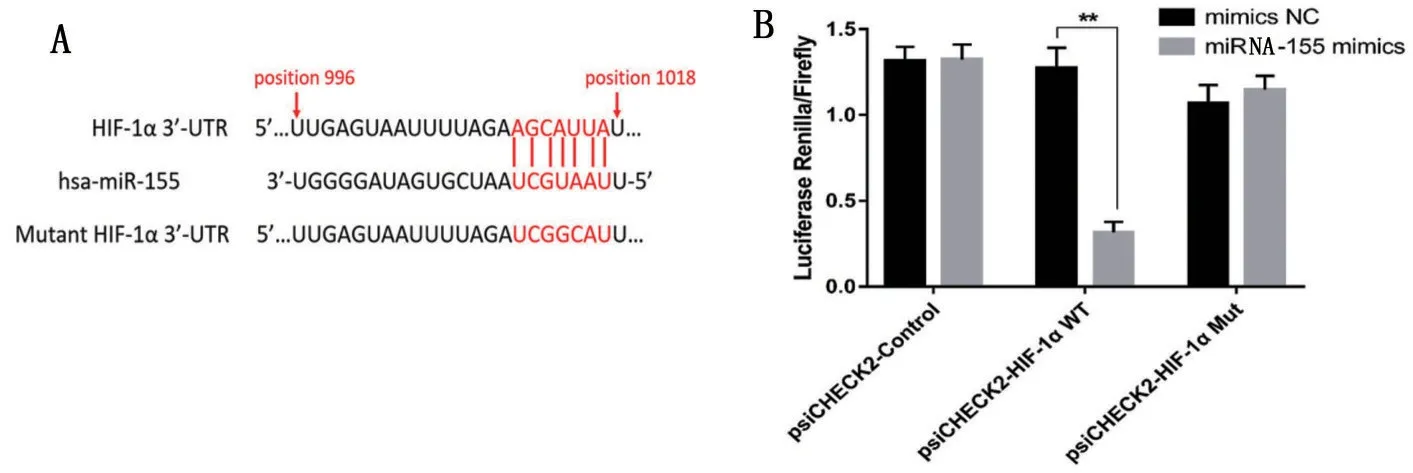
图6 miRNA-155靶向HIF-1α
2.8 下调miRNA-155 对SW620 细胞中HIF-1α 和VEGF水平的影响
采用Western blotting检测技术分析电离辐射的SW620细胞中HIF-1α 和VEGF表达水平。经过6MV-X 射线照射24 h后,anti-miRNA-155组SW620细胞中HIF-1α 和VEGF 表达水平显著低于NC 组,见图7。
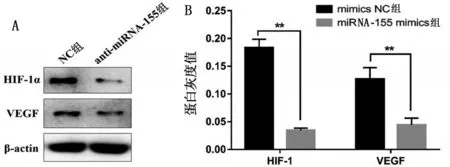
图7 下调miR-155对SW620细胞中HIF-1α和VEGF蛋白表达量的影响
3 讨论
CRC是一种高发的消化系统恶性肿瘤,其具有浸润性生长、恶性程度高、容易发生侵袭转移和复发等特点,导致治疗后患者总体生存率极低[8-9]。因此,探究CRC的侵袭转移机制以及发现抑制放射耐受的新治疗靶点迫在眉睫。miRNAs可调节促癌基因或抑癌基因参与肿瘤细胞的增殖、转移、侵袭等过程,其可作为肿瘤早期诊断的生物标志物和靶向治疗的特异性靶点[10-12]。已有研究报道,miRNA-155 在多种肿瘤组织中异常高表达,提示可能作为癌基因促进癌细胞的转移和侵袭[13]。有研究报道,miRNA-155参与调控乳腺癌、肾癌等癌细胞的侵袭和转移[14-15]。此外,2 Gy 射线辐射人脐静脉内皮细胞24 h 时可显著增加miRNA-155 的表达,miRNA-155 与细胞辐射耐受性密切相关[16]。但是目前还少有相关研究阐明miRNA-155 调控CRC 细胞的迁移、侵袭和放射耐受性的分子机制。本研究通过电离辐射转染anti-miRNA-155的SW620细胞,利用克隆形成实验检测各组细胞放射生物参数。本研究发现,下调miRNA-155 后SW620 细胞的D0值、Dq值、SF2值均显著降低,SER为1.67±0.75。以上实验结果表明,下调miRNA-155 可降低SW620 细胞的放射耐受性,与先前的研究结论吻合。本研究结果显示,下调miRNA-155 后的SW620 细胞经过放射线照射,其增殖、迁移和侵袭能力明显降低;同时,促进细胞凋亡。结果表明,miRNA-155调控CRC细胞侵袭和转移可能与其在已证实的其他癌症转移的分子机制类似。
为了进一步探究miRNA-155 调控CRC 细胞侵袭和迁移的分子机制,通过生物信息学软件预测发现,miRNA-155的可能靶基因是HIF-1α。通过双荧光素酶报告基因试验证实HIF-1α 是miRNA-155 的靶基因。HIF-1α是具有转录活性的核蛋白,其与炎症、血管生成、细胞增殖和细胞凋亡密切相关,可作为转录因子促进不同种类肿瘤的转移[17]。本研究表明,下调miRNA-155 降低了HIF-1α 蛋白的表达。研究已证,HIF-1α 被激活后通过活化PI3K/AKT 通路,抑制HIF-1α 羟基化后的降解,积聚的HIF-1α 启动VEGF 的表达,从而促进肿瘤新血管生成[18]。VEGF 是目前发现的重要的血管生成的调节因子,它的表达与肿瘤侵袭能力呈明显正相关[19]。VEGF是HIF-1α的下游靶基因,HIF-1α的上调诱导VEGF基因表达和肿瘤血管生成,进而促进肿瘤细胞的生长和转移。本研究发现,下调miRNA-155能显著降低VEGF 的表达水平[20]。以上结果提示,下调miRNA-155 可能是通过抑制HIF-1α/VEGF 信号通路降低SW620细胞的增殖、迁移和侵袭的能力。
综上所述,下调miRNA-155能增强结直肠癌细胞SW620的放射敏感性,抑制其增殖、迁移和侵袭,其作用机制可能是抑制HIF-1α/VEGF 信号通路的激活。
- 广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*

