牦牛犊牛溶血性曼氏杆菌与多杀性巴氏杆菌混合感染的病原分离鉴定及药敏实验
佘海瑞
(肃南裕固族自治县康乐镇畜牧兽医工作站, 甘肃 肃南734400)
溶血性曼氏杆菌(Mannheimia haemolytica)和多杀性巴氏杆菌Pasteurella multocida)近年来越来越受到养殖业的重视,二者均属于巴氏杆菌科,是存在于易感动物呼吸道的常在菌和机会致病菌。目前,两种致病菌的集群感染现象在国内外均有报道,给集约型畜群养殖行业造成了巨大的经济损失。我国也有很多养殖场及个体养殖业关于两菌株感染牛羊病例的研究报道,但在牦牛这一生活在高海拔地区的特殊牛种中有关溶血性曼氏杆菌和多杀性巴氏杆菌感染的相关报道尚缺乏研究。本文使用分离自牦牛的两种菌株进行了攻毒实验和药敏试验,确定了敏感药物的使用范围和剂量,为临床规范化用药提供了一定的依据,也为一线畜牧工作及从业人员在牦牛群体中预防和治疗溶血性曼氏杆菌和多杀性巴氏杆菌感染提供了一定的参考。
1 材料与方法
1.1 病料来源
甘肃省肃南县康乐镇安某从某地购买了41头牦牛犊牛,购回后13头陆续发病,4 d 后死亡1 头,11 d后共计死亡5头,病牦牛犊牛临床症状主要表现为精神萎靡,体温升高,食欲下降,咳嗽,流粘脓性鼻液并带有臭味,后卧地不起死亡。剖检病变主要表现为胸腔内有大量浆液性纤维素性渗出积液,心包积液,肺部“肉样变”和肿大。当地兽医初步诊断为多杀性巴氏杆菌感染,但药物治疗效果不明显。采取病死牛肺脏、淋巴组织和胸腔积液到实验室确诊。
1.2 直接PCR检测
在生物安全柜内对病变的肺脏表面和淋巴组织进行消毒(过火焰)。然后,十字切口后从内部组织剪取约1 g(黄豆大小)组织,加入生理盐水,放置于高通组织研磨器研磨,用市售的天根血液/细胞/组织试剂盒提取组织的细菌DNA(按试剂盒说明书操作),采用Pm KMT1/Pm KMT2,Mh-F/Mh-R,MBOUVRC2-L/MBOUVRC2-R引物,用于多杀性巴氏杆菌、溶血性曼氏杆菌和牛支原体核酸的检测。
1.3 细菌分离培养
将肺脏组织在生物安全柜内进行表面消毒(过火焰)、十字切口后从内部组织剪取约1 g(黄豆大小)组织分别直接接种在TSA 培养基和血琼脂培养基上,置于37℃恒温培养箱中培养18 h,观察结果,并进行细菌纯化后,观察细菌的培养特性及菌落形态,并分别挑取单个菌落进行革兰氏染色,镜检。
1.4 药敏实验
1.4.1 实验方法 于超净台内使用灭菌枪尖挑取平板上的单个菌落将其接种于4.5 mL的 TSB 培养基中,于37℃,5%CO2的恒温培养箱中培养至16 h。随后使用无菌生理盐水以20∶1的比例对培养好的菌液进行稀释,制成均匀悬液。经与浊度管(0.5麦氏单位比浊管)比较,浊度一致。取100 μL稀释过的菌液用涂菌棒均匀的涂于TSA培养基表面。平板放置于37℃培养箱中 3~5 min 后,药敏纸片需用消毒灭菌的镊子进行夹取,按照一定空间排布将其贴于一平板表面,并轻压纸片使其贴平。具体排布规则为:相隔两张纸片的间距应不小于24 mm,纸片中心位置距平皿边缘应不小于15 mm。待贴好纸片后将平板在15 min 内置于37℃孵育箱倒置培养。培养18 h 后取出进行观察。
1.4.2 结果判定 培养后取出平板,抑菌环的边缘以肉眼见不到细菌明显生长为限。用游标卡尺量取抑菌圈的直径,并判定试验结果。
1.5 实验动物攻毒试验
分别挑取单菌落接种于4.5 mL TSB 培养基中,37℃ 培养16 h。9只昆明小鼠随机分3组,试验Ⅰ,Ⅱ,Ⅲ组,每组3 只,试验Ⅰ,Ⅱ组分别腹腔注射2种菌纯培养物0. 2 mL /只,对照组腹腔注射TSB 培养基0. 2 mL /只,注射后观察小鼠的发病及死亡情况,并剖检; 无菌采取小鼠肝脏进行细菌分离培养鉴定, 观察细菌的培养特性及菌落形态,革兰氏染色观察细菌形态,并比较与之前细菌培养与分离的结果是否一致。
1.6 PCR产物测序鉴定及BLAST 分析
分别挑取单菌落接种于4.5 mLTSB 培养基中,37℃ 培养16 h后用细菌基因组DNA 提取试剂盒提取DNA,细菌16 sRNA通用引物进行扩增测序及BLAST 分析。
2 结果
2.1 直接PCR检测结果
2份样品中肺有大小为227 bp的特异性扩增条带,即为溶血曼氏杆菌核酸阳性;肺和淋巴结都有大小为460 bp的特异性扩增条带,即为多杀性巴氏杆菌核酸阳性。
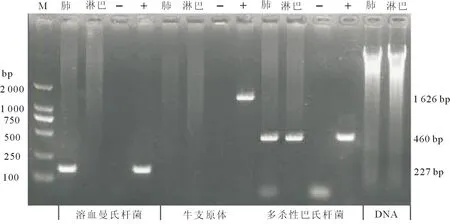
图1 (直接PCR检测结果)
2.2 细菌分离培养结果
TSA 培养基平板上形成大小不同、隆起、表面光滑、湿润、边缘整齐、半透明的灰白色和黄白色的两种菌落;在血琼脂平板上生长两种不同的菌落,一种为灰白色、圆形隆起、表面光滑、边缘整齐、半透明、中间有脐的大菌落, 并呈现明显的β溶血,标记为肺1。另一种为黄白色、圆形、半透明、光滑湿润、不溶血的小菌落,标记为肺2。分别挑取纯化后的单个菌落进行革兰氏染色,镜检可见肺1和肺2都为单个、散在排列、两端钝圆的革兰氏阴性短杆菌,形态极为相似。

图2 细菌分离镜检图
2.3 药敏实验结果

表1 药敏实验结果
2.4 实验动物攻毒试验结果
在注射18 h后Ⅰ、Ⅱ组小白鼠死亡, 对照组无反应。无菌采取肝脏进行细菌分离培养鉴定, 分离出形态一致的细菌。
2.5 PCR产物测序及BLAST 分析结果
BLAST 分析结果显示肺1为溶血曼氏杆菌,肺2为多杀性巴氏杆菌。

图3 (16sRNA PCR图)

图4 (肺1 Blast结果图:Mannheimia)

图5 (肺2 Blast结果图: Pasteurella)
3 讨论
经过直接PCR检测、培养物菌落和菌体形态观察、动物攻毒试验及测序和BLAST 分析,确诊病死牦牛犊牛为溶血性曼氏杆菌与多杀性巴氏杆菌混合感染。
溶血性曼氏杆菌和多杀性巴氏杆菌是广泛存在于牛、绵羊、山羊等反刍动物呼吸道的常在菌及机会致病菌。在某些诱发因素作用下,如环境骤变、运输、饲养坏境恶劣等因素都可造成动物机体应激能力和整体健康状况低下,溶血性曼氏杆菌和多杀性巴氏杆菌可引发以呼吸道症状为主的致死性肺炎。本次牦牛犊牛发病的主要原因是牛群在长途运输时受到了拥挤、饥饿和环境气候不适应,犊牛应激能力和抵抗力下降所致。
多杀性巴氏杆菌和溶血性曼氏杆菌在世界各地均有分布,给全世界范围内的畜牧养殖产业造成了较为严重的经济损失。两菌株在临床上存在单独感染以及混合感染,在致病力方面具有一定的相互协同能力,在疾病表现症状方面,二者所造成的呼吸道症状极为相近,这为临床准确诊断以及随后的治疗措施带来一定的困难。此外,两菌株在个体形态、革兰氏染色特性等方面也极为相似,这就为两种细菌的实验室准确判定造成了一定的困难。
近年来,我县牦牛跨地区交易和流动愈加频繁,牦牛疫病的发生数量也不断增多,从我国牛病防控现状看,尚无有效防治牛溶血性曼氏杆菌病的疫苗,所以,溶血性曼氏杆菌将是目前影响我县牦牛养殖的主要传染病之一,具有发病速度快传染性强的特点,给我县牦牛养殖户带来严重经济损失。
面对牛溶血性曼氏杆菌和多杀性巴氏杆菌感染的防控措施一是坚持自繁自养原则,培育种群健康,在引进牦牛时,必须严格检疫,隔离饲养45 d以上,确保无病患后混入大群;二是在运输过程中,做好车辆消毒和清洁,装车时合理控制密度,途中注意休息和护理,最大限度减少牛的应激;三是有计划的开展多杀性巴氏杆菌疫苗免疫工作;四是发生本病时应迅速采取隔离、消毒、治疗等措施,加强病牛的护理。从本次药敏结果来看,广谱抗生素是治疗该类病的主要药物,结合药敏实验结果,迅速采取抗生素治疗,将能有效提高治疗效果。

