轻度认知障碍癌症病史与AD脑脊液生物标志物关系
王潇 谭兰

[摘要] 目的 探讨轻度认知障碍(MCI)人群癌症病史与阿尔茨海默病(AD)脑脊液生物标志物之间的潜在联系。
方法 使用线性混合效应模型分析MCI参与者癌症病史和脑脊液生物标志物之间的纵向关系。
结果 有癌症病史的MCI参与者脑脊液总tau蛋白(t-tau)和磷酸化tau蛋白(p-tau)较没有癌症病史者变化速率慢(β=-0.005、-0.006,P<0.05)。亚组分析显示,在女性MCI参与者中,癌症病史与更慢的脑脊液t-tau和p-tau变化速率显著相关(β=-0.010、-0.110,P<0.05);在载脂蛋白ε4非携带者中,癌症病史与更慢的脑脊液t-tau和p-tau的变化速率显著相关(β=-0.007、-0.006,P<0.05)。
结论 有癌症病史MCI人群较无癌症病史人群有更低的脑脊液 t-tau和p-tau变化速率。
[关键词] 阿尔茨海默病;认知功能障碍;肿瘤;生物标记;脑脊髓液
[中图分类号] R741
[文献标志码] A
[文章编号] 2096-5532(2021)03-0385-04
doi:10.11712/jms.2096-5532.2021.57.126
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20210628.1638.008.html;2021-06-29 14:06:54
CORRELATION BETWEEN CANCER HISTORY AND CEREBROSPINAL FLUID BIOMARKERS OF ALZHEIMERS DISEASE IN POPULATIONS WITH MILD COGNITIVE IMPAIRMENT
WANG Xiao, TAN Lan
(Department of Clinical Medicine, Weifang Medical University, Weifang 261053, China)
[ABSTRACT]Objective To investigate the potential correlation between cancer history and cerebrospinal fluid (CSF) biomarkers of Alzheimers disease (AD) in populations with mild cognitive impairment (MCI).
Methods A linear mixed-effects model was used to analyze the longitudinal relationship between cancer history and CSF biomarkers of AD in participants with MCI.
Results Participants with cancer history had a significantly slower rate of changes in the levels of CSF total tau protein (t-tau) and phosphorylated tau protein (p-tau) than those without any cancer history (β=-0.005,-0.006;P<0.05). Subgroup analyses showed that cancer history was significantly correlated with slower rates of changes in CSF t-tau and p-tau levels in both female participants with MCI (β=-0.010,-0.110;P<0.05) and non-carriers of apolipoprotein ε4 (β=-0.007,-0.006;P<0.05).
Conclusion MCI populations with cancer history have a slower rate of changes in CSF t-tau and p-tau levels.
[KEY WORDS]Alzheimers disease; cognitive dysfunctio; neoplasms; biomarkers; cerebrospinal fluid
阿尔茨海默病(AD)是最常见的神经退行性疾病[1]。研究表明,某些疾病(如糖尿病、高血压等)可能是AD的危险因素[2]。由于多种疾病能够影响个体患AD的風险,目前迫切需要研究AD与其他疾病的相关性。以往研究结果表明,癌症与AD风险之间存在相关关系[3-5],癌症病人患AD的风险降低,但关于癌症对AD病理方面的影响尚不清楚。根据2018年发表的美国国立老年-痴呆协会研究所(NIA-AA)研究框架,脑脊液中AD的生物标志物包括淀粉样蛋白(Aβ)、总tau蛋白(t-tau)和磷酸化tau蛋白(p-tau),AD诊断着重强调了这些核心标志物的作用[6]。在NIA-AA框架中,AD可以在生物学上通过异常的脑脊液生物标志物被定义。在以往的研究中,虽然轻度认知障碍(MCI)被认为是一些神经退行性病变,特别是AD的早期阶段,但并不是所有的MCI人群最终都会进展为AD。若要判断或预测MCI人群是否会最终进展为AD,需要检测到AD的病理改变,而脑脊液生物标志物是一类反映AD病理改变的非常重要的指标。因此,研究可能会对MCI病人AD生物标志物变化产生影响的因素具有重要意义。本文研究利用AD神经成像计划(ADNI)数据库的纵向随访数据,调查MCI群体中癌症和AD的脑脊液生物标志物之间的纵向关系。现将结果报告如下。
1 资料与方法
1.1 研究对象
本研究使用的数据来自ADNI数据库[7-10],病人均来自ADNI研究的MCI白种人参与者,共纳入870例。ADNI参与者的详细资格标准见http://www.adni-info.org。MCI诊断标准:Wingdings 2jA@病人的简易精神状态量表(MMSE)评分24~30分;Wingdings 2kA@韦氏记忆量表(WMS)逻辑记忆量表Ⅱ评定结果为客观认知或记忆损伤;Wingdings 2lA@临床痴呆量表(CDR)得分0.5;Wingdings 2mA@病人无痴呆。参与者被分为有癌症病史组(CA+组)和没有癌症病史组(CA-组)[5]。CA+组基线为诊断出癌症的时间,CA-组基线则为参加ADNI的时间。870例MCI病人中,共有802例进行了至少1次随访(时间1~10年)。
1.2 统计学方法
所有统计分析均使用R统计软件(3.4.4版)进行。CA+组和CA-组年龄、文化程度、性别、载脂蛋白E4(APOE ε4)水平比較采用连续变量和分类变量的Mann-Whitney秩和检验和卡方检验。对脑脊液生物标志物数据进行对数正态转换,便于各模型的比较[11-12]。采用多元线性回归模型评估癌症病史与脑脊液AD生物标志物之间的横断面关系。在分析中,年龄、性别、教育程度和APOE ε4基因型被认为是可能协变量。为了检验性别和APOE ε4携带状态对癌症和脑脊液生物标志物之间关系的影响,本文建立了带有交互项的模型,如果存在显著的交互作用,则进一步进行分层分析。采用线性混合效应模型(LME)分析癌症病史和脑脊液生物标志物之间的纵向关联,LME包括时间的随机截距和斜率以及随机效应的非结构协方差矩阵;并且将时间和因变量的相互作用视为预测因子,通过校正协变量年龄、性别、教育程度和APOE ε4基因型对脑脊液生物标志物的纵向变化速率进行评估[12-13]。以P<0.05为差异有统计学意义。
2 结 果
2.1 纳入人群的基线特征
纳入研究的870例MCI病人中,211例有癌症病史,659例无癌症病史。CA+组与CA-组性别比较,差异有统计学意义(χ2=7.572,P<0.05)。CA+组年龄大于CA-组,差异有统计学意义(Z=-5.715,P<0.01)。在APOE ε4携带方面,CA+组有103例至少携带1条等位基因,CA-组有335例,两组比较差异无显著性(P>0.05)。两组教育水平、MMSE得分和脑脊液生物标志物Aβ、t-tau和p-tau基线水平等比较差异无统计学意义(P>0.05)。见表1。
2.2 癌症与AD生物标志物的关系
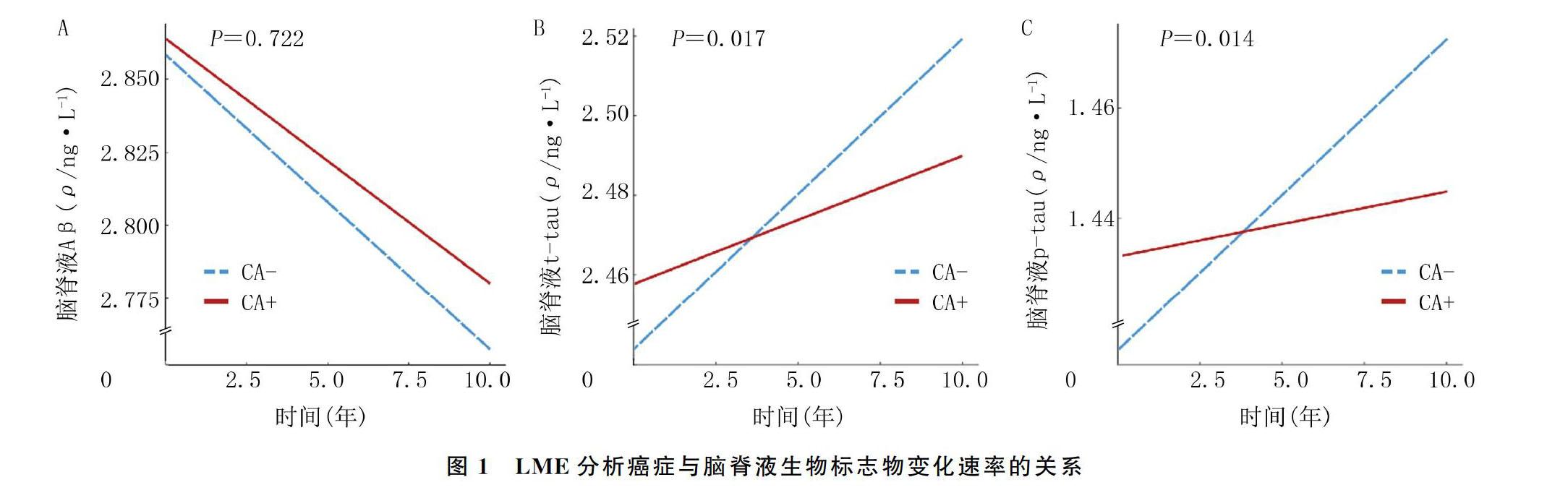
多元线性回归模型分析显示,校正了年龄、性别、文化程度和APOE ε4携带状态后,横断面癌症史和AD脑脊液生物标志物之间差异无显著意义(P>0.05)。LME研究显示,CA+组脑脊液t-tau(β=-0.005,P=0.017)和p-tau(β=-0.006,P=0.014)的升高速率低于CA-组(图1);两组脑脊液Aβ的变化差异无显著性(β=0.001,P=0.722)。
2.3 不同性别及APOE ε4携带状态MCI人群癌症病史与AD生物标志物的纵向关系
性别和APOE ε4携带状态对癌症病史和脑脊液生物标志物t-tau和p-tau之间关系影响存在交互作用(β=-0.124~0.354,P<0.05)。根据性别和APOE ε4携带状态分组后进行LME分析,结果显示,在女性参与者中,CA+组脑脊液t-tau的变化速率(β=-0.010,P=0.022)和p-tau的变化速率(β=-0.011,P=0.018)较CA-组慢;APOE ε4非携带者中CA+组脑脊液t-tau(β=-0.007,P=0.012)和p-tau(β=-0.006,P=0.013)的变化速率较CA-组慢。见表2。
3 讨 论
AD的危险因素是目前研究的热点之一。本研究分析了MCI人群的癌症病史与3种AD脑脊液生物标志物之间的纵向关系,在除去年龄、性别、教育程度和APOE ε4携带状态影响后显示,CA+组脑脊液t-tau和p-tau的升高速率低于CA-组;分组分析显示,这种关联亦存在于女性或APOE ε4非携带者中。本研究进一步明确了癌症病史与AD之间的相关关系,补充了目前研究上的空白。
既往研究结果显示,与非癌症病人相比,癌症病人进展成为AD的风险降低[5,14]。本研究结果与其一致。癌症与AD之间存在相关性,但癌症与AD之间关联的潜在机制尚不清楚。由于遗传因素被认为是影响AD发生的重要因素[15],一种可能的解释是癌症与AD存在共有的遗传易感性。有研究发现,AD和几种癌症基因表达的差异主要集中在细胞存活和凋亡调节所必需的代谢和遗传信息处理通路中,如PIN1基因、ATP13A2基因和p53基因等[16-17]。还有一种假说认为,化疗可能与AD的生物标志物和认知状态有关,用于治疗癌症的方法可以影响大脑,降低p-tau纠缠的水平和AD的发病率。尽管有多项研究表明化疗可导致药物性痴呆,但接受化疗的病人被诊断为AD的风险较低[18-19]。
tau蛋白是一种微管稳定蛋白,微管稳定蛋白作为多种广泛使用的化疗药物的靶点,其水平可能因为化疗药物的应用而降低[20-21]。多项研究结果表明,受试者在使用紫杉醇和其他微管稳定剂后p-tau减少[22-23]。本文研究结果表明,患有癌症的女性参与者的t-tau和p-tau变化速率较没有患癌症的女性要低。女性乳癌病人接受化疗的机会更多,这可能是t-tau和p-tau变化速率较低的原因。
本研究也有一些局限性。首先,有癌症病史的参与者可能表现出预期寿命缩短,这种生存偏差可能会降低癌症病人被检查出AD的风险;此外,认知状态较差的参与者可能因为不合作或健康状况较差,导致接受癌症筛查的可能性降低,这可能是队列研究风险降低的原因。
综上所述,有癌症病史的MCI群体脑脊液t-tau和p-tau的变化速率較没有癌症者慢,这一现象在女性或APOE ε4非携带者中也存在,提示癌症可能是AD的一种保护因子。未来的研究应针对癌症和AD的其他生物标志物之间的联系,进一步阐明其生物学机制,以确定预防和治疗靶点。
[参考文献]
[1]Alzheimers association report. 2020 Alzheimers disease facts and figures[J]. Alzheimers & Dementia: the Journal of the Alzheimers Association, 2020,16:391-460.
[2]XU W, TAN L, WANG H F, et al. Meta-analysis of modifiable risk factors for Alzheimers disease[J]. Journal of Neuro-logy, Neurosurgery, and Psychiatry, 2015,86(12):1299-1306.
[3]FRAIN L, SWANSON D, CHO K, et al. Association of can-cer and Alzheimers disease risk in a national cohort of vete-rans[J]. Alzheimers & Dementia, 2017,13(12):1364-1370.
[4]ZHOU J, YU J T, WANG H F, et al. Association between stroke and Alzheimers disease: Systematic review and meta-analysis[J]. Journal of Alzheimers Disease, 2015,43(2):479-489.
[5]NUDELMAN K N H, RISACHER S L, WEST J D, et al. Association of cancer history with Alzheimers disease onset and structural brain changes[J]. Frontiers in Physiology, 2014,5:423.
[6]JACK C R, BENNETT D A, BLENNOW K, et al. NIA-AA Research Framework: toward a biological definition of Alzheimers disease[J]. Alzheimers & Dementia, 2018,14(4):535-562.
[7]APOSTOLOVA L G, HWANG K S, ANDRAWIS J P, et al. 3D PIB and CSF biomarker associations with hippocampal at-rophy in ADNI subjects[J]. Neurobiology of Aging, 2010,31(8):1284-1303.
[8]PETERSEN R C, AISEN P S, BECKETT L A, et al. Alzheimers Disease Neuroimaging Initiative (ADNI): clinical cha-racterization[J]. Neurology, 2010,74(3):201-209.
[9]SAYKIN A J, SHEN L, FOROUD T M, et al. Alzheimers disease neuroimaging initiative biomarkers as quantitative phenotypes: genetics core aims, progress, and plans[J]. Alzheimers & Dementia: the Journal of The Alzheimers Association, 2010,6(3):265-273.
[10]TROJANOWSKI J Q, VANDEERSTICHELE H, KORECKA M, et al. Update on the biomarker core of the Alzhei-mers disease neuroimaging initiative subjects[J]. Alzheimers & Dementia, 2010,6(3):230-238.
[11]OU Y N, SHEN X N, HU H Y, et al. Fasting blood glucose and cerebrospinal fluid Alzheimers biomarkers in non-diabetic cognitively normal elders: the CABLE study[J]. Aging, 2020,12(6):4945-4952.
[12]HU H, CHEN K L, OU Y N, et al. Neurofilament light chain plasma concentration predicts neurodegeneration and clinical progression in nondemented elderly adults[J]. Aging, 2019,11(17):6904-6914.
[13]SUN Y, TAN L, XU W, et al. Plasma neurofilament light and longitudinal progression of white matter hyperintensity in elderly persons without dementia[J]. Journal of Alzheimers Disease, 2020,75(3):729-737.
[14]MUSICCO M, ADORNI F, DI SANTO S, et al. Inverse occurrence of cancer and Alzheimer disease: a population-based incidence study[J]. Neurology, 2013,81(4):322-328.
[15]KARCH C M, CRUCHAGA C, GOATE A M. Alzheimers disease genetics: from the bench to the clinic[J]. Neuron, 2014,83(1):11-26.
[16]IB EZ K, BOULLOSA C, TABARS-SEISDEDOS R, et al. Molecular evidence for the inverse comorbidity between central nervous system disorders and cancers detected by transcriptomic meta-analyses[J]. PLoS Genetics, 2014,10(2): e1004173.
[17]TABARS-SEISDEDOS R, RUBENSTEIN J L R. Chromosome 8p as a potential hub for developmental neuropsychiatric disorders: implications for schizophrenia, autism and cancer[J]. Molecular Psychiatry, 2009,14(6):563-589.
[18]DU X L, CAI Y, SYMANSKI E. Association between chemotherapy and cognitive impairments in a large cohort of patients with colorectal cancer[J]. International Journal of Oncology, 2013,42(6):2123-2133.
[19]HECK J E, ALBERT S M, FRANCO R, et al. Patterns of dementia diagnosis in surveillance, epidemiology, and end results breast cancer survivors who use chemotherapy[J]. Journal of the American Geriatrics Society, 2008,56(9):1687-1692.
[20]PAZDUR R, KUDELKA A P, KAVANAGH J J, et al. The taxoids: paclitaxel (Taxol) and docetaxel (Taxotere)[J]. Cancer Treatment Reviews, 1993,19(4):351-386.
[21]MOUDI M, GO R, YIEN C Y S, et al. Vinca alkaloids[J]. International Journal of Preventive Medicine, 2013,4(11):1231-1235.
[22]ZHANG B, MAITI A, SHIVELY S, et al. Microtubule-bin-
ding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy mo-
del[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102(1):227-231.
[23]ZHANG B, CARROLL J, TROJANOWSKI J Q, et al. The microtubule-stabilizing agent, epothilone D, reduces axonal dysfunction, neurotoxicity, cognitive deficits, and Alzheimer-like pathology in an interventional study with aged tau transgenic mice[J]. J Neurosci, 2012,32(11):3601-3611.
(本文編辑 黄建乡)

