美国白蛾热激蛋白70基因的鉴定及功能分析
乔 恒, 李 慧, 耿薏舒, 赵旭东, 于晓航, 郝德君,*
(1.南京林业大学南方现代林业协同创新中心, 南京 210037; 2.南京林业大学林学院, 南京 210037)
美国白蛾Hyphantriacunea属鳞翅目(Lepidoptera)灯蛾科(Arctiidae),是一种寄主范围广、繁殖力强、适生性强、危害严重的世界性检疫害虫(季荣等, 2003)。自1979年首次在我国辽宁省丹东地区发现以来,至2019年已经扩散至北京、天津、河北、内蒙古、辽宁、吉林、江苏、安徽、山东、湖北、河南、湖北、陕西共13个省(区、市)的近600个县级行政区(国家林业和草原局2020年第3号公告),对我国的林木资源及相关产业造成了巨大的经济损失。
昆虫在长期外界温度胁迫下,进化出复杂而多样的行为、生理生化及分子机制去抵御外界不利的温度(Maetal., 2021),其中热激蛋白(heat shock protein, HSP)在昆虫体内发挥着重要的作用。热激蛋白又称热休克蛋白,是一种物种间和进化上均高度保守的蛋白质(王宇萍和蒋建东, 2010)。当生物体遭遇极端温度、饥饿胁迫、氧化胁迫、重金属胁迫时,会优先转录该蛋白,引导其他蛋白质的正确折叠,帮助生物体抵御不良环境(Zhao and Jones, 2012)。关于热激蛋白的分类,不同的学者有不同的分类方式,但普遍采纳根据蛋白分子量大小将HSP分为以下5个家族:HSP110, HSP90, HSP70, HSP60和sHSP(Watersetal., 1996)。其中HSP70作为热激蛋白家族的重要组成部分,一直备受国内外关注。研究发现,热激蛋白70家族主要包括诱导型热激蛋白70(heat shock protein 70, HSP70)和组成型热激蛋白70(heat shock cognate protein 70, HSC70)两种类型(Simoncellietal., 2010)。HSP70序列由N端保守的ATPase功能域及C端的底物结合功能域构成(Flahertyetal., 1990)。N端的ATPase功能域可水解ATP,C端的底物结合功能域可与未折叠的多肽底物暴露在外的疏水区域特异性相结合(Kangetal., 1990; Nelsonetal., 1992)。许多学者分别对烟草天蛾Manducasexta(Marinetal., 1994)、二化螟Chilosuppressalis(崔亚东等, 2010)、舞毒蛾Lymantriadispar(Whyardetal., 1986)、粉纹夜蛾Trichoplusiani(Seversonetal., 2005)和叶色草蛉Chrysopaphyllochroma(刘璐, 2014)等昆虫的HSP70基因序列进行克隆,并发现其在抵御高温胁迫中发挥重要作用。杨广生等(2020)基于基因组数据,筛选了4条美国白蛾HSP70基因,并推测其中一条基因在水解ATP中发挥着重要作用,但未阐明HSP70基因在美国白蛾高温胁迫响应中的功能。
在我国,美国白蛾呈现不断向南扩散的趋势,而在南方地区,夏季温度常达35~40℃(中国天气网http:∥www.weather.com.cn/)。由此可见,美国白蛾在扩散的过程中,不可避免地遭受高温胁迫,而目前关于美国白蛾高温胁迫响应的分子机制研究尚属空白。因此,本研究以美国白蛾HSP70基因为研究对象,通过基因克隆、高温胁迫下的表达特性分析、原核表达及纯化及ATPase活性测定等技术,探究HSP70基因在美国白蛾高温胁迫响应中的功能,为美国白蛾发生区域的预测预报及其他昆虫HSP的研究提供参考。
1 材料与方法
1.1 供试材料
美国白蛾幼虫于2019年6月采自江苏省淮安市楚州区古城墙遗址公园(33.62°N, 119.02°E),带回实验室后利用人工饲料进行饲养,饲养条件为:温度26±1℃,相对湿度65%±5%,光周期16L∶8D。成虫羽化后,提供30%蜂蜜水。以室内饲养的第2代4龄幼虫作为实验用虫。
选取新蜕皮的美国白蛾4龄第2天幼虫,分别在25(对照), 30, 35和40℃下处理1, 2和3 h,每3头幼虫混合作为一个样本,每个处理均进行3次生物学重复。所有的样本均用1.5 mL的无核酶离心管保存,转至液氮中速冻,再置于-80℃冰箱中保存用于后续RNA提取及相关实验。
1.2 美国白蛾总RNA的提取和cDNA的合成
利用Trizol法提取1.1节中保存样本的总RNA,通过微量紫外分光光度仪(NanoDrop ND-2000, Thermo, 美国)和1%琼脂糖凝胶电泳检测总RNA的质量和浓度。选择凝胶电泳条带清晰明亮且OD260/OD280值在1.8~2.0之间的mRNA样品,按照反转录试剂盒HiScript Ⅱ Reverse Transcriptase(Vazyme, 南京)的步骤,合成cDNA模板。
1.3 美国白蛾热激蛋白70基因的克隆
基于美国白蛾转录组数据库(本实验室构建,未发表),利用Primer Premier 5.0软件设计引物HSP70-F1/HSP70-R1和HSC70-F1/HSC70-R1(表1),引物由南京金斯瑞生物公司合成。以1.2节中合成的美国白蛾4龄幼虫cDNA为模板,利用LA Taq聚合酶(TaKaRa, 大连)进行PCR扩增。PCR反应体系(50 μL): dNTP Mix(2.5 mmol/L)8 μL, 10×PCR Buffer 5 μL, Mg2+(25 mmol/L)5 μL, 上下游引物(10 pmol/L)各1 μL, cDNA模板(500 μg/μL)1 μL, LA Taq(5 U/μL)0.5 μL, ddH2O 28.5 μL。PCR反应条件: 95℃ 3 min; 98℃ 10 s, 50℃ 15 s, 72℃ 2 min,循环35次; 72℃ 10 min。PCR扩增产物用1.5%的琼脂糖凝胶电泳检测,并且通过DNA回收试剂盒(TIANGEN, 北京)纯化,连接至T/A Blunt Vector载体后,导入大肠杆菌EscherichiacoliDH5α感受态细胞(Vazyme, 南京),在含有氨苄青霉素的LB琼脂板上过夜培养,挑取阳性克隆于LB液体培养基中37℃ 200 r/min孵育2 h,再进行菌液PCR鉴定。将验证正确的菌液送至杰李(上海)生物技术公司测序。
1.4 生物学信息学分析
利用分子生物学软件DNAMAN8.0进行序列的对比和拼接,信号肽预测利用SignalP在线网站(http:∥www.cbs.dtu.dk/services/SignalP-4.0/),等电点及分子质量预测利用在线网站(https:∥web.expasy.org/protparam/),蛋白三维结构预测利用在线网站SWISS-MODEL(https:∥swissmodel.expasy.org/)。利用在线工具NCBI(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)搜索鳞翅目中已知昆虫的热激蛋白70基因序列,利用Clustalx软件进行序列对比,同源搜索鳞翅目、鞘翅目、半翅目、膜翅目、双翅目共5个目41种的HSP70和HSC70氨基酸序列,用MEGA 7.0软件结合邻接法(neighbor-joining method, NJ)进行1 000次抽样分析来构建进化树,并用在线软件iTOL(https:∥itol.embl.de/)进行修饰。
1.5 qPCR检测
本实验选择EF1α作为美国白蛾4龄幼虫不同温度处理下基因表达分析的内参基因(陶蓉等, 2019),内参基因的扩增引物为EF1α-F/EF1α-R(表1)。根据1.3节中克隆获得的HSP70基因序列,利用在线网站(https:∥www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool)设计并筛选qPCR引物HSP70-qF/HSP70-qR和HSC70-qF/HSC70-qR(表1)。qPCR反应在Applied Biosystem 7500 System(Thermo Fisher Scientific, 美国)上进行,反应体系(20 μL): SYBR Green Master Mix(YEASEN, 上海)10 μL, 上下游引物(10 pmol/L)各0.4 μL, cDNA模板2 μL, RNase-free H2O 7.2 μL。反应程序: 95℃ 5 min; 95℃ 10 s, 60℃ 40 s,循环40次; 95℃ 15 s, 60℃ 60 s, 95℃ 15 s形成溶解曲线。每个样品设置3个生物学重复及3个技术重复。
1.6 美国白蛾热激蛋白70的重组表达与纯化
利用CE Design软件(Vazyme, 南京)设计美国白蛾热激蛋白70基因序列的原核表达引物(HSP70-tPCR-F和HSP70-tPCR-R, 表1),引物包含NheⅠ和BamHⅠ酶切位点。同1.3节中操作步骤,引物更换为HSP70-tPCR-F和HSP70-tPCR-R,获得原核表达的DNA模板,随后将其与线性化的pET-28a载体通过ClonExpress II一步克隆试剂盒(Vazyme, 南京)同源连接,并转入到大肠杆菌DH5α感受态细胞,在含有卡那霉素的LB琼脂板上过夜培养,挑取阳性克隆进行菌液PCR,送至杰李(上海)生物技术公司测序。

表1 本研究所用引物
测序正确的质粒转入到大肠杆菌BL21(Vazyme, 南京)感受态细胞中进行蛋白表达。次日挑选单克隆将其转移至含卡那霉素(30 μg/mL)的100 mL新鲜LB液体培养基中,然后孵育至OD600=0.5,将异丙基-β-D-硫代吡喃半乳糖苷(IPTG)(Sango, 上海)添加至最终浓度为1 mmol/L,并在30℃ 200 r/min条件下过夜孵育12 h。在4℃ 11 000 r/min离心15 min得到菌液沉淀,并加入平衡缓冲液(50 mmol/L NaH2PO4和Na2HPO4, 300 mmol/L NaCl, 20 mmol/L咪唑, pH 7.9),搅拌并通过在冰水中超声处理破坏混合物。在4℃ 12 000 r/min离心20 min后,获得上清。重组蛋白通过His60 Ni Superflow树脂和重力柱(TaKaRa, 北京)纯化,纯化的重组蛋白用7.5% SDS-PAGE凝胶分析。
1.7 免疫印迹分析
以1.6节纯化的HcHSP70蛋白作为抗原,取20 μL蛋白进行SDS-PAGE凝胶电泳,将蛋白转移至0.45 μm的PVDF膜。用5%脱脂奶粉溶液封闭,将膜置于含His-tag抗体(Beyotime, 上海)的一抗孵育液中4℃孵育过夜,用TBST缓冲液洗膜,然后将膜转入含有辣根过氧化物酶(HRP)标记的抗兔IgG的二抗孵育液(Beyotime, 上海)中,室温轻摇孵育1~2 h,洗膜后将膜置于West Pico ECL(Biosharp, 武汉)显色拍照。
1.8 美国白蛾热激蛋白70的酶活性测定
采用Zhang等(2018)的方法测定热激蛋白70的酶活性。配制100 μL反应体系,包含2.0 μg HcHSP70/BSA/ddH2O, 1.0 mmol/L Bistris, 1.0 mmol/L KCl, 0.1 mmol/L MgCl2和0.01 mmol/L ATP,其中添加BSA/ddH2O为对照。将反应混合物在25, 30, 35和40℃下孵育10 min后,加入10 μL 55% HClO4终止反应。将混合物放置冰上10 min,然后以12 000 r/min 离心3 min。最后,用微量组织无机磷含量测定试剂盒(Solarbio, 北京)确定无机磷的浓度。热激蛋白70的酶活性定义为1 min内1 mg HcHSP70催化的无机磷的产生量(μmol/min·mg)。
1.9 数据分析
利用IBM SPSS Statistics 20软件进行数据处理,采用单因素分析法中的Duncan氏多重检验法对高温处理下美国白蛾热激蛋白70基因相对表达量及不同温度下HcHSP70重组蛋白的ATP酶活性进行差异显著性分析,差异显著水平为P<0.05。
2 结果
2.1 美国白蛾HSP70基因的克隆以及序列
克隆获得美国白蛾2条HSP70基因HcHSP70(GenBank登录号: MT995848)和HcHSC70(GenBank登录号: MT261583),其ORF长度分别为1 917和2 061 bp,分别编码637和687个氨基酸,分子质量分别约为69.66和74.96 kD,等电点分别为5.90和5.96。HcHSP70与HcHSC70氨基酸序列中存在HSP70家族中3个高度保守的区域GIDLGTTYS, IFDLGGGTFDVSIL和VGGSTRIPKVQ。并具有由AEAYLGKS组成的ATP-GTP结合位点及由PRALRRLRTAAERAKRTL组成的核定位信号标签和非细胞器基序RARFEEL的3个典型特征也高度保守(图1)。亚细胞定位预测HcHSP70位于细胞质中,HcHSC70位于线粒体中。

图1 美国白蛾HcHSP70和HcHSC70与其他鳞翅目昆虫HSP70氨基酸序列对比
利用SWISS-MODEL工具建模,HcHSP70与模板的一致性为53.86%,HcHSC70与模板的一致性为62.27%。预测的美国白蛾HcHSP70和HcHSC70蛋白的三维结构与其他物种热激蛋白70的三维结构高度相似。如图2所示,HcHSP70和HcHSC70的三维结构均是由N端ATPase功能域和C端底物结合功能域所组成。

图2 美国白蛾HcHSC70(A)和HcHSP70(B)的SWISS-MODEL三维结构预测模型
如图3系统进化树所示:HcHSP70和HcHSC70分别属于两个分支,HcHSP70与鳞翅目HSP70家族的其他成员聚为一支,HcHSC70与鳞翅目HSC70家族的其他成员聚为另一支。此外,鞘翅目、半翅目、膜翅目及双翅目各目的热激蛋白70序列同样分为HSP70及HSC70两个分支。

图3 邻接法构建的基于氨基酸序列的美国白蛾和其他昆虫HSP70系统进化树(1 000次重复)
2.2 高温胁迫下美国白蛾热激蛋白70基因的相对表达量
从图4(A)中可以看出,美国白蛾4龄幼虫在30, 35和40℃下分别处理1, 2和3 h,HcHSP70的表达量与对照(25℃)相比显著上调:在1 h时,随着温度的升高,HcHSP70基因的相对表达量持续上升;在35℃ 2 h时,相对表达量达到峰值,约为对照组的183.70倍;但在35和40℃处理3 h时,相对表达量与对照相比则无显著性差异(P>0.05)。
由图4(B)可知,与对照组(25℃)相比,HcHSC70在每个温度梯度、不同时间的相对表达量与对照相比无显著性差异,如在40℃下3 h时相对表达量最高,为对照组的4.76倍,但与对照相比无显著性差异(P>0.05)。
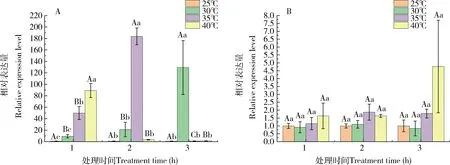
图4 高温处理不同时间后美国白蛾4龄第2天幼虫中HcHSP70(A)和HcHSC70(B)的相对表达量
2.3 美国白蛾热激蛋白70的重组表达与纯化
HcHSP70重组质粒转入BL21表达感受态细胞中的表达产物通过SDS-PAGE分析表明,在69.66 kD处检测到一条明显的诱导表达蛋白条带,而pET-28a空载体则无相应的条带,这与预测的分子量大小一致(图5)。使用Ni2+-His柱进一步纯化可溶性重组蛋白,并且纯化的HcHSP70的浓度为1.7 mg/mL。通过重组蛋白HcHSP70与His-tag抗体发生特异性反应,表明HcHSP70基因已经在大肠杆菌表达系统中正确表达。

图5 重组蛋白HcHSP70的SDS-PAGE分析
2.4 高温下HcHSP70蛋白的ATPase活性
在25, 30, 35和40℃的温度下测定纯化的HcHSP70的ATPase活性分别为27.3039, 25.5823, 23.8551和26.2028 μmol/min·mg pro,高于BSA/ddH2O对照组的活性(图6)。而且,随着温度的升高,HcHSP70蛋白的ATPase活性在不同温度处理之间无显著性差异(P>0.05)。
3 讨论
本研究利用PCR技术首次在美国白蛾中克隆出2条热激蛋白70家族基因的cDNA序列,分别命名为HcHSP70和HcHSC70。氨基酸序列分析表明,这2条基因具备HSP70家族保守的结构特点,并具有3个HSP70蛋白家族的签名序列(Gupta, 1995)和3个真核细胞特征基序(图1)。亚细胞定位的预测结果显示HcHSP70定位于细胞质中,HcHSC70定位于线粒体中。线粒体作为真核细胞的重要“能量工厂”,是细胞进行呼吸等细胞代谢的主要场所(孙飞等, 2008),所以推测HcHSC70可能参与了高温下细胞的代谢过程。
热激蛋白70家族分为诱导型HSP70和组成型HSC70两种类型(Zhangetal., 2011),前者在正常生理状态下表达量极低,胁迫后大量上调;后者正常条件下含量较高,受到胁迫后仅微量上调或不上调。系统发育树显示,不同鳞翅目昆虫的诱导型HSP70之间同源性高于同属于美国白蛾的HcHSP70和HcHSC70之间的同源性,不同鳞翅目昆虫的组成型HSC70之间的同源性同样高于同属于美国白蛾的HcHSP70和HcHSC70之间的同源性(图3)。这表明虽然诱导型HSP70和组成型HSC70的序列结构特征十分相似,但热激蛋白70基因在昆虫进化的早期已经出现两支,使得HSP70和HSC70各自在不同物种间的同源性更高(Delelis-Fanienetal., 1997)。
热激蛋白70基因在转录水平参与美国白蛾幼虫的热胁迫响应。美国白蛾4龄幼虫在热激处理1 h后,HcHSP70的表达量上调,并且与温度梯度呈正相关,在35℃处理2 h时表达量达到峰值(图4: A);而HcHSP70在热激条件下仅微量上调或不上调(图4: B),暗示了HcHSP70在美国白蛾抵御热胁迫时发挥重要作用。但HSP70的上调表达存在极限,如在40℃下2和3 h时HcHSP70表达量并没有上调。这种现象与其他昆虫热激蛋白的转录响应特性一致,如松墨天牛Monochamusalternatus的MaltHSP21.20在45℃时表达量最高,而在50℃处理组中相对表达量呈现下降趋势(李慧等, 2018);烟粉虱Bemisiatabaci在41℃时HSP70基因表达量最高,在43和45℃时表达水平迅速降低(崔旭红等, 2007)。这些结果表明,昆虫热激蛋白70对转录响应存在极限,一方面原因是当外界环境温度过高时,会破坏昆虫体内的正常生理状况;另一方面热激蛋白70过量的表达可能会影响昆虫正常的生长发育,从而对许多生理过程如生殖等带来负面影响(Krebs and Feder, 1997)。
本研究在对HcHSP70重组表达与纯化的基础上进行分子伴侣功能分析,发现HcHSP70在25, 30, 35和40℃下具有高且稳定的ATPase活性(图6)。对松墨天牛的MaltHSP70-2研究中也得到相似结果(Lietal., 2020)。高温胁迫下稳定的结构和构象是HSP70发挥分子伴侣功能的基础,推测HcHSP70蛋白在美国白蛾应对热胁迫中发挥着重要作用(赵超越, 2016)。但是本研究仅限于体外表达重组蛋白来验证HcHSP70具有稳定的ATPase活性,还需要通过RNA干扰或者基因编辑技术进一步探究HcHSP70蛋白在美国白蛾抵御高温胁迫中的作用。
本研究克隆获得2条美国白蛾HSP70基因HcHSP70和HcHSC70,序列分析表明2条基因的编码蛋白均符合热激蛋白70家族的结构特征,并且亚细胞定位预测位于不同的细胞结构中;检测了其在高温处理下mRNA的相对表达量,表明HcHSP70和HcHSC70参与了美国白蛾抵御高温胁迫的过程。此外,通过原核表达及纯化获得美国白蛾HSP70蛋白,并通过体外实验证明重组蛋白HcHSP70在高温处理下具有稳定的ATPase活性,进一步暗示HcHSP70是影响美国白蛾耐热性的重要基因,可以为揭示美国白蛾的扩散机制以及预测潜在分布区提供参考。

