马铃薯StSnRK2基因家族的鉴定与表达分析
秦天元,许德蓉,王一好,孙 超,毕真真,刘玉汇,张俊莲,白江平*
(1.甘肃农业大学农学院,甘肃 兰州 730070;2.甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与栽培种创新重点实验室,甘肃 兰州 730070)
马铃薯(Solanum tuberosum L.),在生物分类学中属于茄科(Solanaceae)龙葵亚属(Subg.Solanum),一年生植物,是全世界第一大粮菜兼用型作物[1,2]。马铃薯是块茎类作物,在整个马铃薯生长发育过程中,逆境胁迫能够改变马铃薯生长期内的源库关系,进而影响块茎的形成,从而造成马铃薯产量降低和品质下降[3-5]。为了避免逆境胁迫造成的不利影响,植物通过调节自身细胞产生有利的化感物质或启动相关基因的表达来响应逆境胁迫,从而形成抵抗各种胁迫的自我保护机制,维持自身正常的生长发育[6,7]。在响应逆境胁迫的机制中,植物蛋白激酶磷酸化起着非常重要的作用,其中,SnRK2蛋白激酶家族是普遍存在于植物中的一类蔗糖非酵解型蛋白激酶,其功能主要参与脱落酸(Abscisic acid,ABA)依赖及非ABA依赖的非生物胁迫,从而影响植物生长发育[8,9]。根据前人的研究,在玉米中共发现SnRK2基因家族有11个成员,其中有7个家族成员分别受NaCl、低温和热处理诱导表达[10,11]。此外,杨树中SnRK2家族成员PtSnRK2.5和PtSnRK2.7在拟南芥中的过表达表明,盐胁迫下拟南芥的叶绿素含量和根系伸长量相对于对照均保持不变,提高了植株的存活率。同时,PtSnRK2.7 或还可影响脂质代谢、类黄酮代谢相关基因、转录因子和一些离子转运相关基因的表达[12];甘蔗SnRK2 家族成员SoSnRK2.1在烟草中的过量表达可以提高烟草的抗旱性[13];研究发现,拟南芥种子在萌发、生长和休眠等生育期AtSnRK2.2/3/6 基因在干旱胁迫后其表达量发生变化,表明这些基因可响应ABA 的信号转导[14-18];此外,在水稻中关于SnRK2 家族成员的研究表明,在盐胁迫下,SAPK4 基因可通过调节水稻体内的离子平衡,来响应逆境胁迫[19]。目前,越来越多的植物研究表明,SnRK2家族蛋白激酶可参与响应植物非生物胁迫和ABA依赖[16,20,21]。
目前,关于SnRK2家族基因已在多种作物中得到了广泛的研究。例如小麦[22,23]、玉米[24]、水稻[19,25]、高粱[26]、烟草[27]等。马铃薯作为全球第四大粮食作物,研究干旱胁迫下马铃薯相关基因的表达模式和分子机制,对于提高马铃薯品质和产量具有重要意义。目前国内外关于马铃薯中StSnRK2基因家族成员的研究相对较少[28-30]。通过对前期在干旱条件下马铃薯StSnRK2基因成员表达谱的分析,发现StSnRK2家族成员中不同基因的表达存在差异。因此,本文采用比对的方法,从新发布的马铃薯全基因组数据库中系统地鉴定并分析了StSnRK2 基因家族成员,并对其序列特征、染色体定位和基因复制等方面进行了综合分析。这些结果为进一步分析马铃薯StSnRK2基因家族的分化过程和生物学功能奠定了基础,同时也为马铃薯抗逆基因的挖掘和筛选提供理论依据。
1 材料与方法
1.1 马铃薯StSnRK2基因家族成员的鉴定
从Spud DB数据库下载马铃薯最新杂合二倍体参考基因组序列(http://solanaceae.plantbiology.msu.edu/rh_potato_download.shtml)鉴定马铃薯基因组中的StSnRK2基因家族成员[31]。利用SnRK2基因家族的隐马尔可夫模型(注册号:PF00069.25)和本地Blast等多种比对的方法进行多重搜索[32]。此外,根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)中关于拟南芥、水稻、玉米等物种的SnRK2基因序列作为种子序列,为了尽可能地搜索真正的StSnRK2基因家族成员,使用e 值≤1e-20 来基于Blast算法进行搜索。将经过多重比对后的StSnRK2家族成员的蛋白序列提交到CDD 数据库(https://www.ncbi.nlm.nih.gov/structure/bwrpsb/bwrpsb.cgi)和Pfam数据库(http://pfam.xfam.org/)来进一步确认符合StSnRK2保守域的最终家族基因成员[31,33,34]。
1.2 马铃薯StSnRK2基因的生物信息学分析
利用CDD 和Pfam 数据库将最终鉴定到的StSnRK2基因进行系统发育分析。将所有家族成员基因的蛋白序列先使用ClustalX(版本1.83)软件[35]结合系统默认参数进行比对。将比对后的文件保存为meg格式后,再使用MEGA7软件[36]进行系统进化树的构建,使用方法为最大似然数法,其中将Bootstrap 值设置为1 000,最后根据系统发育树的拓扑结构,可以将马铃薯StSnRK2基因成员分为不同的亚族。ExPASy网站(http://web.expasy.org/protparam/)[31]可用来计算StSnRK2基因成员的氨基酸数量、分子量和等电点(pI)等指标。利用本地MEME工具(版本4.11.2,http://alternate.meme-suite.org/tools/meme)采用Perl 语言来搜索马铃薯StSnRK2 家族成员序列中的保守基序[31,37]。通过在线软件(PG2C,http://mg2c.iask.in/mg2c_v2.1/)和(GSDS,http://gsds.cbi.pku.edu.cn/)来分别构建马铃薯StSnRK2家族成员基因的染色体位置图和外显子-内含子结构图。采用Perl 语言编写代码来提取马铃薯StSnRK2 家族成员基因编码区上游1.5kb的序列,并提交到在线数据库PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)中进行该基因家族中重要的顺式作用元件的鉴定。利用MCScanX[38]和Circos[39]软件来研究马铃薯不同染色体间StSnRK2 基因的串联重复和片段复制现象,并借助于烟草参考基因组来进一步探究马铃薯StSnRK2 基因与烟草之间的比对基因组分析[31]。
1.3 马铃薯StSnRK2的基因表达模式分析
本试验利用马铃薯数据库(http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml)中已上传的关于马铃薯二代Illumina 的公共RNA-seq 数据,并自主进行Cufflink和Tophat的分析。具体挑选为马铃薯StSnRK2 基因在150 mmol/L NaCl 下处理24 h、260 μmol/L 甘露醇(Mannitol)下处理24 h、50 μmol/L ABA下处理24 h 和10 μmol/L吲哚乙酸(Indoleacetic acid,IAA)下处理24 h的FPKM值,并根据其FPKM 值进一步研究马铃薯StSnRK2 基因家族中不同基因的表达模式,运用R 软件中的Heatmap包来绘制马铃薯StSnRK2基因家族的表达模式热图。
1.4 马铃薯StSnRK2基因的qPCR分析验证
采用RNA prep Pure Plant Kit(TIANGEN)试剂盒来提取马铃薯的总RNA,用1%琼脂糖凝胶电泳检测RNA的完整性、用核酸测定仪(P100)检测RNA的浓度与纯度。检测合格后,使用ReverTra Ace qPCR RT Master Mix(TOYOBO)反转录试剂盒将RNA 反转录为cDNA,用于后期基因表达量的测定。使用QuantStudio5 实时荧光定量PCR(ABI,美国)进行qPCR 的测定。反应体系为20 μL:SYBR Premix Ex Tap TM 10 μL,引物F(10 μmol/L)0.8 μL,引物R(10 μmol/L)0.8 μL,cDNA 2 μL,ROX Reverence Dye(2X)0.4 μL,ddH2O 6 μL。PCR 扩增程序为:95℃预变性30 s;95℃变性5 s,58℃退火34 s,40个循环;95℃变性15 s,58℃退火60 s,95℃处理15 s。试验以肌动蛋白(actin)为内参基因,采用2-ΔΔCt法计算马铃薯StSnRK2 基因的相对表达量[31]。
2 结果与分析
2.1 马铃薯StSnRK2基因家族成员的鉴定与分析
采用本地Blast的生物信息学方法进行分析,从马铃薯‘RH89-039-16’全基因组中共鉴定和分析了StSnRK2基因38个StSnRK2,再通过局部保守序列的BLASTP发现28个序列。删除两种方法比对后的重复序列,最终保留26 个特征序列,并提交至CDD 和Pfam在线数据库中进行保守StSnRK2蛋白结构域的确认。最后,共鉴定到23 个StSnRK2 家族成员,分别命名为StSnRK2.1~StSnRK2.23(表1)。表1 列出了基因ID、染色体位置、氨基酸数、分子量和pI。马铃薯中StSnRK2 家族基因长度范围从286(RHC11H2G0520)到491 个氨基酸(RHC01H2G4721)不等。StSnRK2 的分子量为32.6(RHC11H2G0520)~55.4 kD(RHC01H2G4721)。StSnRK2 基因分布于12对马铃薯染色体上。StSnRK2 基因的预测等电点为4.51(RHC11H2G0520)~9.47(RHC02H2G1792)。以上结果表明,StSnRK2基因家族中,不同基因的长度相差较大,且与分子量有关。此外,大多数StSnRK2蛋白(65%)的pI小于7.0,由于pI主要取决于氨基酸中酸性氨基酸和碱性氨基酸的比值,因此推断该家族大多数基因蛋白可能是一类酸性蛋白(表1)。
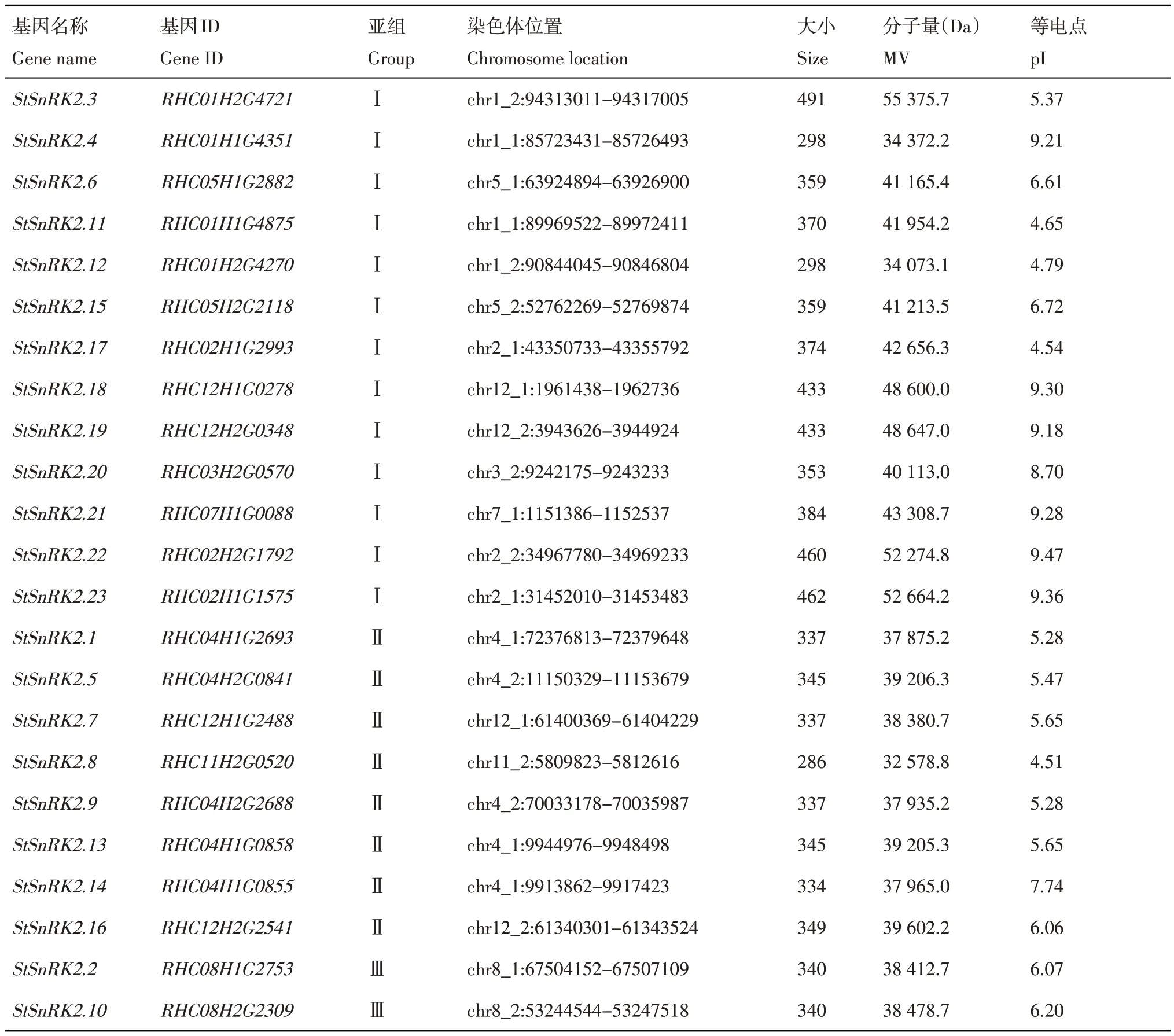
表1 马铃薯StSnRK2基因家族信息Table 1 Information of StSnRK2 gene family in potato
2.2 马铃薯StSnRK2氨基酸序列同源性比对及其进化分析
StSnRK2基因家族成员蛋白主要由2部分组成,其中70%的部分为N末端激酶结构域,另外30%的部分位于C末端。其中,能够响应非生物胁迫的激活区域(Domain Ⅰ)和ABA激活结构域(Domain Ⅱ)的部分主要分布在C末端。对马铃薯23条StSnRK2氨基酸序列进行多重序列比对,发现该基因家族在N端具有较高的保守性,属于StSnRK2基因家族成员的核心区域。C末端存在响应非生物胁迫的激活区域(Domain Ⅰ),该结构域存在于所有家族成员中。除StSnRK2.4和StSnRK2.20两个蛋白外,其余21个StSnRK2蛋白C末端均存在能够响应ABA的结构域(Domain Ⅱ)(图1)。

图1 马铃薯23个StSnRK2蛋白多序列比对Figure 1 Alignment of amino acid sequences of StSnRK2 in potato
为了进一步了解马铃薯StSnRK2基因家族成员的同源性,利用水稻、拟南芥、玉米等物种中已鉴定出的SnRK2基因为种子序列,共同构建了与马铃薯StSnRK2 的系统发育树,聚类结果显示为3 个亚族:Ⅰ、Ⅱ和Ⅲ,分别含有13、8、2个StSnRK2基因(图2)。
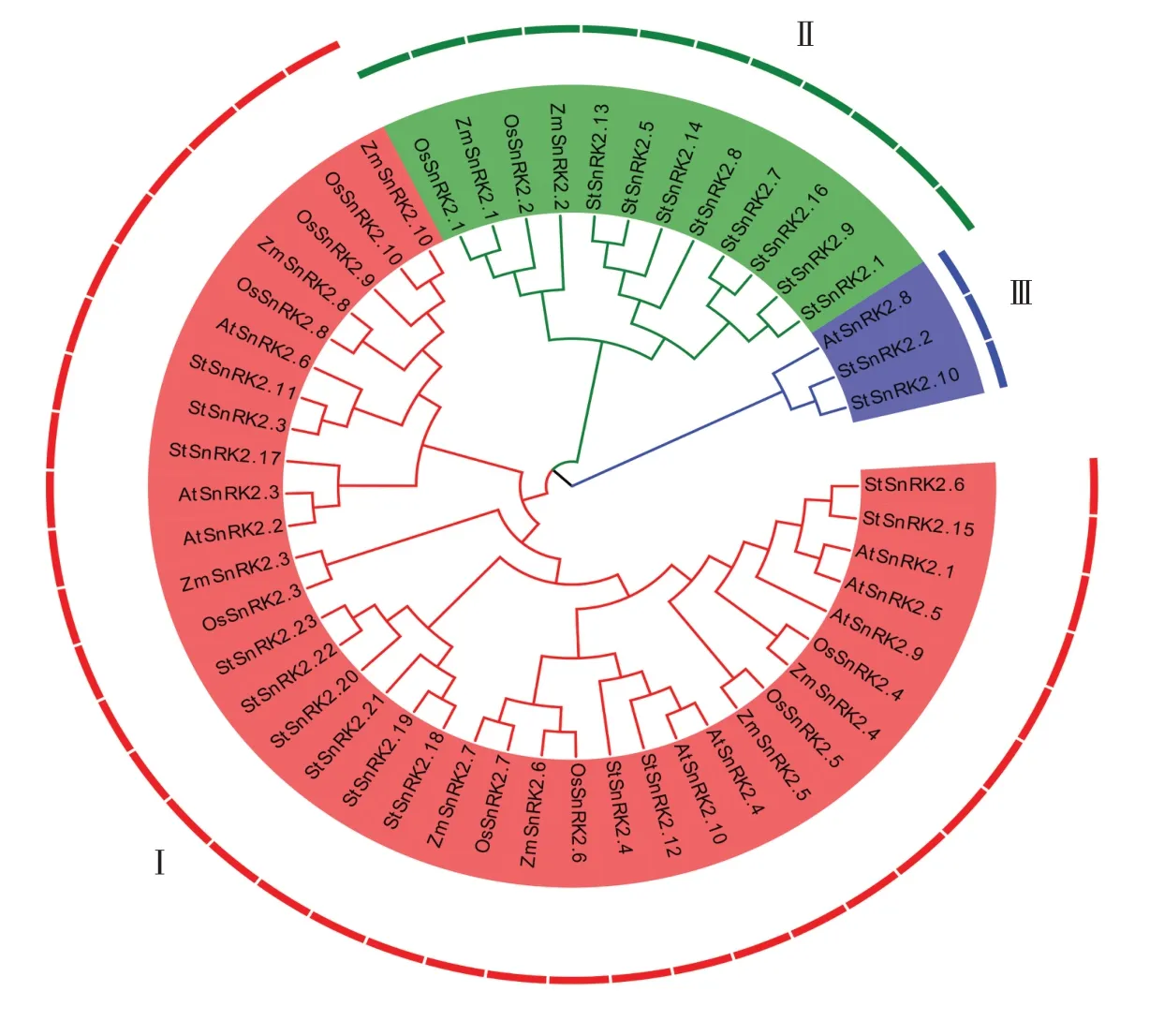
图2 马铃薯StSnRK2基因家族系统进化树Figure 2 Unrooted phylogenetic tree of potato StSnRK2 gene family
2.3 马铃薯StSnRK2基因家族的结构特征分析
马铃薯StSnRK2基因家族3个亚族间的基因结构有显著差异。其中,I亚族中外显子的数目为1~10个,且有部分基因在进化过程中可能完全丢失了内含子;II亚族为7~9个,而III亚族成员外显子数目只有9 个(图3A)。同一亚族的基因外显子结构相似,但相似的外显子长度却有不同的基因全长,这说明内含子长度可能有很大的差异。由图3B可知,马铃薯StSnRK2基因家族蛋白共鉴定获得10个保守基序(Motif)。其中,I亚族的蛋白保守序列较II和III亚族结构相对复杂,第I亚族中包含所有保守基序为Motif 1~Motif 10,第II亚族和第III亚族中均只包含Motif 1~Motif 9,Motif 10 只特异性位于亚族Ⅰ中。这些结果表明,马铃薯StSnRK2 基因家族均含有Motif 1~Motif 9结构域,但部分成员的其他结构域并不完整。从3 个亚族的结构来看,I 亚族包含Motif 10的基因均不含Motif 4和Motif 8;II亚族和III亚族中Motif在各个基因上的分布基本一致。说明这些基因在遗传进化过程中可能存在遗传信息的遗失与改变(图3B)。
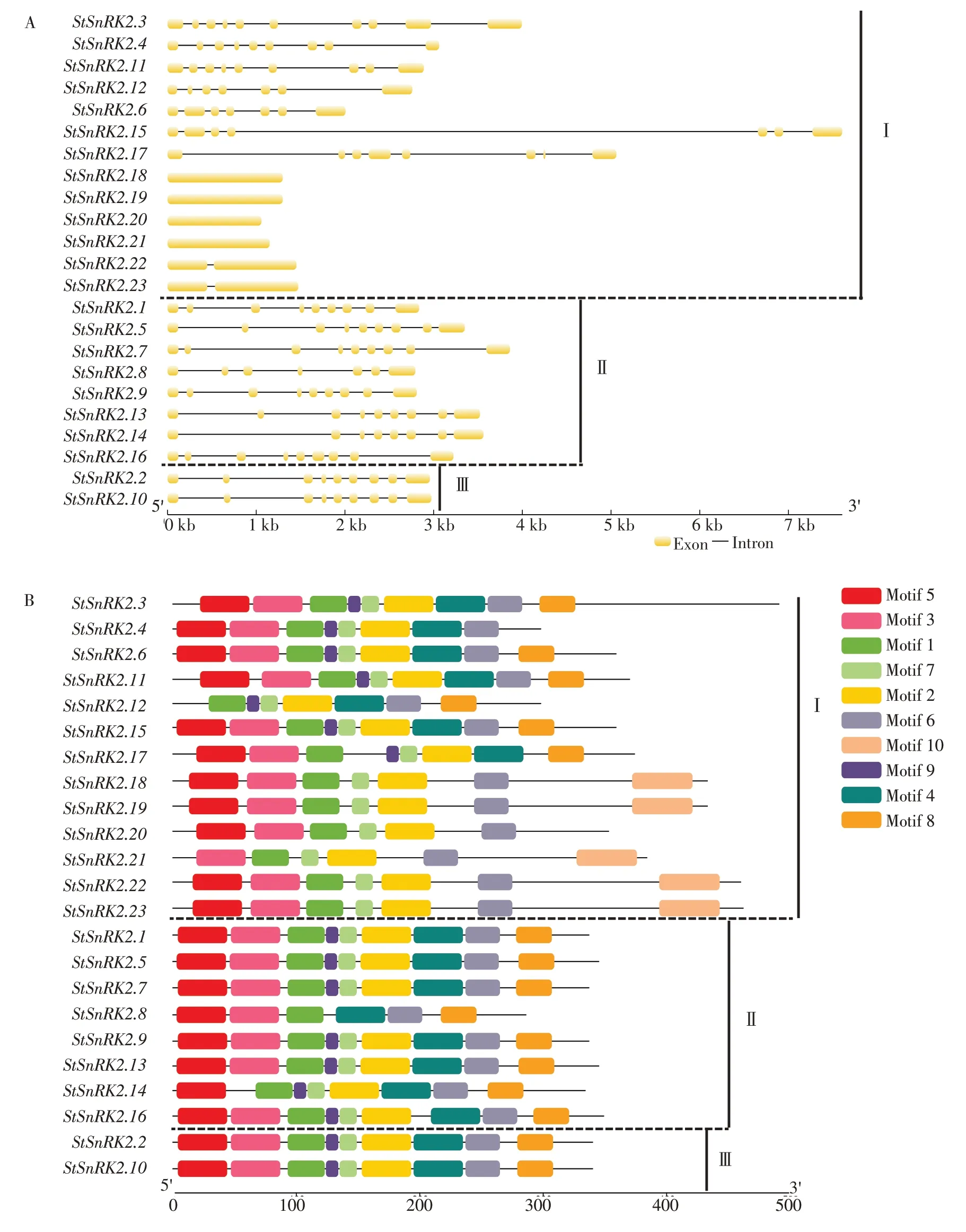
图3 马铃薯StSnRK2基因家族成员的结构特征Figure 3 A structural characteristics of StSnRK2 family in potato
2.4 马铃薯StSnRK2基因启动子与胁迫相关的顺式元件分析
为了进一步研究StSnRK2基因在非生物胁迫反应中的潜在调控机制,利用Perl 语言提取StSnRK2家族基因编码区上游1.5 kb的序列提交到PlantCare网站进行顺式元件的预测。共检测到6个非生物胁迫响应元件,分别为脱落酸响应元件ABRE,生长素响应元件AuxRR-core,与分生组织表达有关的作用元件CAT-box,参与干旱诱导相关的作用元件MBS,赤霉素响应元件TATC-box以及参与防御和应激反应的作用元件TC-rich。通过3个亚族中不同顺式元件的分布情况可知,马铃薯StSnRK2基因家族均含有ABRE,CAT-box,MBS和TATC-box 顺式作用元件,其中Ⅰ亚族基因相对于Ⅱ亚族富含更多参与生长素响应元件AuxRR-core,而Ⅱ亚族基因相对于Ⅲ亚族富含更多参与防御和应激反应的作用元件TC-rich(图4)。以上结果表明,StSnRK2基因的表达与这些非生物胁迫应激相关且StSnRK2基因对不同的非生物胁迫作出不同反应可能也与此相关。
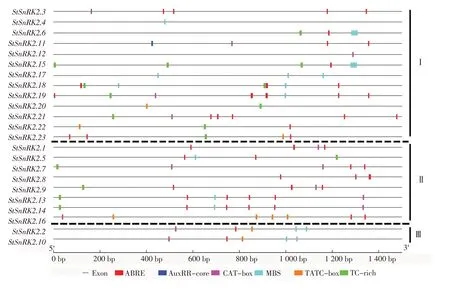
图4 马铃薯StSnRK2基因启动子顺式元件预测分析Figure 4 Predicted analysis of cis-elements in StSnRK2 promoters
2.5 马铃薯StSnRK2基因家族的染色体定位分析与基因复制
依据马铃薯StSnRK2染色体位置信息,23条基因不均匀地分布在马铃薯其中9对染色体,共计15条染色体上(图5)。其中4_1号染色体上分布的基因较多为3 条,其余染色体上大多分布于1 到2 条基因。3_2、4_1、7_1和11_2号染色体上的基因主要分布在其上端,1_1、1_2、2_1、5_1、5_2、8_1和8_2号染色体的基因则分布在其下端。通过3个亚族基因在染色体上分布情况比较,发现I亚族基因主要集中在1_1、1_2、2_1、2_2、3_2 和7_1 号染色体上;Ⅱ亚族基因主要集中在4_1、4_2和11_2号染色体上;Ⅲ亚族基因主要集中在8_1 和8_2 号染色体上。此外,12_1和12_2号染色体上共同含有Ⅰ亚族和Ⅱ亚族基因。在进化过程中,串联重复和片段复制共同参与了基因家族的产生,为了进一步研究马铃薯StSnRK2基因家族在进化过程中遗传信息是否发生了串联重复或大片段基因复制现象,通过MCScanX及下游程序对该家族基因的共线性和串联重复基因进行了分析(图6)。结果发现,15 个基因被证实为串联重复和片段复制基因,占StSnRK2基因家族所有基因的65.2%。其中,位于1_1、1_2、4_1、4_2、5_1、5_2、8_1 和8_2 号染色体上的8个基因为4对独立的串联重复基因,占所有共线性基因的53.3%,其余7 个基因不但发生了串联重复同时也发生了片段复制,且不均匀分布于4_1、4_2、7_1、12_1 和12_2 号染色体,占所有共线基因的46.7%。根据以上结果,可以推断,串联重复和片段复制共同促进了马铃薯StSnRK2 基因家族的扩大。

图5 StSnRK2基因在马铃薯染色体上的位置Figure 5 Chromosome location of StSnRK2 genes in potato
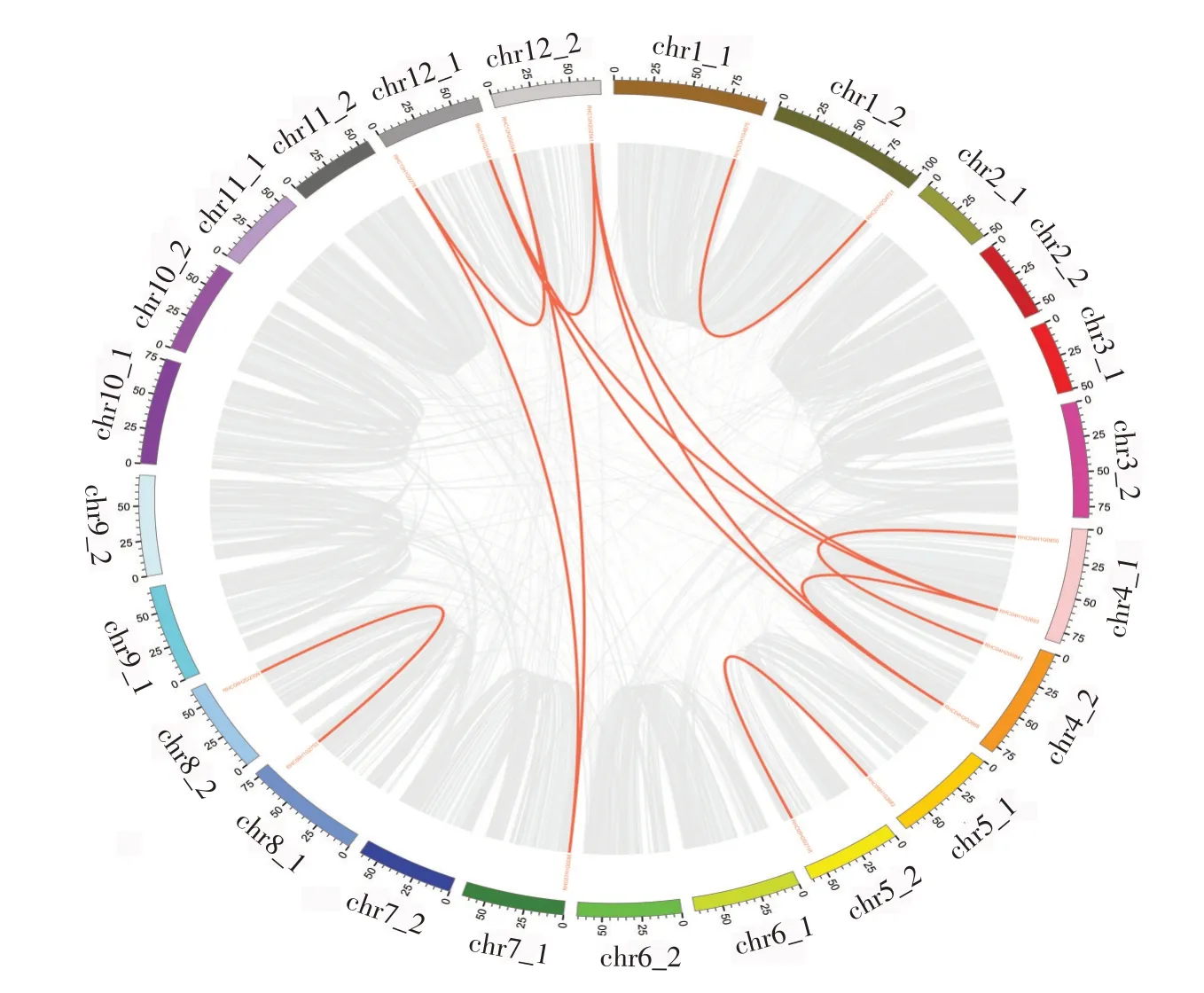
图6 马铃薯StSnRK2基因家族的共线性分析与基因复制Figure 6 Collinearity analysis and gene replication of potato StSnRK2 gene family
2.6 烟草和马铃薯StSnRK2基因家族的比较基因组分析
为了更进一步研究马铃薯StSnRK2 基因的进化机制,基于烟草和马铃薯基因组数据库构建物种间全基因组共线性关系。结果显示(图7),共有10 条StSnRK2 基因与5 条烟草NtStSnRK2 基因构成10 条共线性关系,其中共线性关系主要集中于马铃薯1、3、4、7、8 和12 这6 对染色体与烟草1、8、9和11号染色体之间。在对烟草和马铃薯基因组间共线性进行分析时,发现马铃薯StSnRK2基因与烟草之间的共线性主要集中在1 号染色体上,马铃薯1号、4号和12号染色体的下半部分与烟草的1号染色体上半部分同源,而7号和12号染色体上半部分与烟草的11 号染色体下半部分同源。对于上述结果中存在的同源基因对的位置及类型差异,推测可能与近缘物种的祖先分化有关,也进一步为染色体间能够进行基因片段复制融合提供了有力证据,同时也说明同源染色体间可能还存在一些染色体间不同位置的重排现象。
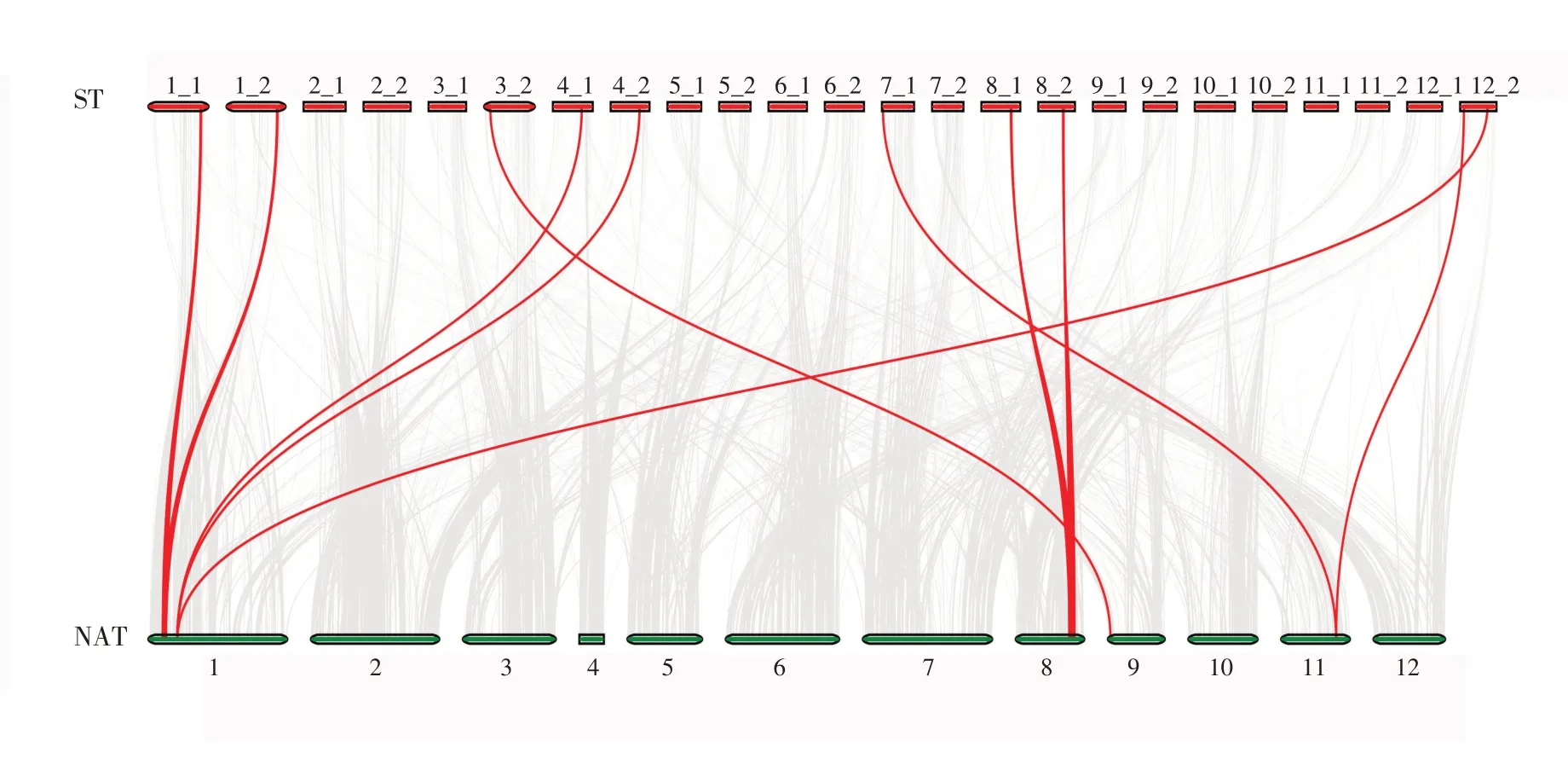
图7 烟草和马铃薯StSnRK2基因家族基因的比较基因组分析Figure 7 Comparative genomic analysis of StSnRK2 gene family genes in tobacco and potato
2.7 马铃薯StSnRK2基因在干旱胁迫下的表达模式分析
本研究中使用的马铃薯RNA-seq 数据为FPKM。与原始读取计数相比,FPKM值可以更好地减少样本差异。利用基于R语言的DESeq2软件,分析并调取23 个马铃薯StSnRK2 基因在150 mmol/L NaCl下处理24 h、260 μmol/L Mannitol下处理24 h、50 μmol/L ABA下处理24 h和10 μmol/L IAA下处理24 h的FPKM值,并根据其FPKM值进行不同胁迫下的基因表达分析。结果显示,马铃薯StSnRK2基因家族的3个亚族基因在不同胁迫处理下具有不同程度的表达趋势。其中,在亚族I中的基因主要响应NaCl、甘露醇和ABA胁迫,且53.8%的基因在ABA处理24 h后表达量显著升高;II亚族基因主要响应ABA 胁迫,87.5%的基因在ABA 处理24 h 后高表达;III亚族基因则主要响应NaCl和甘露醇胁迫,在胁迫24 h时基因表达量有明显的上升。3个亚族内部呈现出不同的表达模式,有15 个StSnRK2 基因在ABA 胁迫24 h 时表达量发生上调,证明这部分基因对马铃薯响应ABA 胁迫具有重要的作用。此外干旱胁迫下的差异表达模式表明,StSnRK2 基因家族在不同胁迫条件下3 个亚族内基因具有不同的反应和调控机制(图8)。随后重新处理了材料,并在3个亚族内随机选取了8个基因StSnRK2.2、StSnRK2.5、StSnRK2.6、StSnRK2.9、StSnRK2.10、StSnRK2.12、StSnRK2.16和StSnRK2.22进行qPCR验证(图9)。并利用qPCR结果和RNAseq 数据进行相关性分析,结果发现,qPCR与RNAseq之间具有较强的相关性,这些结果进一步证实了转录组测序的可靠性(图10)。以上结果表明,StSnRK2基因家族成员可响应盐、ABA、IAA等多种非生物胁迫。
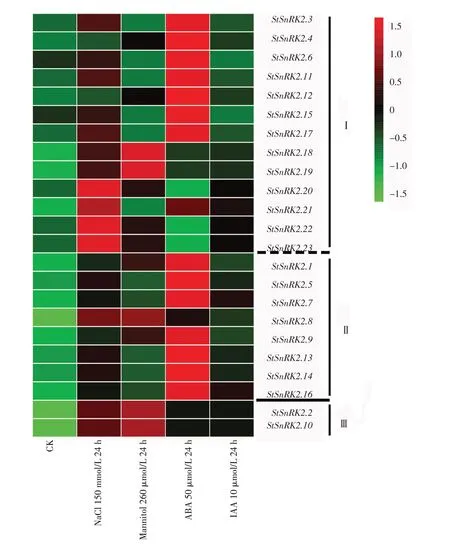
图8 马铃薯StSnRK2基因在不同胁迫下的表达模式分析Figure 8 Expression patterns of potato StSnRK2 genes under different stresses

图9 马铃薯StSnRK2基因家族部分基因在不同胁迫下的基因表达Figure 9 Gene expressions of some genes in potato StSnRK2 gene family under different stresses
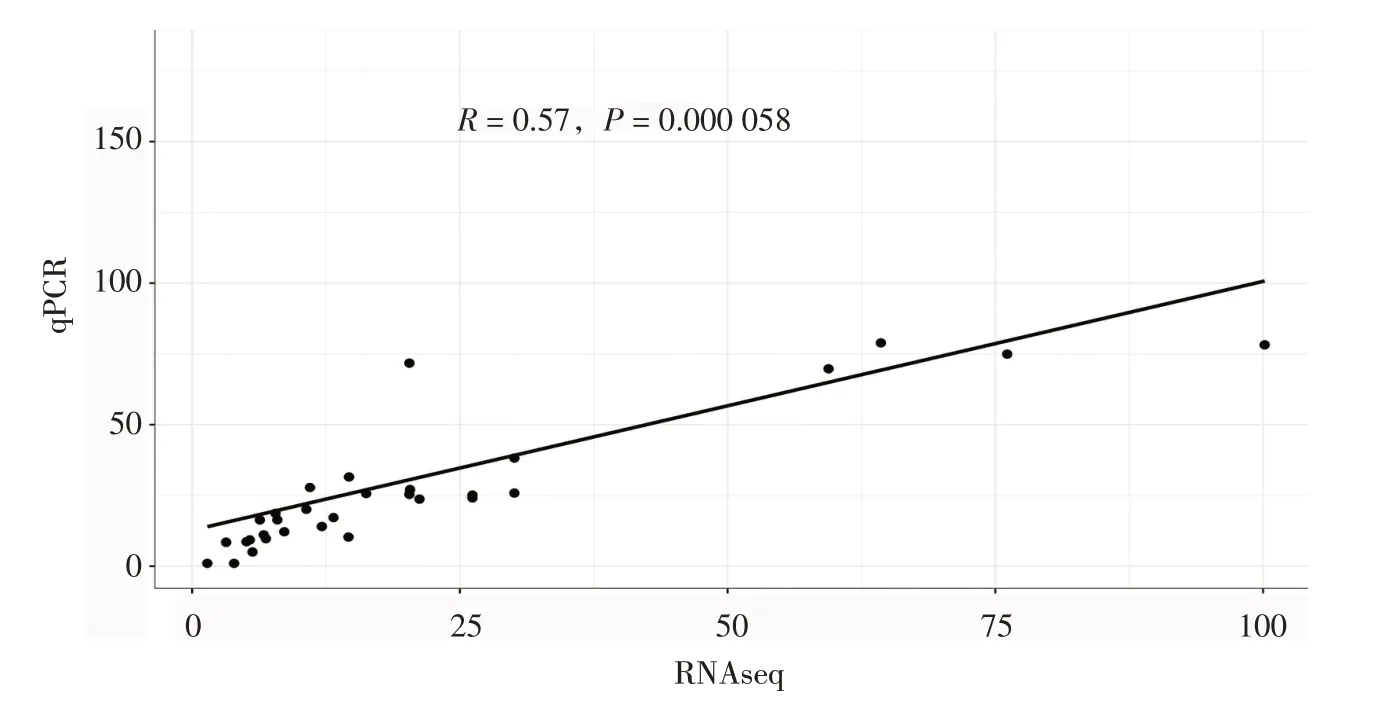
图10 马铃薯StSnRK2基因家族部分基因qPCR和RNAseq数据间的相关性分析Figure 10 Correlation analysis between qPCR and RNAseq data of some genes in potato StSnRK2 gene family
3 讨论
目前,中国马铃薯主要种植于年平均降水量小于500 mm的干旱和半干旱地区。干旱胁迫会极大的影响马铃薯的植株长势,严重会导致其产量的下降甚至绝收[40,41]。SnRK2是一类植物中特有的蔗糖非酵解型蛋白激酶,越来越多的研究表明StSnRK2家族成员在植物响应抗逆胁迫中发挥重要的作用[42-44]。随着许多植物全基因组序列的获得,SnRK2基因已经在多个物种中被鉴定出来,如拟南芥[17,28]、小麦[22,23]、玉米[24]和水稻[19,25]等。
本研究从马铃薯最新发表的参考基因组‘RH89-039-16’中经过Fgensh[45]和Blast[46]方法克隆得到了马铃薯StSnRK2基因家族中的23成员,分别命名为StSnRK2.1~StSnRK2.23。序列比对结果表明,马铃薯StSnRK2 基因家族成员在N 端相对保守,而在C端高度特异,这与马宗桓等[47]在葡萄中的研究结果一致。系统发育树显示StSnRK2基因可分为3个不同的亚家族,而不同亚族的结构域差异又决定了其功能的多样性,这与Li等[26]在高粱中的研究结果相似。除此之外,有研究表明植物在受到干旱等逆境胁迫时,通过调控体内信号传递,进而激活相应的转录因子并调控植物体内相关抗逆基因的转录表达[48]。本试验通过对马铃薯StSnRK2基因家族顺式作用元件分析发现3 个亚族基因中均含有ABRE,CAT-box,MBS 和TATC-box 顺式作用 元件,这对研究该家族响应抗逆性顺式作用元件的功能提供一定的参考。
研究发现基因家族的扩展和基因组进化机制主要取决于基因复制事件,其主要的复制模式为串联复制和片段复制[31,49]。在本研究中,通过基因共线性分析发现,在马铃薯StSnRK2家族成员中共检测到15个StSnRK2重复基因,其中包括8个串联重复基因和7 个片段重复基因(图6),这表明串联重复和片段复制共同促进了马铃薯StSnRK2基因家族的进化,这与Qin等[50]在小麦中关于SWEET基因家族成员扩展的研究结果相似。与烟草比对基因组研究结果发现不同染色体间不仅能够进行基因片段复制融合而且还可能存在一些染色体间不同位置的重排现象,这种复制现象在大多数植物中非常普遍,且在现代植物核型形成的重要分子机制中起着关键作用[51]。
SnRK2s是植物特有的能够响应非生物胁迫的蛋白激酶家族之一,有研究表明SnRK2s能够通过结合脱落酸反应元件(ABFs)来激活下游基因,从而激活ABA响应基因的表达[21,52]。在本研究中,发现有15个StSnRK2 基因在50 μmol/L 的ABA 处理24 h 时表达量发生明显的上调表达,推测这些成员能够响应ABA激素信号传导并参与植物调控胁迫应激过程。除上述ABA诱导途径外,SnRK2s亚家族成员对其他非生物胁迫(NaCl、Mannitol、IAA)也高度敏感。上述结果表明马铃薯StSnRK2基因家族成员可以通过多种途径对逆境胁迫做出反应,进而维持植物细胞的正常代谢和生长发育。本研究为马铃薯StSnRK2基因家族成员提供了较全面的信息,为进一步研究该基因家族每个成员的功能和作用机理提供了理论依据。
本研究通过对马铃薯StSnRK2家族进行全基因组分析,最终确定出23个StSnRK2基因。基于生物信息学方法,对StSnRK2基因在基因结构、系统发育和逆境相关顺式元件等方面进行了全面分析,并根据系统进化和基因结构特征将马铃薯StSnRK2家族基因分为3个亚族,不同亚族内基因的结构、保守Motif及顺式作用元件等均不同;StSnRK2基因不均等地分布在12 对染色体上,并有多个基因发生了片段复制,且染色体间不仅能够进行基因片段复制融合还可能存在一些染色体间不同位置的重排现象。StSnRK2 基因家族3 个亚族之间具有明显的响应不同逆境胁迫的差异性表达,且有部分基因协同调控了马铃薯应对逆境胁迫的响应。

