重度子痫前期合并胎儿生长受限的凝血指标、脐血流S/D值以及母婴结局分析
仲艳敏
广州市妇女儿童医疗中心妇产科,广东 广州 510000
子痫前期是妊娠期特有的疾病,该疾病属于妊娠期高血压疾病的一种。相关文献显示子痫前期在世界范围内发病率为2%~5%,还有临床研究显示,一些胎儿生长受限患者病情进一步发展,会合并子痫前期,发生率为21.7%~61.9%[1-2]。重度子痫前期患者病情较为严重,胎盘微循环出现异常,导致胎盘血流灌注减少,进而阻碍胎儿供氧及营养物质的吸收,随着病情的进一步发展易产生宫内生长受限。重度子痫前期合并胎儿生长受限是现阶段引起孕产妇和围产儿死亡的主要因素。现阶段仍未明确重度子痫前期发病机制,大部分学者认为和母体炎性反应、氧化应激反应、内皮功能异常、螺旋动脉重塑受损、胎盘灌注降低、滋养层细胞异常入侵等因素相关[3]。有临床研究显示,血液高凝状态、凝血功能异常、血管内皮细胞损伤均是诱发重度子痫前期的重要因素[4]。进而可通过相应凝血指标判断患者疾病详情,而通过超声脐血流可明确胎儿有无生长,为临床期待治疗提供参考。因此本次选择重度子痫前期以及合并胎儿生长受限患者为研究对象,针对重度子痫前期合并胎儿生长受限的D-二聚体、蛋白S、蛋白C、抗凝血酶III、脐血流S/D值以及母婴结局进行了研究,详情研究内容如下。
1 资料与方法
1.1 一般资料
在2019年1月—2020年10月时间段内,选择在广州市妇女儿童医疗中心产科进行治疗和分娩的72例重度子痫前期患者为研究对象,选择回顾分析法对其临床资料进行分析,将36例合并胎儿生长受限的患者纳入实验组,另外36例未合并胎儿生长受限的患者纳入对照组。实验组:年龄21~44岁,平均年龄(32.5±9.4)岁;孕周为27~34周,平均孕周为(30.5±3.1)周;20例初产妇、16例经产妇。对照组:年龄22~41岁,平均年龄(31.4±8.7)岁;孕周为28~33周,平均孕周为(29.7±2.9)周;19例初产妇、17例经产妇。所有患者以上相关资料对比,差异无统计学意义(P>0.05)。
1.1.1 纳入标准 患者符合第九版《妇产科学》中重度子痫前期、胎儿生长受限诊断标准[5]:重度子痫前期:舒张压超过110 mmHg或(和)收缩压超过160 mmHg,出现微血管内溶血、肾功能受损、肝酶异常现象、肺水肿、中枢神经系统异常或视觉障碍。胎儿生长受限:胎儿体重低于同胎龄体重第10百分位数。
1.1.2 排除标准 合并妊娠糖尿病患者;合并原发性高血压疾病患者;甲状腺功能性疾病病史患者;合并机体脏器功能严重障碍患者;一周前进行过抗凝治疗患者;胎儿染色体异常或基因缺陷者;临床资料不完整患者。
1.2 方法
采集两组患者治疗前的空腹静脉血3 mL,离心处理后检测D-二聚体、蛋白S、蛋白C、抗凝血酶III水平;间隔三天进行一次胎儿彩超检查,了解胎儿脉血流S/D详情;期待治疗:予以患者促胎肺成熟、镇静、降压、解痉治疗,治疗期间根据患者具体病情,适时终止妊娠;记录患者分娩孕周、住院时间以及产妇并发症和围产儿结局
1.3 统计学方法
选用统计软件SPSS 22.0对本次研究所涉及的数据进行分析,均数±平方差代表计量资料,以t检验。百分比率(%)代表计数资料,以χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 对比72例患者D-二聚体、蛋白S、蛋白C、抗凝血酶III、脐血流S/D值详情
在D-二聚体、抗凝血酶III、脐血流S/D值上,和对照组相比,实验组明显下降(P<0.05);两组患者的蛋白S水平对比差异较大(P<0.05);两组患者的蛋白C水平对比无明显差异(P>0.05),见表1。
表1 对比72例患者D-二聚体、蛋白S、蛋白C、抗凝血酶III、脐血流S/D值详情(±s)
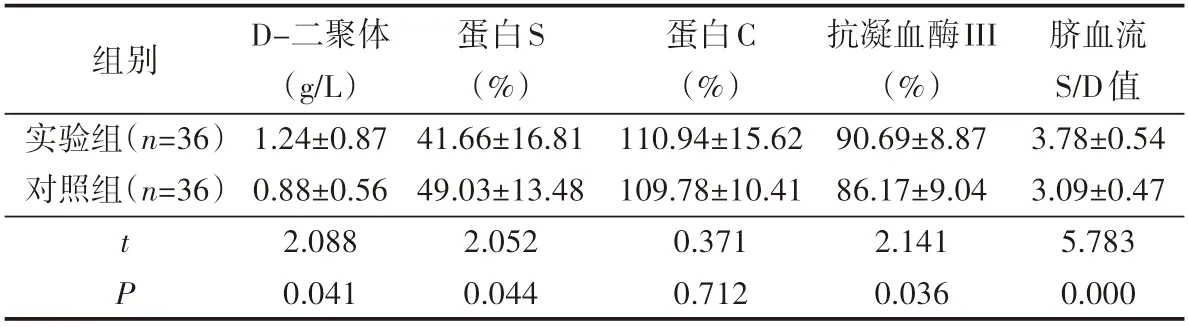
表1 对比72例患者D-二聚体、蛋白S、蛋白C、抗凝血酶III、脐血流S/D值详情(±s)
D-二聚体(g/L)蛋白S(%)蛋白C(%)抗凝血酶III(%)脐血流S/D值组别实验组(n=36)对照组(n=36)1.24±0.87 0.88±0.56 41.66±16.81 49.03±13.48 110.94±15.62 109.78±10.41 90.69±8.87 86.17±9.04 3.78±0.54 3.09±0.47 t P 2.088 0.041 2.052 0.371 0.044 0.712 2.141 0.036 5.783 0.000
2.2 对比72例患者分娩孕周、住院天数
在分娩孕周、住院天数上,实验组和对照组对比差异较小(P>0.05),见表2。
表2 对比72例患者分娩孕周、住院天数(±s)
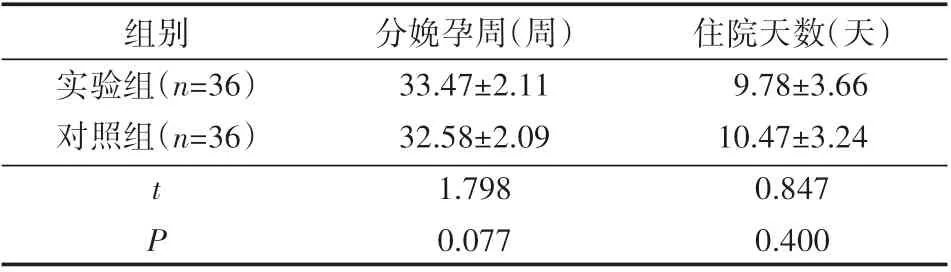
表2 对比72例患者分娩孕周、住院天数(±s)
分娩孕周(周) 住院天数(天)组别实验组(n=36)对照组(n=36)33.47±2.11 9.78±3.66 32.58±2.09 10.47±3.24 t P 1.798 0.847 0.077 0.40 0
2.3 对比72例患者并发症发生详情
两组患者在HELLP综合征、急性左心衰、胎盘早剥、腹水、胸水、视网膜水肿发生率上,无明显差异性(P>0.05),见表3。

表3 对比72例患者并发症发生详情 例(%)
2.4 对比两组围产儿不良结局发生详情
在胎儿窘迫终止妊娠率,和对照组相比,实验组显著提高(P<0.05);两组体重相比,实验组明显低于对照组(P<0.05);两组黄疸、贫血、窒息发生率差异较小(P>0.05),均未发生死亡,见表4。
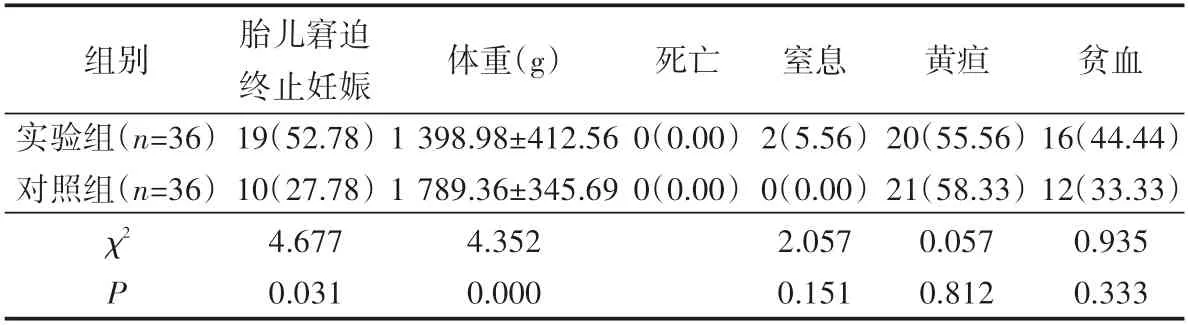
表4 对比两组围产儿不良结局发生详情 例(%)
3 讨论
孕产妇较为严重的并发症之一为重度子痫前期,发病后部分患者合并胎儿生长受限。一些临床研究中发现,先兆子痫的危险因素之一为易栓症[6]。有临床研究显示,先兆子痫患者会有一大部分存有血栓类疾病,并诱发胎儿生长受限等不良妊娠结局,在临床产科中,合并产科并发症的孕产妇中有52%左右存有血栓性基因缺陷[7-8]。抗凝血酶III是一种血液抗凝因子和血栓抑制剂,属于α2糖蛋白,能够有效抑制凝血因子的活性,以减少和预防血栓的产生。相关研究中,静脉血栓患者中缺乏抗凝血酶III占比2%~6%[9]。这就进一步说明重度子痫前期的发病可能和抗凝血酶III密切相关。蛋白C、蛋白S则经肝脏合成,属于生素K依赖性蛋白的一种,蛋白C抗凝系统是由以上两种蛋白共同构成。缺乏蛋白C、蛋白S现象,则属于常染色体显性遗传,血栓产生风险较高,和未缺乏患者相比,其死亡率和死胎率相对较高。研究发现,妊娠者缺少蛋白C或者蛋白S,会显著提高胎盘血栓风险,且不良妊娠结局发生率高于未缺少以上两种蛋白患者。有学者研究证实,子痫前期和缺乏蛋白C、蛋白S密切相关,并发现胎儿生长受限、胎盘早剥、重度子痫前期血栓性疾病发生风险较大,而先兆子痫患者更易产生缺乏蛋白C和蛋白S、凝血酶原基因突变[10]。这就表示重度子痫前期和缺乏蛋白C、蛋白S有一定关联性。而在本次研究中发现,实验组的蛋白S、抗凝血酶III水平差异于对照组,但是两组的蛋白C水平无明显差异。说明蛋白S、抗凝血酶III可能是引起重度子痫前期合并胎儿生长受限的因素之一,但是本次研究所选样本数量小且为同一地区,缺乏代表性,导致研究数据有一定偏差,比如一些研究中发现蛋白C参与重度子痫前期合并胎儿生长受限,但是本研究结果与其相反,因此还需进一步扩大临床研究证实。
多种因素均会引起D-二聚体水平异常提高,如炎症、创伤、妊娠、血栓等。大量学者研究一致认为子痫前期和D-二聚体密切相关,分娩时间和新生儿体重与其呈负相关[11]。而本研究中显示,两组患者的D-二聚体水平差异显著。这就说明可将D-二聚体水平纳入重度子痫前期合并胎儿生长受限的预测因子之中。有学者研究发现,重度子痫前期患者的胎儿脐血流S/D值和D-二聚体水平明显异常,而新生儿窒息、胎儿生长受限、围产儿死亡发生率较高。当患者产生D-二聚体异常情况后,会有多发性血栓发生于子宫动脉等血管中,抑制血液纤溶活性,减弱血管内皮受损细胞清除功能,提高血小板活性,促进血栓的产生,从而产生恶性循环。当出现胎儿宫内窘迫后,彩超的脐血流S/D值出现异常,可通过脐动脉血流速度谱判断胎儿宫内缺氧情况,可对分娩风险进行预测。还有学者认为,先兆子痫和胎儿生长受限可通过监测脐动脉血流进行判断胎儿宫内情况,够明显减少围产儿死亡率,是产前监护胎儿宫内情况的有效手段。此外一些研究显示,在子痫前期患者中,出现了脐动脉舒张末期血流异常时,表示胎儿预后较差[12]。本次研究显示,实验组的脐血流S/D值显著高于对照组,胎儿窘迫和对照组相比,实验组显著提高。两组体重相比,实验组明显低于对照组。当患者血液处于高凝状态时,会降低胎盘绒毛间血液灌注,进而引起胎盘血流异常,脐血流S/D值越高,胎儿窘迫、低体重发生情况越多。
重度子痫前期合并胎儿生长受限病情较为严重,多数患者药物治疗效果欠佳,需适时终止妊娠,以减少对母体造成的损伤,但会增加围产儿死亡率,需根据患者实际情况选择期待治疗。本研究中发现,两组胎儿窘迫终止妊娠率对比差异显著。在分娩孕周、住院天数、窒息发生率上,两组对比差异较小,均未发生死亡。说明期待治疗不会增加围产儿死亡率和窒息率,但是终止妊娠率高,主要是合并胎儿生长受限病情严重,对胎儿影响大,出现胎儿窘迫,如不终止妊娠会加重母婴损伤。此外胎儿娩出后易产生其他并发症,进而增加住院时间。两组的分娩孕周对比差异较小。这就说明,使用期待治疗可在一定程度上延长孕周,终止妊娠有助于减少患者并发症和新生儿死亡率,而本研究中两组的并发症发生率无明显差异,与上述观点相符。
综上所述,在重度子痫前期合并胎儿生长受限的患者中,其血液处于高凝状态,可通过D-二聚体、蛋白S、蛋白C、抗凝血酶III、脐血流S/D值对患者病情进行预测,预防母婴不良结局。

