酒精性肝病合并肌肉减少症的研究进展
王 倩, 常春艳, 杨 松,3,4
1 解放军联勤保障部队第九六〇医院 药学部, 济南 250031; 2 首都医科大学附属北京地坛医院 肝病中心, 北京 100015; 3 北京大学医学部北京地坛医院教学医院 肝病中心, 北京 100015; 4 青海省第四人民医院 肝病二科, 西宁 810000
酒精性肝病(ALD)是由于长期大量饮酒导致的肝脏疾病,是危害我国人民健康的主要肝脏疾病[1]。近年来ALD患者合并肌肉减少症(以下简称肌少症)的问题引起广泛关注。约有60%的ALD患者合并肌少症。合并肌少症会导致ALD患者预后进一步恶化,而改善肌少症可能对ALD患者预后具有改善作用。本研究拟就ALD患者合并肌少症的流行病学、发病机制、对ALD预后影响及治疗等进展综述如下。
1 肌少症概述
肌少症是一种进行性、广泛性地以骨骼肌量减少、肌力下降和体能减退为特征的综合征,肌少症可导致机体失能、生活质量下降和死亡等不良后果[2-3]。肌少症可分为原发性与继发性两种。原发性肌少症主要与年龄有关;继发性肌少症主要由不良的饮食摄入、营养不良和慢性疾病如慢性肝病等导致。随着肌少症认识的不断深入,目前对于肌少症的诊断包含3个因素,分别是肌力下降、肌量下降与体能下降。其中肌力下降是肌少症诊断的关键,肌量下降是诊断的重要依据,体能下降则是严重肌少症的标志[2-3]。2019年亚洲肌少症工作组(Asian Working Group for Sarcopenia,AWGS)更新了肌少症诊疗共识[3],针对亚洲人群的体型、体成分组成、生活方式和体力活动方面的特点制定了亚洲肌少症诊断标准(表1),可供我国肌少症临床诊疗及研究参考。
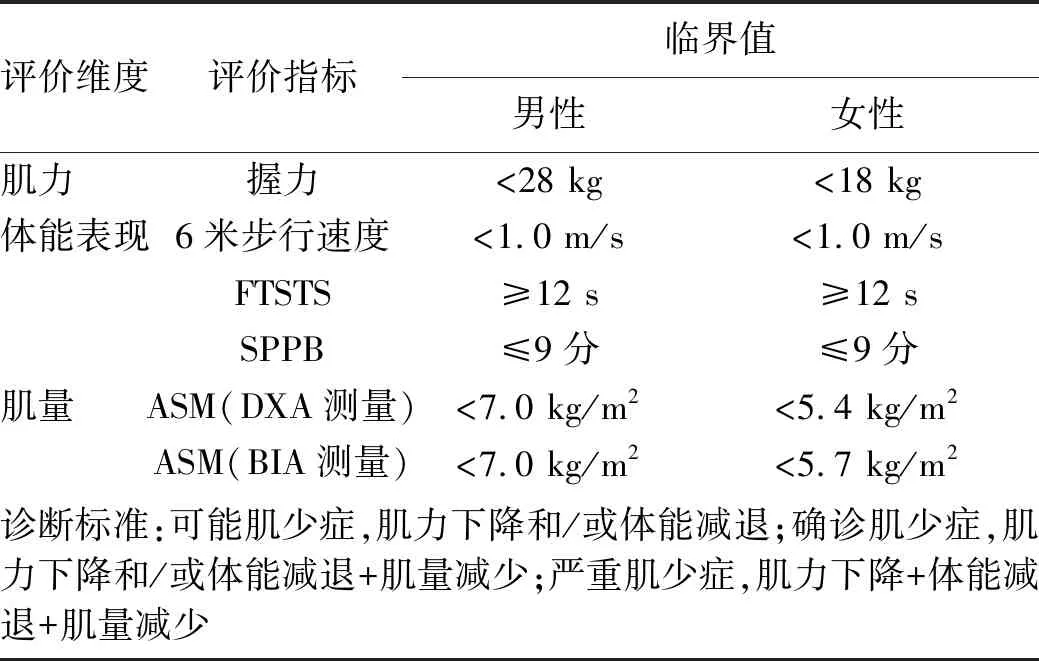
表1 2019年AWGS肌少症的诊断标准及临界值
除上述采用BIA与DXA方法进行肌少症评价外,近年来采用CT与MRI等检查来评价肝病相关肌少症的研究日益增多[4-5]。这是由于CT和MRI可对肌量、肌肉密度及肌肉内脂肪组织进行精确客观定量。欧洲肝脏病学会建议通过腹部CT/MRI评估肝硬化患者肌少症[6]。CT或MRI影像躯体横断面骨骼肌总面积与全身骨骼肌含量呈线性正相关,该相关性不受年龄、性别、身高、体质量、种族等影响,尤其是第三腰椎层面的骨骼肌总面积与全身骨骼肌含量的相关性最高[7-10]。
L3骨骼肌指数(skeletal muscle index at the third lumbar vertebra,L3SMI)是目前肝病相关肌少症最常用的骨骼肌质量评估方法之一。特别是CT测量的骨骼肌质量不仅能反映躯体肌肉总量,还与患者握力、步速等显著相关,可在反映机体肌肉量的同时反映肌力和体能表现,可反映患者整体肌少症的情况[7]。目前L3SMI评价肌少症的临界值尚不统一。Prado等[11]在加拿大开展的一项针对呼吸系统及胃肠道肿瘤患者的流行病学调查,确立男性L3SMI<52.4 cm2/m2、女性<38.5 cm2/m2作为诊断肌少症的标准,这一标准被后续多项研究采用。Carey等[12]2017年发表的一项涉及北美5所移植中心的多中心研究,以L3SMI 评估等待肝移植的终末期肝病患者的肌少症情况,将临界值定为男性<50 cm2/ m2和女性<39 cm2/ m2。Romagna等[13]对83例肝硬化患者分别采用上述Carey等[12]和Prado等[11]研究中的临界值进行肌少症诊断,结果表明两种标准诊断肌少症得出的患病率并无显著性差异。目前对于不同人种之间肌少症的诊断临界值是否通用还存在争议。Carey等[12]研究结果显示,在5所肝移植中心396例待肝移植的肝硬化患者中,西班牙裔或非西班牙裔白人、亚裔、黑人、其他人种的L3SMI中位值差异并无统计学意义,提示种族对L3SMI的影响有限。但Imai等[14]一项关于日本肝癌患者的肌少症研究报道中确立的肌少症临界值为男性L3SMI≤36.0 cm2/m2、女性≤29.0 cm2/m2。国内研究者基于上海正常人群的人体测量学及人体成分指标的相关性,确立肌少症临界值为男性L3SMI<53.23 cm2/m2、女性<39.17 cm2/m2[15]。除了L3SMI,腰大肌厚度/身高比(psoas muscle thickness/height,PMTH)对检测肝硬化患者肌少症和预测预后也有大量研究。Gu等[16]对653例肝硬化患者开展的有关PMTH与L3SMI的相关性以及最佳PMTH临界值的研究显示,男性和女性PMTH与L3SMI的相关性均较好(P<0.001);评估肌少症的最佳PMTH临界值男性为17.3 mm/m,女性为10.4 mm/m。总体而言,目前肝病相关肌少症研究中的评估方法及临界值范围差异较大,且许多研究中仅通过测定骨骼肌质量诊断肌少症,对肌力与体能的评估不足,研究结果数据差异比较大[5,14,17]。我国肝病相关肌少症研究亟需大样本、多中心的研究来确立统一的诊断规范与诊断标准。
2 ALD患者合并肌少症的流行病学
ALD的各个阶段均可发生肌少症,其严重程度取决于肝病的严重程度以及过量饮酒的严重程度。综合现有ALD营养评估的数据,有60%~70%的ALD患者合并不同程度的肌少症[18-19]。从不同肝病类型合并肌少症的情况来看,ALD患者与代谢相关脂肪性肝病、病毒性肝炎等其他肝病相比,ALD患者肌少症的流行率及严重程度通常高于代谢相关脂肪性肝病等其他肝脏疾病患者,这可能与乙醇及其代谢产物会额外造成骨骼肌代谢异常有关[19-20]。Welch等[21]最近发表的关于肝硬化病因(包括ALD、病毒性肝炎和代谢相关脂肪性肝病等)对肌少症影响的研究显示,ALD是导致肌少症的独立危险因素(P=0.011),ALD患者初始肌肉面积最小,肌肉面积减少速度最快,肌肉损失率最高。Gu等[16]对653例肝硬化患者(包含ALD 326例、病毒性肝炎269例、其他58例)肌少症的研究也提示,与其他肝病患者相比,ALD患者更容易发生肌少症(OR=1.592,95%CI:1.080~2.346,P=0.019)。从ALD本身的疾病谱而言,现有证据提示酒精性肝炎患者发生肌少症概率高于酒精性肝硬化患者,这可能与重症酒精性肝炎患者存在急性炎症反应导致骨骼肌量减少有关[19-20]。
3 ALD合并肌少症的发病机制
肝脏疾病本身作为继发性肌少症的常见原因,其肌少症发生与食欲下降、能量摄入不足、营养消化和/或吸收不良、体力活动减少等有关[19]。此外肝脏疾病尤其是肝硬化与终末期肝病患者往往存在糖原代谢异常,在此过程中需要分解更多骨骼肌蛋白提供氨基酸进行糖异生导致骨骼肌减少增加;肝脏疾病相关的血氨升高可通过作用于肌生长抑制素以及雷帕霉素复合物1(mechanistic target of rapamycin complex 1,mTORC1)通路减少骨骼肌蛋白合成,增加肌肉细胞自噬导致肌肉量减少。此外肝硬化本身存在的激素紊乱(胰岛素样生长因子1、维生素D及睾酮水平降低)、炎性细胞因子激活(TNFα、IL-6表达上调)和其他代谢紊乱也会导致骨骼肌蛋白合成受损以及肌细胞自噬增加[22]。
除了一般肝病相关肌少症发病机制外,酒精及其代谢产物还可以通过多种机制导致肌少症的发生。Davuluri等[23]研究显示,乙醇通过抑制磷酸肌醇3激酶γ,破坏了内源性蛋白磷酸酶2A(protein phosphatase 2A,PP2A)抑制剂与PP2A的结合,使骨骼肌中的PP2A被靶向激活,导致mTORC1和磷酸腺苷激活蛋白激酶去磷酸化从而造成骨骼肌蛋白质合成减少、自噬增加。对于高血氨引起的骨骼肌细胞损伤,酒精可通过上调骨骼肌细胞上氨转运蛋白RhBG表达,进一步增加骨骼肌细胞内的氨浓度,加重高血氨导致的骨骼肌细胞损伤[24]。过量饮酒还可以下调血浆及肌肉胰岛素样生长因子1水平,减少肌肉蛋白合成[20]。酒精本身即可导致炎症因子TNFα与IL-6表达,后两者可作用于泛素蛋白酶途径加速骨骼肌蛋白降解[20]。酒精可直接影响骨骼肌细胞线粒体功能,降低骨骼肌细胞ATP水平,导致氧自由基沉积,降低线粒体蛋白合成水平并促进骨骼肌细胞自噬[25]。酒精本身还可以通过上调去乙酰化酶抑制骨骼干细胞活性,影响骨骼肌再生[26]。因此,酒精的直接作用和继发肝损伤的交互影响或叠加作用,可能共同导致或加重了肌少症的发生。
4 ALD合并肌少症对疾病预后的影响
肝病患者相关肌少症发生不良临床事件及死亡风险增加,与无肌少症的患者相比,合并肌少症的肝硬化患者生存率显著降低[27-29],发生感染[28-29]、顽固性腹/胸水[28]、肝性脑病[30-32]、衰弱[33]等并发症的发生率明显升高。肌少症不仅是肝硬化患者显性和轻微型肝性脑病的独立危险因素,同时可增加经颈静脉肝内门体分流术后发生肝性脑病的风险[34]。此外,肌少症还是男性肝硬化患者发生原发性肝癌的独立风险因素[35]。肝移植患者围手术期肌少症不仅可显著增加肝移植等待时间和移植后患者的病死率[12,36],还会延长患者移植术后住院时间和机械通气时间,增加肝移植术后并发症特别是败血症或严重感染的发生率[17]。对接受根治性切除或射频消融术的原发性肝癌患者,伴有肌少症的患者复发率更高[37],肌少症还会增加原发性肝癌患者术后1年的病死率[38]。虽然相关研究[16-17,39]中入组患者均包含相当比例的ALD患者(16%~50%),但上述研究并非只针对ALD患者。最近Al-Azzawi等[40]发表的有关肌少症与酒精性肝炎严重程度以及与病死率、30 d再入院率、并发症、感染和住院时间等之间的相关性研究结果与上述结论基本一致。该研究纳入194例成年酒精性肝炎患者,结果显示肌少症组的MELD评分更高(21.5分 vs 24.2分,P=0.03),BMI更低(24.5 kg/m2vs 29.6 kg/m2,P<0.001),住院时间显著延长(17.2 d vs 12.4 d,P=0.003);此外肌少症组患者发生肺炎(OR=2.34,95%CI:1.19~4.62,P=0.01)、败血症(OR=2.39,95%CI:1.23~4.64,P=0.01)和肝性脑病(OR=2.48,95%CI:1.30~4.71,P=0.006)的风险更高。
5 ALD合并肌少症的干预措施
对于ALD合并肌少症患者,戒酒一方面可改善ALD,还对肌少症有一定缓解作用。但单纯戒酒对于患者肌少症缓解作用有限,在戒酒基础上还要针对肌少症进行系列的干预措施。目前ALD合并肌少症的干预措施主要包括营养支持与运动干预,激素替代治疗及药物干预也有大量研究探索。
首先,肌少症患者应保证足够的热量及蛋白质摄入,营养治疗可改善酒精性肝硬化与酒精性肝炎患者临床转归[41]。鼓励胃肠内营养支持,肠内营养不能满足机体需求的患者可考虑肠外营养[42]。建议日间少食多餐,睡前加餐,以缩短空腹状态的持续时间;睡前高蛋白零食和富含蛋白质的早餐结合有助于逆转患者的合成代谢抵抗和骨骼肌量减少,改善肌少症[43]。补充富含亮氨酸的支链氨基酸(branched-chain amino acid, BCAA)有利于骨骼肌质量和功能的恢复。BCAA可通过骨骼肌合成谷氨酰胺,降低血氨水平;还可抑制氨基酸缺乏传感器改善肌肉质量的减少[44]; BCAA中的亮氨酸可以激活mTORC1信号途径、抑制自噬[45-46]。补充BCAA可提高肝硬化肌少症患者的生存率[27]、预防肝性脑病的发生及延缓肌少症的进展[47]。
抗阻运动和有氧运动也可改善患者骨骼肌的质量和功能。但对肝硬化患者,运动过程中较低的运动耐受和增加的肌肉产氨作用可能减少了获益[48]。Naseer等[49]通过荟萃分析明确不同干预措施对肝硬化合并肌少症的疗效,初步证据表明有氧运动后肌肉质量、力量和身体功能都有所改善。补充BCAA联合步行锻炼或口服亮氨酸联合中等强度运动可提高肝硬化患者运动能力、肌肉质量和生活质量评分[50-51]。虽然目前对 ALD患者的运动方式还没有具体的建议,但鼓励适当活动或锻炼以刺激肌肉组织合成代谢,改善肌肉质量和功能。未来尚需要高质量的随机对照试验进一步验证运动疗法在ALD特别是酒精性肝硬化患者中的安全性及有效性,以及明确运动与补充氨基酸的时机[52]。
此外,Sinclair等[53]报道对于性腺功能低下的男性进行睾酮替代治疗证明能有效改善肝硬化患者的肌少症,但上述干预措施对患者肝脏功能及整体生存的潜在影响还需要更大规模的研究。Kumar等[54]研究显示长期降氨治疗有助于改善肝硬化患者肌少症病情。近年来针对肌少症的靶向治疗药物如肌生长抑制素拮抗剂等已先后进入临床研究阶段,但这些药物对于合并肝病的肌少症患者的疗效与安全性还需进一步验证[55]。
6 小结和展望
ALD合并肌少症与患者的预后密切相关,应引起临床足够重视。ALD患者合并肌少症的相关研究亟需统一各种检测方法的临界值。对于我国ALD合并肌少症的流行病学、诊断标准、临床表型及与患者预后的关系均有待进一步明确。戒酒对于改善ALD患者肌少症病情具有一定缓解作用,但还需结合营养支持、运动调理个体化施行。后续需要探索激素替代治疗、降氨治疗及针对肌少症的靶向治疗对于ALD合并肌少症患者的疗效与安全性,以更好地纠正肌少症,改善患者临床结局与生活质量。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:王倩负责文献检索分析,撰写论文;常春艳参与文献检索及修改论文;杨松负责拟定写作思路,指导撰写文章并最后定稿。

