痰热清胶囊化学成分、药理作用及临床应用研究进展
何玉琼 赵洋 马颖 张木升 张小利 王亮 陈万生
中图分类号 R283 文献标志码 A 文章编号 1001-0408(2021)13-1639-09
DOI 10.6039/j.issn.1001-0408.2021.13.18
摘 要 目的:总结痰热清胶囊的化学成分、药理作用及临床应用的研究进展,为该药的进一步研究和开发提供参考。方法:对痰热清胶囊的化学成分、药理作用及临床应用的相关研究进行归纳总结。结果与结论:痰热清胶囊处方是依据中医温病理论建立的,方中以黄芩为君药,其味苦性寒,具有清热燥湿、泻火解毒的功效;熊胆粉和山羊角均为臣药,熊胆粉性寒,山羊角味苦咸性寒,具有平肝息风、清热解毒等作用;金银花为佐药,味甘性寒,以助清热解毒、宣肺化痰;连翘味苦性微寒,具有清热宣透作用,又可引诸药入肺经,故为使药。痰热清胶囊的化学成分主要包括黄酮类、有机酸类、氨基酸类、苯乙醇苷类、木脂素类等57种化合物,具有抗炎、抗氧化、抗菌、抗病毒等药理作用,临床主要用于急性气管-支气管炎以及上呼吸道感染性疾病。目前,痰热清胶囊的药理作用和临床应用的研究明显不足,药理作用研究只是集中在解热、抗菌、袪痰等方面,临床研究也只是集中在急性气管-支气管炎(风热犯肺型咳嗽)和上呼吸道感染性疾病方面;对其质量控制的方法也仅有薄层鉴别和含量测定,且其指标成分较少,还有待深入研究。
关键词 痰热清胶囊;药理作用;化学成分;临床应用
痰热清胶囊是由黄芩、熊胆粉、山羊角、金银花、连翘等5味中药材提取而成的中药制剂[1],其具有清热解毒、化痰解痉等功效,主要用于风热袭肺证,症见发热、恶风、咳嗽等[2]。痰热清胶囊于2013年作为痰热清注射液的改良型口服新药上市,并在2019年入选了国家医保谈判品种。在临床应用方面,痰热清胶囊被呼吸系统疾病诊疗指南和专家共识,以及中西医联合治疗社区获得性肺炎、急性上呼吸道感染中成药应用的专家共识等推荐使用[3]。为深入了解痰热清胶囊的基础研究及临床应用的相关进展,笔者对其化学成分、药理活性以及临床应用的研究进行综述,为该制剂的进一步研究和开发提供参考。
1 化学成分
研究表明,痰热清胶囊中5味中药的主要药效物质分别为黄芩苷、汉黄芩苷等黄酮类成分,熊去氧胆酸、鹅去氧胆酸、牛磺熊去氧胆酸、牛磺鹅去氧胆酸等胆汁酸类成分,有机酸类成分,氨基酸类成分,苯乙醇苷及其苷类成分和木脂素类成分[4]。
1.1 黄酮类成分
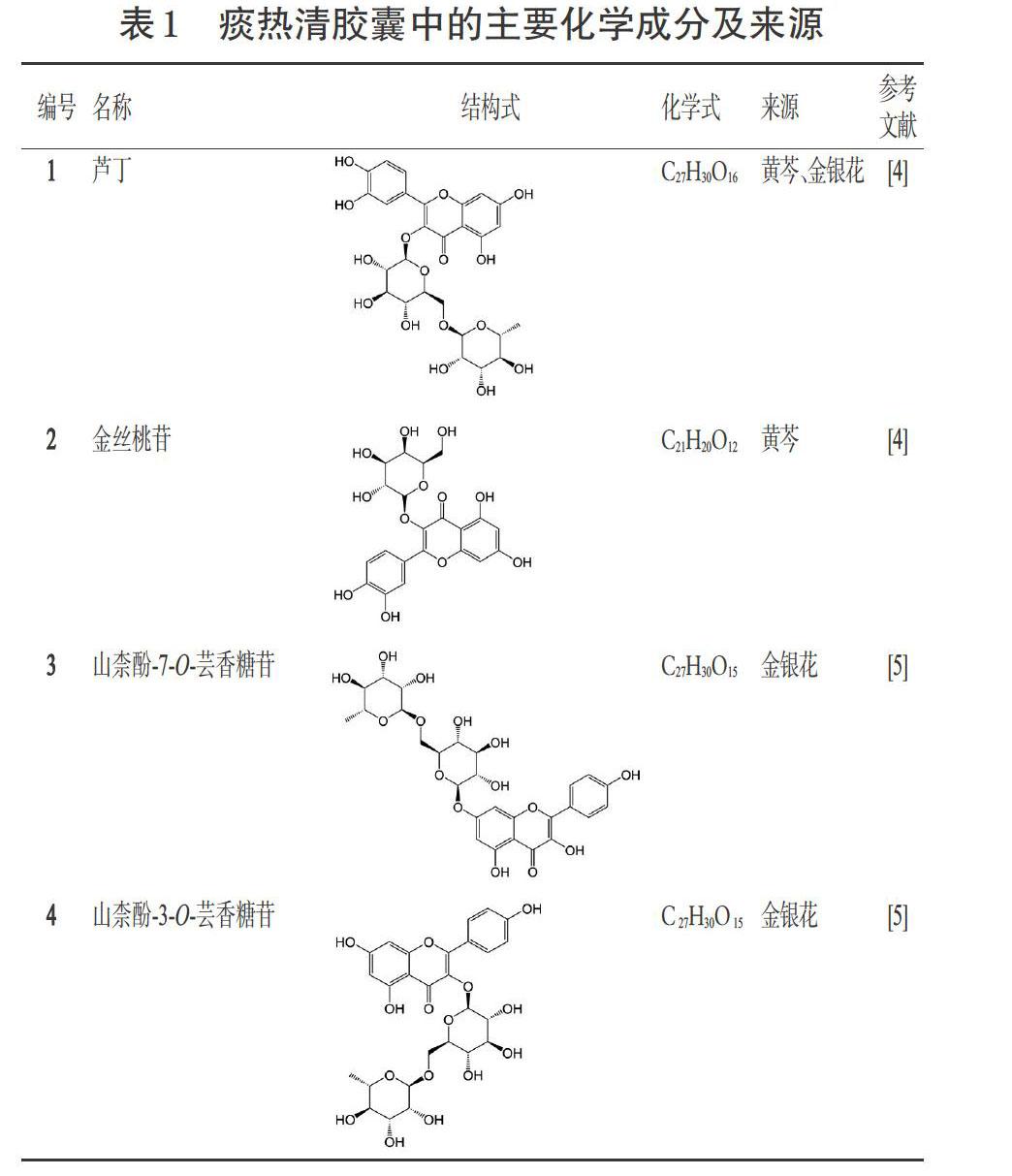
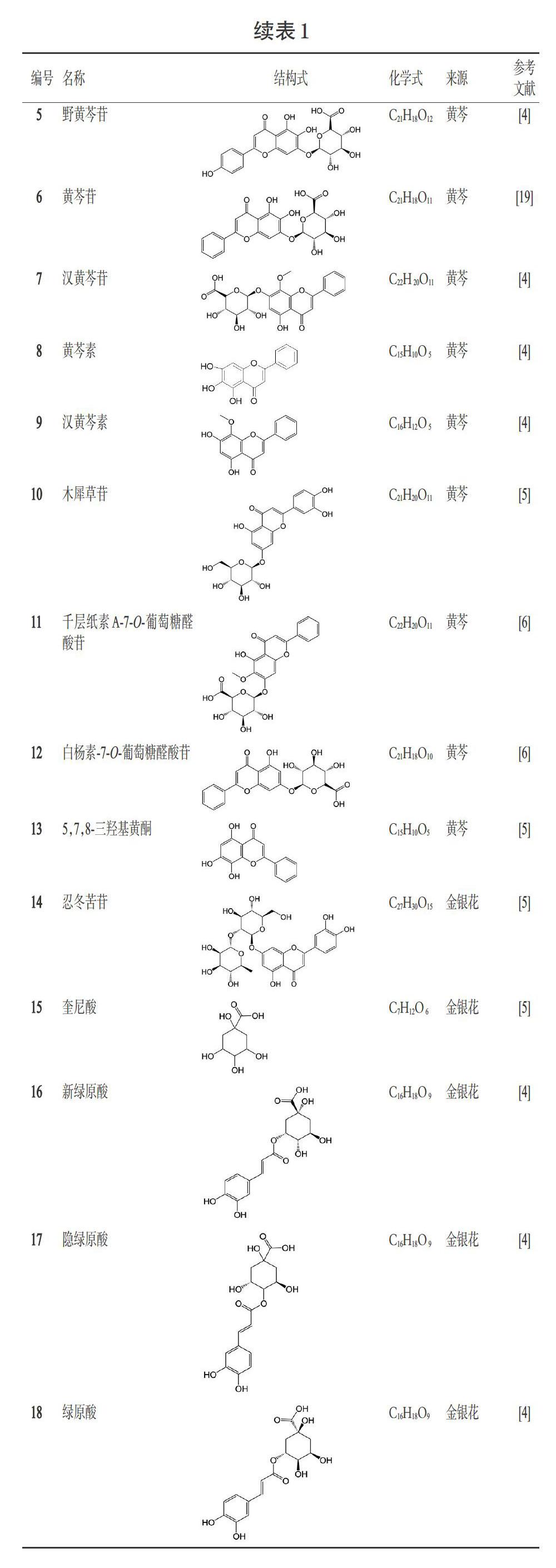
痰热清胶囊中的黄酮类化合物大多来源于黄芩和金银花,结构类型包括黄酮醇类和黄酮类。黄酮醇类成分有芦丁(化合物1)、金丝桃苷(化合物2)、山柰酚-7-O- 芸香糖(化合物3)、山柰酚-3-O-芸香糖苷(化合物4)[4-5];黄酮类成分有野黄芩苷(化合物5)、黄芩苷(化合物6)、汉黄芩苷(化合物7)、黄芩素(化合物8)、汉黄芩素(化合物9)、木犀草苷(化合物10)、千层纸素A-7-O-葡萄糖醛酸苷(化合物11)、白杨素-7-O-葡萄糖醛酸苷(化合物12)、5,7,8-三羟基黄酮(化合物13)、忍冬苦苷(化合物14)等[4-6],详见表1。
1.2 有机酸类成分
痰热清胶囊中的有机酸类成分主要有奎尼酸(化合物15)、新绿原酸(化合物16)、隐绿原酸(化合物17)、绿原酸(化合物18)、咖啡酸(化合物19)、异绿原酸C(化合物20)、异绿原酸A(化合物21)、异绿原酸B(化合物22)等[4-5],详见表1。
1.3 木脂素类成分
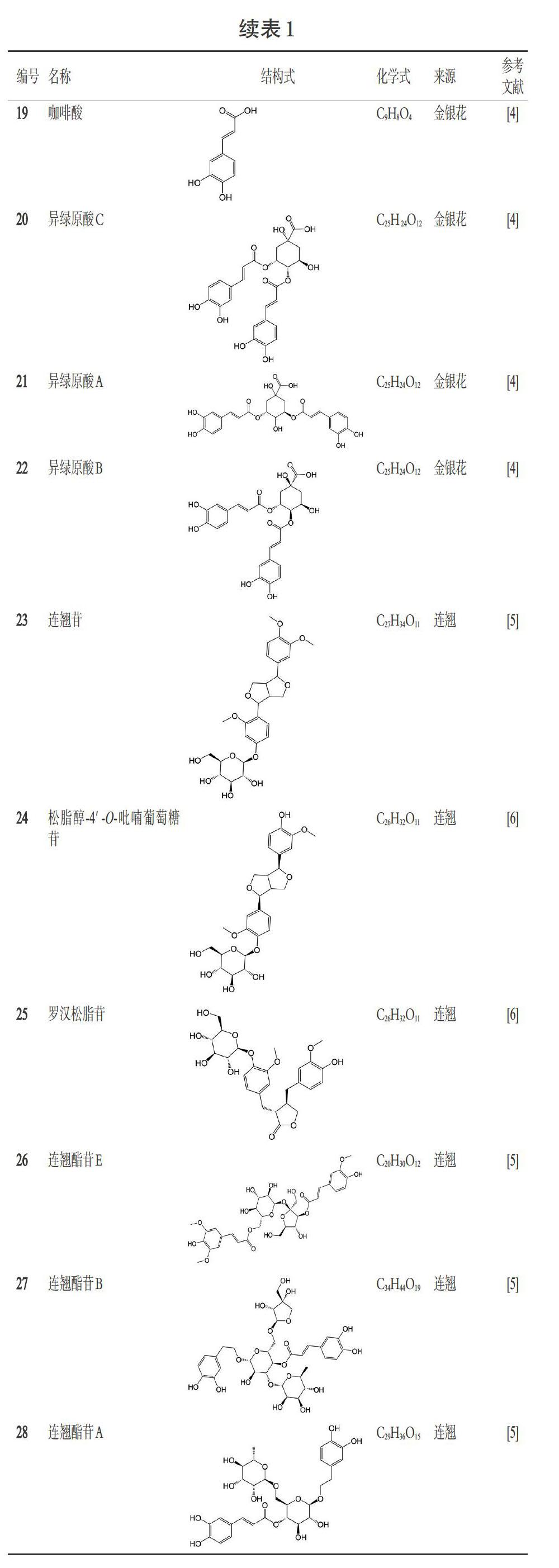
木脂素类是痰热清胶囊中连翘的特有成分,主要有连翘苷(化合物23)、松脂醇-4′-O-吡喃葡萄糖苷(化合物24)、罗汉松脂苷(化合物25)等[5-6],详见表1。
1.4 苯乙醇苷类成分
痰热清胶囊中的苯乙醇苷类化合物主要来自于连翘,主要有连翘酯苷E(化合物26)、连翘酯苷B(化合物27)、連翘酯苷A(化合物28)、异连翘酯苷A(化合物29)、连翘种苷(化合物30)、R-2′-羟基连翘(化合物31)、S-2′-羟基连翘苷(化合物32)、芦蓬苷(化合物33)、异紫葳新苷Ⅱ(化合物34)等[5-6],详见表1。
1.5 胆汁酸类成分
痰热清胶囊中的胆汁酸类化合物主要源自于熊胆粉,主要有牛磺鹅去氧胆酸(化合物35)、牛磺熊去氧胆酸(化合物36)、胆酸(化合物37)、熊去氧胆酸(化合物38)、鹅去氧胆酸(化合物39)、蜥蜴胆酸(化合物40)、3-脱氢胆酸(化合物41)、3-氧代-4,6-胆二烯酸(化合物42)等[5-6],详见表1。
1.6 氨基酸类成分
痰热清胶囊中的氨基酸成分主要来自于山羊角,主要有丝氨酸(化合物43)、焦谷氨酸(化合物44)、氨基己酸(化合物45)、亮氨酸(化合物46)、异亮氨酸(化合物47)、苯丙氨酸(化合物48);还有来自于金银花的色氨酸(化合物49)[5],详见表1。
1.7 环烯醚萜类化合物
痰热清胶囊中的环烯醚萜类成分主要有四乙酰开联番木鳖苷环(化合物50)、獐芽菜苦苷(化合物51)、獐牙菜苷(化合物52)、断氧化马钱苷(化合物53)、马钱子碱 A(化合物54)、(2S,2′S,3R,3′R,4R,4′S)-4,4′-[(1E)-1-甲酰基-1-丙烯基-1,3-二基]双[3-乙烯基-2-(β-D-吡喃葡萄糖基氧基)-3,4-二氢-2H-吡喃-5-羧酸]二甲酯(化合物55)、五福花苷酸(化合物56)、马钱子苷(化合物57)等[5],其中五福花苷酸源自于连翘,其余均来源于金银花,详见表1。
2 药理作用
痰热清胶囊中的黄芩为君药,具有清肺热、燥湿解毒的功效;熊胆粉和山羊角为臣药,具有清热解毒、祛痰平喘等作用;金银花和连翘为佐使药,以助清热解毒、宣透散邪,因此,痰热清胶囊具有抗炎、抗菌、抗病毒、祛痰的作用[2]。在2020年抗击新型冠状病毒肺炎(COVID-19)疫情的过程中,痰热清胶囊在部分省市的诊疗方案中被列为推荐用药[7-8]。因此,痰热清胶囊的药理作用值得关注。
2.1 抗炎
众多研究表明,痰热清胶囊具有显著的抗炎作用。郭丽云等[9]研究发现,痰热清胶囊联合激素抗生素对放射性肺炎的治疗效果优于激素和抗生素,其对患者血清中细胞因子转化生长因子β(TGF-β)及白细胞介素6(IL-6)具有更强的抑制作用。在角叉菜胶致SD大鼠炎症模型中,张小利等[10]发现痰热清胶囊在168 mg/kg的剂量下能明显改善角叉菜胶致大鼠足肿胀,表明其具有明显的抗炎作用。痰热清胶囊的抗炎作用源于其所含的众多具有抗炎活性的小分子化合物。研究表明,芦丁、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素可作用于多种免疫细胞,通过下调Toll 样受体(TLR),抑制丝裂原活化蛋白激酶(MAPK)、蛋白激酶B(Akt)、核因子κB(NF-κB)等通路从而有效抑制IL-1β、IL-6、IL-8、肿瘤坏死因子α(TNF-α)等炎症因子的释放,发挥抗炎作用[11-12]。千层纸素A-7-O-葡萄糖醛酸苷可激活RAW 264.7细胞及骨髓来源的巨噬细胞中过氧化物酶体增殖物激活受体(PPARγ),抑制NF-κB活性,从而抑制炎症因子IL-1β、IL-6 和TNF-α的释放,可有效预防葡聚糖硫酸钠盐(DSS)诱导的结肠炎[13]。此外,痰热清胶囊中金丝桃苷[14]、山柰酚-3-O-芸香糖苷[15]、木犀草苷[16]、新绿原酸[17]、隐绿原酸[18]、绿原酸[19]、咖啡酸[20]、连翘苷[21]、连翘酯苷 B[22]、连翘酯苷 A[23]、牛磺鹅去氧胆酸[24]、牛磺鹅去氧胆酸[25]、熊去氧胆酸[26]、鹅去氧胆酸[27]、獐芽菜苦苷[28]、马钱子苷[29]等化合物均能通过作用于细胞的MAPK、Akt、NF-κB、核苷酸结合寡聚化结构域受体3(NLRP3)和Janus激酶/信号转导与转录激活子(JAK-STAT)等通路,从而有效抑制炎症因子的释放,发挥抗炎作用,对炎症相关疾病如关节炎、结肠炎、肺炎等有较好的防治作用。综上,痰热清胶囊中多种化合物均可发挥抗炎作用,对炎症性疾病具有治疗作用。
2.2 抗氧化
痰热清胶囊的多种化学成分与痰热清注射液相似,均具有抗氧化的作用,因此痰热清胶囊具有潜在的抗氧化应激的作用。研究发现,痰热清胶囊中黄芩苷及黄芩素可通过阻断NF-E2相关因子2(Nrf2)与Kelch样环氧氯丙烷相关蛋白1(Keap1)的结合,并诱导Nrf2核转位来激活Nrf2,从而增强超氧化物歧化酶(SOD)及谷胱甘肽(GSH)抗氧化酶活性,并抑制丙二醛(MDA)及活性氧(ROS)表达,发挥抗氧化作用,从而减轻对乙酰氨基酚诱导的肝毒性[30]。此外,痰热清胶囊中的芦丁[31]、汉黄芩苷[32]、汉黄芩素[33]、金丝桃苷[34]、山柰酚-3-O-芸香糖苷[35]、新绿原酸[36]、隐绿原酸[19]、绿原酸[37]、咖啡酸[21]、连翘苷[38]、牛磺熊去氧胆酸[39]、熊去氧胆酸[40]等化合物也可通过调节Nrf2及磷脂酰肌醇3-激酶(PI3K)等信号通路,抑制ROS和MDA的活性,促进SOD、GSH、过氧化氢酶(CAT)的表达,从而发挥抗氧化作用,在肝损伤、动脉粥样硬化、糖尿病、非酒精性脂肪肝等动物模型中具有保护作用。因此,痰热清胶囊也具有一定的抗氧化、抑制氧化应激的作用,对氧化应激相关疾病具有潜在的治疗作用。
2.3 抗菌
张黎莉等[2]采用体内外抗菌实验观察痰热清胶囊的抗菌作用,结果显示,该药物对上呼吸道感染的9种细菌均有抗菌活性,并对金黄色葡萄球菌及乙型溶血性链球菌感染后的动物有明显的保护作用,可降低动物的死亡率,延缓动物的死亡时间。此外,张小利等[10]研究发现,痰热清胶囊对肺炎链球菌感染模型小鼠具有一定的保护作用,能降低其肺炎链球菌所致肺指数的升高。还有研究发现,痰热清胶囊中的芦丁和黄芩苷在小鼠体外及体内对大肠埃希菌和金黄色葡萄菌均有显著的抑制作用[41-42]。芦丁在体外可通过抑制金黄色葡萄球菌中分选酶A(SrtA)的活性从而降低纤维蛋白原和纤连蛋白的黏附率,发挥抗金黄色葡萄球菌的作用[43]。黄芩苷也能抑制小鼠体内金黄色葡萄球菌的生长和毒性,并减弱细菌生物膜的形成,显著提高金黄色葡萄球菌感染后小鼠的生存率,减轻小鼠组织损伤[41]。绿原酸对多种细菌均有抑制作用,对肺炎链球菌和痢疾志贺氏菌的最小抑制浓度为20 μg/mL,能增加细菌外膜和质膜的通透性,导致其屏障功能的丧失和核苷酸的轻微泄漏,从而引起细菌的死亡[44]。此外,黄芩素[45]、咖啡酸[46]、连翘苷[47]、熊去氧胆酸[48]等也具有抗菌作用。因此,痰热清胶囊具有显著的抗菌作用。
2.4 抗病毒
韦祖猛等[49]采用分子对接技术,发现熊去氧胆酸、芦丁、鹅去氧胆酸、汉黄芩苷、木樨草苷、黄芩苷与冠状病毒3CL水解酶的结合能力较强,可抑制病毒的复制,发挥抗病毒作用。有研究发现,黄芩苷、黄芩素及汉黄芩素均能抑制吸道合胞病毒,其半数抑制浓度(IC50)分别为20.8、20.8、7.4 μg/mL,可有效阻断病毒感染,并减少病毒感染小鼠的炎性细胞浸润和肺部损伤[50-51]。痰热清胶囊中的芦丁也是有效的抗病毒成分,有研究显示,芦丁能抑制新型冠状病毒(SARS-CoV-2)的包膜蛋白表达[52],抑制登革热病毒中的丝氨酸蛋白酶生成[53],且对乙型肝炎病毒及丙型肝炎病毒均有抑制作用[54-55]。此外,木犀草苷[56]、绿原酸[57]、咖啡酸[58]、连翘苷[59]、牛磺熊去氧胆酸[60]等对流感病毒、肝炎病毒等也有抑制作用。因此,痰热清胶囊具有一定的抗病毒作用,能在COVID-19等病毒感染性疾病的防治中发挥作用。
3 临床应用
目前,痰热清胶囊的临床应用主要集中在急性气管-支气管炎以及上呼吸道感染性疾病。有学者研究了痰热清胶囊治疗急性气管-支气管炎(风热犯肺型咳嗽)的临床效果,结果发现,该药疗效确切,临床试验过程中未见药物所致的毒副作用和不良反应[61-63]。同时,痰热清胶囊也广泛联合其他药物用于治疗其他肺部疾病。放射性肺炎是胸部恶性肿瘤患者进行放射治疗时发生的最严重的并发症[64-65]。郭丽云等[9]研究了痰热清胶囊联合抗生素治疗放射性肺炎的有效性及安全性,结果发现,联用方案治疗放射性肺炎安全有效,值得临床推广。老年获得性肺炎是老年人群呼吸系统最常见的疾病之一,由于老年人全身各器官功能减退,免疫防御力降低,加之其自身合并症多,一旦发病则病情进展迅速,极易发展为重症肺炎[66-68]。张晓艳[66]研究痰热清胶囊联合抗生素对老年获得性肺炎患者血清中超敏C反应蛋白(hs-CRP)、降钙素原的影响,结果发现,联用方案可显著降低患者血清中hs-CRP、降钙素原水平,对控制感染具有積极意义。
在2020年COVID-19疫情期間,上海公共卫生临床中心使用痰热清胶囊治疗COVID-19患者,与常规治疗相比后发现,同时联用痰热清胶囊能显著缩短患者的粪便核酸转阴时间(从9天降至4天),该作用可能与提高CD3 T细胞水平有关[69]。有学者就痰热清胶囊治疗COVID-19的网络调控机制进行探索,得出痰热清胶囊中的主要化学成分野黄芩苷、黄芩苷、连翘苷、连翘酯苷E、连翘酯苷D、绿原酸、咖啡酸、熊去氧胆酸、鹅去氧胆酸等可能通过作用于TNF、表皮生长因子(EGFR)、诱导型一氧化氮合酶(iNOS)、过氧化氢合成酶(PTGS2)、IL-2等关键蛋白干预多个与清热、化痰、解毒相关的生物过程,从而发挥对COVID-19的治疗作用的这一结论[70]。
4 结语
痰热清胶囊处方是依据中医温病理论建立的,方中以黄芩为君药,其味苦性寒,具有清热燥湿、泻火解毒的功效;熊胆粉和山羊角均为臣药,熊胆粉性寒,山羊角味苦咸性寒,具有平肝息风、清热解毒等作用;金银花为佐药,味甘性寒,以助清热解毒、宣肺化痰;连翘味苦性微寒,具有清热宣透作用,又可引诸药入肺经,故为使药[10]。5味药相互配伍,加强了本方的清热解毒、化痰镇惊等功效。
痰热清方目前主要是以注射液的剂型应用于临床上,主要用于治疗发热、咳嗽、急性支气管炎、急性肺炎等症,但在临床上引起了较多相关的过敏反应、过敏性休克、头昏恶心、腹泻、高热、心肾功能异常、呼吸困难、喉头水肿、药疹等不良反应[71]。目前,临床上常用痰热清胶囊替代其注射液,可有效减少不良反应的发生。但痰热清胶囊的药理作用和临床应用的研究明显不足,药理作用研究只是集中在解热、抗菌、袪痰等方面,临床研究也只是集中在急性气管-支气管炎(风热犯肺型咳嗽)和上呼吸道感染性疾病方面,故其相应研究有待深入开展。
痰热清胶囊虽然可减少注射液的一些不良反应,但其经过胃肠道口服吸收和肝脏代谢,与注射液静脉给药的代谢方式不同,可能会影响组方中化学成分的药效发挥。而目前关于痰热清胶囊化学成分的研究明显不足,查阅所得的文献大多数都是在研究痰热清胶囊与注射液化学成分的差异。经过阅读文献,笔者发现痰热清胶囊的化学成分普遍比注射液的多。痰热清注射液和胶囊的组方药材来源于相同的5种中药材,制备过程中提取工艺也相似,但注射液的生产过程中为了保证制剂的无菌水平,增加了活性炭吸附、高温灭菌、配液和超滤等生产工艺,因此推测痰热清注射液和胶囊的化学成分可能由此而产生了差异。痰热清胶囊制备过程的工艺相对注射液而言较为简单,化学成分损失较少,其所含的成分也更加丰富;但目前痰热清胶囊标准中质量控制的方法仅有薄层鉴别和含量测定,且其指标成分较少,故其质量控制指标也有待深入研究和完善。
参考文献
[ 1 ] 范小会,范军铭,毕巧莲,等.痰热清胶囊治疗急性气管-支气管炎(风热袭肺证)随机双盲单模拟多中心临床研究:Ⅲ期[J].中药药理与临床,2020,36(3):238-241.
[ 2 ] 张黎莉,李展,徐晓月,等.痰热清胶囊的主要药效学研究[J].中国实验方剂学杂志,2004,10(3):37-40.
[ 3 ] 王玉彩,菅向东,王东兴,等.痰热清胶囊药理作用及临床应用[J].中国社区医师,2020,36(27):102-103.
[ 4 ] ZHAO Y N,XU Z Y,WANG T M,et al. Simultaneous quantitation of 23 bioactive compounds in Tanreqing capsule by high-performance liquid chromatography electrospray ionization tandem mass spectrometry[J]. Biomed Chromatogr,2019,337(7):e4531.
[ 5 ] 赵松峰,张晓,师秀琴,等.基于超高效液相色谱-高分辨质谱技术方法分析痰热清注射液和胶囊化学成分的定性差异[J].中国药学杂志,2018,53(9):739-748.
[ 6 ] 张振华,钟苹苹,徐英.基于HPLC-ESI-MS/MS技术分析痰热清胶囊和痰热清注射液化学成分的差异[J].中国实验方剂学杂志,2017,23(12):44-51.
[ 7 ] 上海市卫生健康委员会.上海市新型冠状病毒肺炎中医诊疗方案:试行第2版[EB/OL]. [2020-02-24].http://wsjkw.sh.gov.cn/zyygz2/20200224/a1f1aab9745e4490867cb- 4aaf40eaad0.html.
[ 8 ] 广东省中医药局.广东省新型冠状病毒肺炎中医药治疗方案:试行第2版[EB/OL]. [2020-02-18].http://szyyj.gd.gov.cn/zwgk/gsgg/content/post_2902010.html.
[ 9 ] 郭丽云,魏世鸿,董玉梅,等.痰热清胶囊联合激素抗生素治疗放射性肺炎的有效性及安全性[J].中华中医药学刊,2019,38(6):218-221.
[10] 张小利,陈迪新,李瑞鹏,等.痰热清胶囊的解热、抗炎及抗菌作用研究[J].海峡药学,2020,32(7):22-24.
[11] LIAO H,YE J,GAO L. The main bioactive compounds of Scutellaria baicalensis Georgi. for alleviation of inflammatory cytokines:a comprehensive review[J]. Biomed Pharmacother,2021,133:110917.
[12] WANG X P,SUN Y,ZHAO Y,et al. Oroxyloside prevents dextran sulfate sodium-induced experimental colitis in mice by inhibiting NF-κB pathway through PPARγ activation [J]. Biochem Pharmacol,2016,106:70-81.
[13] ZARAGOZ? C,VILLAESCUSA L,MONSERRAT J, et al. Potential therapeutic anti-inflammatory and immunomodulatory effects of dihydroflavones,flavones,and flavonols[J]. Molecules,2020,254(4):1017.
[14] JIN X N,YAN E Z,WANG H M,et al. Hyperoside exerts anti-inflammatory and anti-arthritic effects in LPS-stimulated human fibroblast-like synoviocytes in vitro and in mice with collagen-induced arthritis[J]. Acta Pharmacol Sin,2016,375(5):674-686.
[15] HU W H,DAI D K,ZHENG B Z,et al. The binding of kaempferol-3-O-rutinoside to vascular endothelial growth factor potentiates anti-inflammatory efficiencies in lipopolysaccharide-treated mouse macrophage RAW264.7 cells[J]. Phytomedicine,2021,80:153400.
[16] WANG X,YUAN T,YIN N,et al. Luteoloside protects the uterus from staphylococcus aureus-induced inflammation,apoptosis,and injury[J]. Inflammation,2018,41(5):1702-1716.
[17] PARK S Y,JIN M L,YI E H,et al. Neochlorogenic acid inhibits against LPS-activated inflammatory responses through up-regulation of Nrf2/HO-1 and involving AMPK pathway[J]. Environ Toxicol Pharmacol,2018,62:1-10.
[18] ZHAO X L,YU L,ZHANG S D,et al. Cryptochlorogenic acid attenuates LPS-induced inflammatory response and oxidative stress via upregulation of the Nrf2/HO-1 signa- ling pathway in RAW 264.7 macrophages[J]. Int Immunopharmacol,2020,83:106436.
[19] LIU C C,ZHANG Y,DAI B L,et al. Chlorogenic acid prevents inflammatory responses in IL-1β stimulated human SW-1353 chondrocytes,a model for osteoarthritis[J]. Mol Med Rep,2017,16(2):1369-1375.
[20] AJIBOYE T O,AJALA-LAWAL R A,ADEYIGA A B.Caffeic acid abrogates 1,3-dichloro-2-propanol-induced hepatotoxicity by upregulating nuclear erythroid-related factor 2 and downregulating nuclear factor-kappa B[J].Hum Exp Toxicol,2019,38(9):1092-1101.
[21] MA Q,LI R,PAN W,et al. Phillyrin (KD-1) exerts anti-viral and anti-inflammatory activities against novel coronavirus(SARS-CoV-2) and human coronavirus 229E (HCoV-229E) by suppressing the nuclear factor kappa B (NF-κB) signaling pathway[J]. Phytomedicine,2020,78:153296.
[22] JIANG W L,ZHANG S P,ZHU H B,et al. Forsythoside B protects against experimental sepsis by modulating inflammatory factors[J]. Phytother Res,2012,26(7):981- 987.
[23] ZHANG J L,ZHANG Y,HUANG H L,et al. Forsythoside A inhibited S. aureus stimulated inflammatory response in primary bovine mammary epithelial cells[J]. Microb Pathog,2018,116:158-163.
[24] CHENG L,HUANG C,CHEN Z. Tauroursodeoxycholic acid ameliorates lipopolysaccharide-induced depression like behavior in mice via the inhibition of neuroinflammation and oxido-nitrosative stress[J]. Pharmacology,2019,103(1/2):93-100.
[25] QI Y C,DUAN G Z,MAO W,et al.Taurochenodeoxycholic acid mediates cAMP-PKA-CREB signaling pathway[J]. Chin J Nat Med,2020,18(12):898-906.
[26] WARD J B J,LAJCZAK N K,KELLY O B,et al. Ursodeoxycholic acid and lithocholic acid exert anti-inflammatory actions in the colon[J]. Am J Physiol Gastrointest Liver Physiol,2017,312(6):G550-G558.
[27] HORIKAWA T,OSHIMA T,LI M,et al. Chenodeoxycholic acid releases proinflammatory cytokines from small intestinal epithelial cells through the farnesoid X receptor[J]. Digestion,2019,100(4):286-294.
[28] SARAVANAN S,ISLAM V I,THIRUGNANASAMBANTHAM K,et al. Swertiamarin ameliorates inflammation and osteoclastogenesis intermediates in IL-1β induced rat fibroblast-like synoviocytes[J]. Inflamm Res,2014,63(6):451-462.
[29] WANG J W,PAN Y B,CAO Y Q,et al. Loganin alleviates LPS-activated intestinal epithelial inflammation by regulating TLR4/NF-κB and JAK/STAT3 signaling pathways
[J]. Kaohsiung J Med Sci,2020,36(4):257-264.
[30] SHI L,HAO Z,ZHANG S,et al.Baicalein and baicalin alleviate acetaminophen-induced liver injury by activating Nrf2 antioxidative pathway:the involvement of ERK1/2 and PKC[J]. Biochem Pharmacol,2018,150:9-23.
[31] SINGH S,SINGH D K,MEENA A,et al. Rutin protects t-butyl hydroperoxide-induced oxidative impairment via modulating the Nrf2 and iNOS activity[J]. Phytomedicine,2019,55:92-104.
[32] JIANG G Y,CHEN D Y,LI W P,et al. Effects of wogonoside on the inflammatory response and oxidative stress in mice with nonalcoholic fatty liver disease[J]. Pharm Biol,2020,58(1):1177-1183.
[33] YU W,XU Z,GAO Q,et al. Protective role of wogonin against cadmium induced testicular toxicity:involvement of antioxidant,anti-inflammatory and anti-apoptotic pathways[J]. Life Sci,2020,258:118192.
[34] YANG L,SHEN L,LI Y,et al. Hyperoside attenuates dextran sulfate sodium-induced colitis in mice possibly via activation of the Nrf2 signalling pathway[J]. J Inflamm (Lond),2017,14:25.
[35] WANG Y,TANG C,ZHANG H. Hepatoprotective effects of kaempferol 3-O-rutinoside and kaempferol 3-O-glucoside from Carthamus tinctorius L. on CCl4-induced oxidative liver injury in mice[J]. J Food Drug Anal,2015,23(2):310-317.
[36] LEE Y J,HSU J D,LIN W L,et al. Upregulation of caveolin-1 by mulberry leaf extract and its major components,chlorogenic acid derivatives,attenuates alcoholic steatohepatitis via inhibition of oxidative stress[J]. Food Funct,2017,8(1):397-405.
[37] LIU D,WANG H,ZHANG Y,et al. Protective effects of chlorogenic acid on cerebral ischemia/reperfusion injury rats by regulating oxidative stress-related Nrf2 pathway[J].Drug Des Devel Ther,2020,14:51-60.
[38] DU Y,YOU L,NI B,et al. Phillyrin mitigates apoptosis and oxidative stress in hydrogen peroxide-treated RPE cells through activation of the Nrf2 signaling pathway[J].Oxid Med Cell Longev,2020,2020:2684672.
[39] BIAN K Y,JIN H F,SUN W,et al. DCA can improve the ACI-induced neurological impairment through negative regulation of Nrf2 signaling pathway[J]. Eur Rev Med Pharmacol Sci,2019,23(1):343-351.
[40] LI C,ZHANG S,LI L,et al. Ursodeoxycholic acid protects against arsenic induced hepatotoxicity by the Nrf2 signaling pathway[J]. Front Pharmacol,2020,11:594496.
[41] ZHANG S,HU B,XU J,et al. Baicalin suppress growth and virulence-related factors of methicillin-resistant Sta- phylococcus aureus in vitro and vivo[J]. Microb Pathog,2020,139:103899.
[42] 赵强,赵海福.紫花苜蓿中芦丁的提取及抗菌活性研究[J].中国奶牛,2013(20):26-27.
[43] 王亚男,柳秉润,邓旭明,等.芦丁对金黄色葡萄球菌Sortase A抑制作用的初步研究[J].吉林农业大学学报,2013,35(3):303-307.
[44] LOU Z,WANG H,ZHU S,et al. Antibacterial activity and mechanism of action of chlorogenic acid[J]. J Food Sci,2011,76(6):M398-M403.
[45] VINH P T,SHINOHARA Y,YAMADA A. Baicalein inhibits stx1 and 2 of EHE:effects of baicalein on the cytotoxicity,production,and secretion of shiga toxins of enterohaemorrhagic escherichia coli[J]. Toxins (Basel),2019,11(9):505.
[46] PEREIRA A P,FERREIRA I C,MARCELINO F,et al.Phenolic compounds and antimicrobial activity of olive (Olea europaea L. Cv. Cobran?osa) leaves[J]. Molecules,2007,125(5):1153-1162.
[47] ZHOU S,ZHANG A,CHU W. Phillyrin is an effective inhibitor of quorum sensing with potential as an anti-Pseudomonas aeruginosa infection therapy[J]. J Vet Med Sci,2019,81(3):473-479.
[48] LANG S M,ORTMANN J,ROSTIG S,et al. Ursodeoxycholic acid attenuates hepatotoxicity of multidrug treatment of mycobacterial infections:a prospective pilot study[J]. Int J Mycobacteriol,2019,8(1):89-92.
[49] 韋祖猛,黄卫清,赵宁波,等.基于网络药理学及分子对接技术的痰热清胶囊治疗新冠肺炎的物质基础及机制研究[J].中国中医急症,2020,29(10):1705-1708.
[50] SHI H,REN K,LV B,et al. Baicalin from Scutellaria baicalensis blocks respiratory syncytial virus (RSV) infection and reduces inflammatory cell infiltration and lung injury in mice[J]. Sci Rep,2016,6:35851.
[51] MA S C,DU J,BUT P P,et al. Antiviral Chinese medicinal herbs against respiratory syncytial virus[J]. J Ethnopharmacol,2002,79(2):205-211.
[52] DAS S,SARMAH S,LYNDEM S,et al. An investigation into the identification of potential inhibitors of SARS- CoV-2 main protease using molecular docking study[J]. J Biomol Struct Dyn,2021,39(9):3347-3357.
[53] DWIVEDI V D,BHARADWAJ S,AFROZ S,et al. Anti-dengue infectivity evaluation of bioflavonoid from Azadirachta indica by dengue virus serine protease inhibition[J]. J Biomol Struct Dyn,2021,39(4):1417-1430.
[54] PARVEZ M K,TABISH REHMAN M,ALAM P,et al.Plant-derived antiviral drugs as novel hepatitis B virus inhibitors:cell culture and molecular docking study[J]. Saudi Pharm J,2019,27(3):389-400.
[55] BOSE M,KAMRA M,MULLICK R,et al. Identification of a flavonoid isolated from plum (prunus domestica) as a potent inhibitor of Hepatitis C virus entry[J]. Sci Rep,2017,7(1):3965.
[56] CAO Z,DING Y,KE Z,et al. Luteoloside acts as 3C protease inhibitor of enterovirus 71 in vitro[J]. PLoS One,2016,11(2):e0148693.
[57] DING Y,CAO Z,CAO L,et al. Antiviral activity of chlorogenic acid against influenza A (H1N1/H3N2) virus and its inhibition of neuraminidase[J]. Sci Rep,2017,7:45723.
[58] UTSUNOMIYA H,ICHINOSE M,KINHIBITION I,et al.By caffeic acid of the influenza a virus multiplication in vitro[J]. Int J Mol Med,2014,34(4):1020-1024.
[59] QU X Y,LI Q J,ZHANG H M,et al. Protective effects of phillyrin against influenza a virus in vivo[J]. Arch Pharm Res,2016,39(7):998-1005.
[60] LI N,ZHANG Y,WU S,et al. Tauroursodeoxycholic acid(TUDCA) inhibits influenza A viral infection by disrup- ting viral proton channel M2[J]. Sci Bull(Beijing),2019,64(3):180-188.
[61] 墻建军.痰热清胶囊治疗急性气管-支气管炎(风热犯肺型咳嗽)临床观察[D].武汉:湖北中医学院,2006.
[62] 墙建军,赵为军,杨宏志,等.痰热清胶囊治疗急性气管-支气管炎24例临床观察[J].中国中医急症,2005,14(12):1163-1164.
[63] 范小会,杜学航,范军铭,等.痰热清胶囊治疗急性气管-支气管炎(风热袭肺证)随机双盲单模拟多中心临床研究[J].中药药理与临床,2020,36(2):245-248.
[64] ZHU L,ZHANG J,XIA B,et al. Identification of potential molecular mechanisms of radiation pneumonitis deve- lopment in non-small-cell lung cancer treatment by data mining[J]. Radioprotection,2020,55(3):173-178.
[65] KASMANN L,MAAS J,BENDIKS L,et al. The role of TRP/Orai channels in the development of radiation-induced pneumonitis and pulmonary fibrosis[J]. Strahlenther Onkol,2020,196(Suppl 1):S185-S185.
[66] 张晓艳.痰热清胶囊联合抗生素对老年获得性肺炎血清hs-CRP、降钙素原的影响[J].陕西中医,2015,36(12):1590-1591.
[67] AHMEDTAHA O M,YAMI A,MOHAMMED M A. Treatment and outcomes of community-acquired pneumonia in hospitalized patients:the case of Jimma University Specialized Hospital[J]. Ther Innov Regul Sci,2014,48(2):220-225.
[68] CHEN J X,TIAN C,CHENG X G,et al. A case of asymptomatic SARS-CoV-2 infection followed by secondary community acquired pneumonia[J]. Quant Imag Med Surg,2020,10(11):2208-2211.
[69] ZHANG X,XUE Y,CHEN X,et al. Effects of tanreqing capsule on the negative conversion time of nucleic acid in patients with COVID-19:a retrospective cohort study[J]. J Integr Med,2021,19:36-41.
[70] 韩彦琪,刘耀晨,武琦,等.基于网络药理学的痰热清胶囊治疗新型冠状病毒肺炎(COVID-19)机制研究[J].中草药,2020,51(11):2967-2976.
[71] LI X X,ZHUO L,ZHANG Y,et al. The incidence and risk factors for adverse drug reactions related to tanreqing injection:a large population-based study in China[J]. Front Pharmacol,2019,10:1523.
(收稿日期:2020-12-24 修回日期:2021-05-25)
(编辑:罗 瑞)

