氮杂碳原位包覆Cu2O/Co3O4@C异质结构复合材料的设计构筑及高效储锂性能
田润赛,卢 芊,张洪滨,张 渤,冯源源,魏金香,冯季军,
(1.山东高校界面反应与传感分析重点实验室,2.济南大学化学化工学院,济南 250022)
自锂电池使用石墨碳负极商业化以来逐渐在诸多领域发挥了重要作用,但碳素材料因其较低的理论容量(372 mA·h/g)限制了锂电池性能的进一步提升[1~5].在可替代的锂离子电池负极材料中,过渡金属氧化物因其比容量较高,且价格低廉、安全性能较好等优点而成为研究热点[6,7].但过渡金属氧化物的低电导率和循环过程中的体积膨胀,导致其倍率特性和循环性能都不理想,阻碍了其在高能锂离子电池中的应用进程[8,9].为提高过渡金属氧化物的电化学性能,通常采用颗粒纳米化和表面碳包覆等方法来提高其导电能力并抑制其体积膨胀[10~13].纳米氧化物不仅可以通过缩短颗粒间的传输路径来提升材料的倍率性能,而且由于其高比表面积可提供更多的活性位点和界面赝电容,从而使得氧化物材料甚至呈现出高于其理论值的可逆容量.
Cu2O是一种p型半导体材料,具有环境友好及资源丰富等优点,在电催化和储能等领域引起了广泛关注[14~16].Cu2O制备简单并有良好的形貌可塑性,Kim等[17]通过调节合成路线中聚乙烯吡咯烷酮(PVP)的含量合成了尺寸可控的正八面体Cu2O材料,其表现出良好的电化学性能.但Cu2O较低的理论容量(375 mA·h/g)限制了其应用发展.与之相比,尖晶石结构的Co3O4因为多价态的特性,可提供更高的理论容量(890 mA·h/g),被认为是较理想的负极候选材料,但较低的电导率和充-放电过程中较大的体积变化率仍是其不可忽视的问题.
近年来,异质结构复合材料的设计构建吸引了研究者的关注.两种不同的金属氧化物(或硫化物、硒化物等),由于它们能量带隙(Eg)的差异,会在异质界面处产生内部电场,因此可以促进电荷传输并增强界面电极过程动力学,从而产生协同效应,展现出比各组分更优异的电化学性能[18].将Cu2O和Co3O4的优势相结合,设计构筑基于Cu2O/Co3O4的异质结构复合材料,将获得更高的容量和更好的稳定性.
本文通过液相法制备形貌可控的Cu2O纳米立方体颗粒,利用金属有机框架化合物(MOFs)的自组装形貌调控性,在Cu2O纳米立方体颗粒表面引入含Co的沸石咪唑酯骨架结构(ZIF)的双MOF材料ZIF-67/ZIF-8,成功制备了氮杂碳原位包覆的Cu2O/Co3O4@C异质结构复合材料,表征了该复合材料的结构和形貌,并研究了其作为锂离子电池负极材料的电化学性能.
1 实验部分
1.1 试剂与仪器
CuCl2·2H2O、NaOH、抗坏血酸(C6H8O6)、Co(NO3)2·4H2O、Zn(NO3)2·4H2O和N-甲基吡咯烷酮(NMP)均为分析纯,购自科密欧(天津市)化学试剂有限公司;2-甲基咪唑(分析纯),购自麦克林化学试剂有限公司;甲醇(分析纯),购自国药集团化学试剂有限公司;聚偏氟乙烯(PVDF,分析纯),购自太原力之源电池有限公司;锂电聚丙烯隔膜,购自美国Celgard公司;铜箔(分析纯),购自山东金宝电子股份有限公司;乙炔黑(分析纯),购自日本LION公司;金属锂片(分析纯),购自上海顺有金属材料有限公司;1 mol/L LiPF6的碳酸乙烯酯(EC)-碳酸二乙酯(DMC)(体积比1∶1)电解液购自深圳市科晶智达科技有限公司.
SmartlabSE型X射线衍射仪(XRD,日本理学株式会社,辐射源为CuKα,扫描范围2θ=10°~80°,步长为0.02°,扫描速率为10.0°/min);Gemini 300型扫描电子显微镜(SEM,德国蔡司公司);X-Max 80T型电制冷能谱仪和X-MAXN型能量色散光谱仪(EDS,英国牛津仪器有限公司);Quanta 250型透射电子显微镜(TEM,美国赛默飞公司);Tristar-Ⅱ-3020型比表面积测试仪(美国麦克公司);HCT-1型热重分析仪(恒久科学仪器厂,升温速率为10℃/min);RENISHAW型拉曼光谱仪(英国雷尼绍公司);kratos AXIS Supra型X射线光电子能谱仪(XPS,日本岛津公司).
1.2 Cu2O纳米立方体的制备
采用简单溶液法制备Cu2O纳米立方体.将2 mmol CuCl2·2H2O加入100 mL去离子水中并于60℃下搅拌溶解,再加入8 mmol NaOH继续在60℃下搅拌30 min得到蓝色溶液.而后向上述溶液中加入1.5 mmol C6H8O6继续搅拌30 min,至溶液呈现橘黄色后继续搅拌4 h.以6000 r/min速率离心分离5 min后,将沉淀用去离子水清洗3次后得到橘黄色沉淀前驱体.该前驱体在60℃真空干燥12 h后取出研磨,即可得到Cu2O粉末.
1.3 Cu2O/Co3O4@C异质结构复合材料的制备
样品制备的流程如Scheme 1所示.将得到的Cu2O粉末置于100 mL无水甲醇中,于室温下搅拌30 min使之充分分散混匀,继而加入1 mmol Co(NO3)2·4H2O和1 mmol Zn(NO3)2·4H2O继续搅拌至溶解.向溶液中滴加50 mL 0.16 mol/L 2-甲基咪唑甲醇溶液,在室温下继续搅拌5 h.再将上述溶液以6000 r/min速率离心分离5 min并用去离子水清洗沉淀,在60℃下真空干燥12 h后取出研磨,得到复合材料前驱体.将该前驱体于氮气气氛下于800℃煅烧2 h,而后退火到450℃,关闭氮气的流通,在空气气氛下继续煅烧2 h,自然冷却至室温后取出研磨,即得到Cu2O/Co3O4@C复合材料.
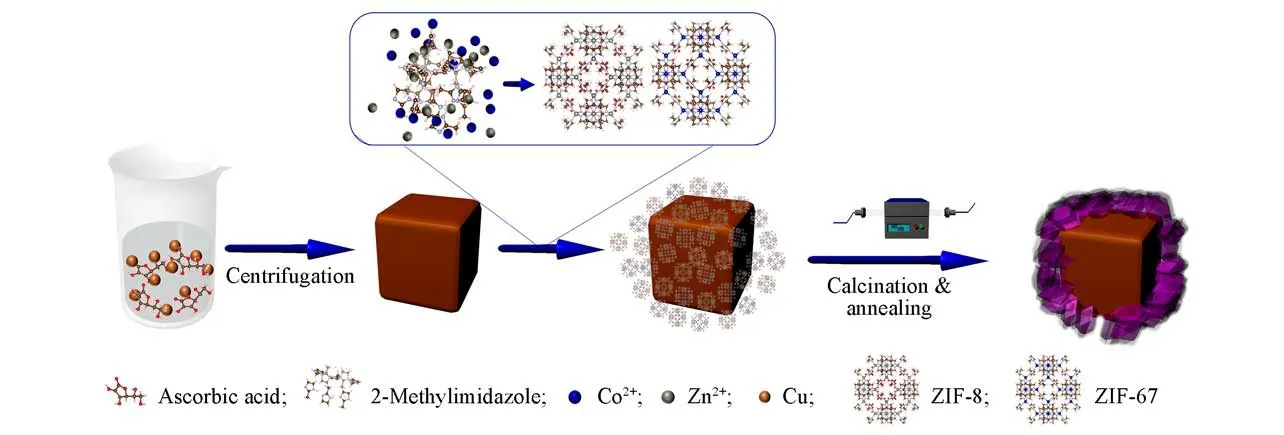
Scheme 1 Schematic illustration of the controllable construction of Cu2O/Co3O4@C heterostructure
1.4 Cu2O/Co3O4@C复合材料的电化学性能测试
按质量比8∶1∶1称取活性物质Cu2O/Co3O4@C复合材料、乙炔黑与PVDF,加入NMP混合均匀成浆后刮涂在铜箔上,于80℃下干燥4 h后冲出直径为1.0 cm2的圆形片,然后在120℃下真空干燥12 h得电极片.于充满氩气的惰性气氛手套箱(德国布劳恩公司,Unilab 1950/780)中,将所制备的电极片与隔膜、电解液和金属锂对电极片组装成CR2025纽扣电池.用蓝电CT-2001A电池测试系统(武汉蓝电电子有限公司)在0.1~3.0 V范围内进行恒流充放电.通过CHI760D电化学工作站(上海辰华仪器有限公司)进行循环伏安(CV)测试,扫描电位范围为0.1~3.0 V,扫描速率为0.1 mV/s.用SP-150电化学工作站(法国Bio-Logic公司)进行电化学阻抗谱测试,交流信号振幅为5 mV,频率范围为10 mHz~200 kHz.
2 结果与讨论
2.1 材料的表征
图1为Cu2O及Cu2O/Co3O4@C复合材料的XRD谱图.可以看出,样品Cu2O各衍射峰位置与Cu2O的标准谱图(PDF#75-1531)一致.Cu2O@Co3O4/C复合材料则呈现出Cu2O与Co3O4(PDF#42-1467)的组合特征,表明Cu2O@Co3O4/C异质结构复合材料已成功构建.图1(A)中2θ=37°附近有两个较为尖锐的衍射峰,将其2θ=33°~40°的范围放大[图1(B)],可以看出位于2θ=36.54°处的衍射峰与Cu2O(111)晶面对应,而2θ=36.88°处的衍射峰对应于尖晶石型Co3O4(311)晶面.此外,在2θ=20°~30°之间存在的衍射峰宽化是典型的无定型碳衍射特征[19].
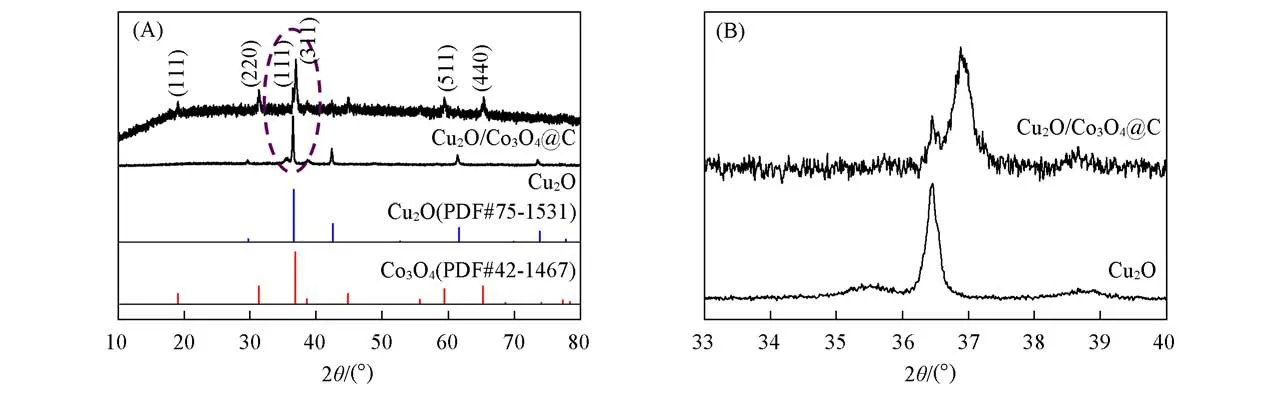
Fig.1 XRD patterns(A)and close-up patterns between 33°and 40°(B)of Cu2O and Cu2O/Co3O4@C composite material
为明确Cu2O/Co3O4@C复合材料中碳成分的含量,对材料进行了热重分析.由图2(A)可见,在100~525℃之间发生了较明显的材料质量损失,而在525℃以上的后续升温过程中质量则基本稳定.在350℃之前约有2.51%的轻微质量损失,主要归因于吸附水的挥发和材料制备过程中引入的残留有机溶剂和配体的分解、释放[20],350~525℃之间显著的质量损失则是复合材料中的碳成分氧化流失造成的,由此推算材料中的碳含量约为3.07%[21].图2(B)所示的拉曼光谱表征及拟合结果进一步表明了碳元素在Cu2O/Co3O4@C复合材料中的存在形式,位于1557.9 cm-1的G峰对应于石墨层状结构中sp2杂化碳原子的面内伸缩振动,而在1326.4 cm-1处出现的D峰则是由晶格缺陷和碳原子排布的长程无序化程度所引起的.D峰与G峰较高的峰面积比值(ID∶IG=1.2480)表明碳晶格中存在一定程度的杂原子掺杂缺陷[22],且碳成分主要以无定型的形式存在,与XRD谱图中的无定型碳衍射峰一致.

Fig.2 TG behavior(A)and Raman spectrum(B)of Cu2O/Co3O4@C composite material
利用扫描电子显微镜和透射电子显微镜对Cu2O和Cu2O/Co3O4@C异质结构复合材料的形貌进行了观察,结果如图3所示.由图3(A)可见,Cu2O呈现为表面光滑、分散性良好的立方体颗粒,尺寸约为80~250 nm.ZIF-67和ZIF-8双MOF衍生的多孔结构Co3O4多面体小颗粒(粒径约为20 nm)自组装在Cu2O立方体表面.同时,MOF的有机配体在热解过程中形成的残余碳原位包裹在上述Cu2O/Co3O4核/壳异质结构颗粒表面,成功构建了双壳层的Cu2O/Co3O4@C异质结构复合材料,颗粒尺寸约为220~400 nm,如图3(B)所示.Cu2O/Co3O4@C的EDS能谱表征如图3(C)~(F)所示,展示了Co,Cu,O和C等各元素的分布情况.从图3(G)的TEM照片可以更加清晰地看出内部为Cu2O立方体,外面紧密包裹着Co3O4多面体小颗粒和薄碳层的异质核/壳结构.图3(H)为EDS线扫描的元素分布图,可以明显看出Cu元素在颗粒内部,Co元素在壳层,C元素在外表面薄层的分布状况,进一步证实双壳层Cu2O/Co3O4@C异质结构的成功构建.
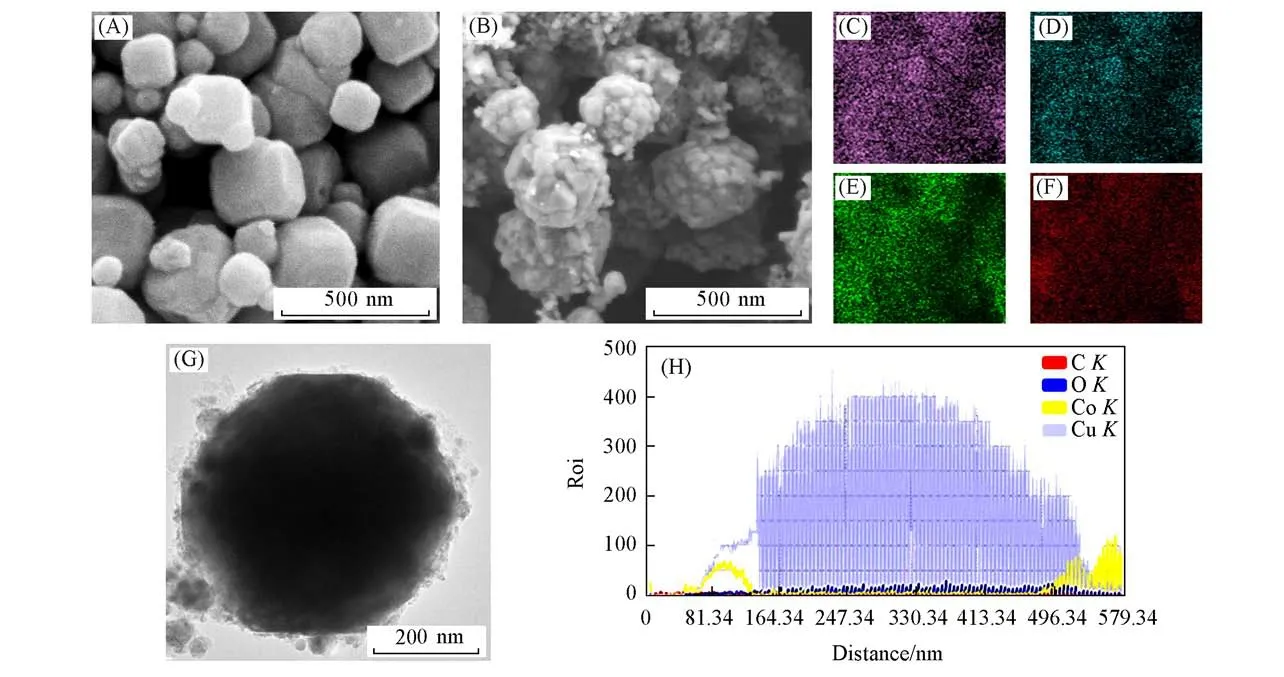
Fig.3 SEM images of Cu2O(A)and Cu2O/Co3O4@C(B)composite material and the individual EDS elemental mapping images of Co(C),Cu(D),O(E),C(F)of Cu2O/Co3O4@C,TEM image(G)and EDS line scan(H)of Cu2O/Co3O4@C
图4 (A)为Cu2O/Co3O4@C复合材料的XPS谱图,可见,其主要元素为Cu,Co,O,C和N.对Co2p谱进行分峰拟合,如图4(B)所示,在780.1和794.9 eV处出现了两个主峰,分别对应于Co3+(778.5 eV)与Co2+(780.2 eV)的Co2p3/2结合能和Co3+(791.35 eV)与Co2+(794.8 eV)的Co2p1/2结合能;此外,在796.9和783.7 eV处还出现了Co3O4的典型振动卫星峰[23].因此,该复合材料中Co3O4中的Co以Co3+和Co2+两种混合价态存在.从图4(C)中Cu2p谱图可见,位于931.6和951.6 eV处的两个较为明显的峰分别对应Cu+的Cu2p3/2和Cu2p1/2轨道,而位于933.7 eV处的Cu2p3/2轨道峰和954.1 eV处的Cu2p1/2的轨道峰以及旁边的卫星峰,则归属于Cu2+的典型特征,表明Cu+占据着主导地位,有部分Cu2+的存在.Cu2O/Co3O4异质结构中的过渡金属Co和Cu都以混合价态形式存在,而多价态特性有利于在异质结构界面处形成内部电场,从而进一步提高材料的本征电导率[24].图4(D)中C1s谱可拟合为分别位于283.9,284.9和288.0 eV处的3个不同峰,分别对应于sp2杂化的石墨碳中C=C/C—C键和C—N键及C—O/C=O键.C—N键的存在意味着ZIF-67/ZIF-8热解碳中氮掺杂缺陷的存在.由N1s谱图[图4(E)]可见,位于398.2,399.6和400.8 eV处的3个峰分别归属于吡啶氮、吡咯氮和石墨氮,进一步证实氮杂碳的存在,与拉曼光谱的分析一致.氮原子掺杂造成的碳晶格拓扑缺陷,能够使得碳材料具有更好的化学亲和性,并产生更高的载流子密度和表面反应活性,从而使得复合材料获得更高的电子/离子传输能力,有效提升材料的综合电化学性能[10].XPS谱图未出现ZIF-8中Zn元素的特征峰,这是由于Zn的沸点较低,在高温热解过程中挥发流失了,与XRD中未出现属于锌化合物衍射峰是一致的.ZIF-67/ZIF-8双MOF的热解和Zn的挥发,能够在复合材料中留下丰富的层级孔道结构.
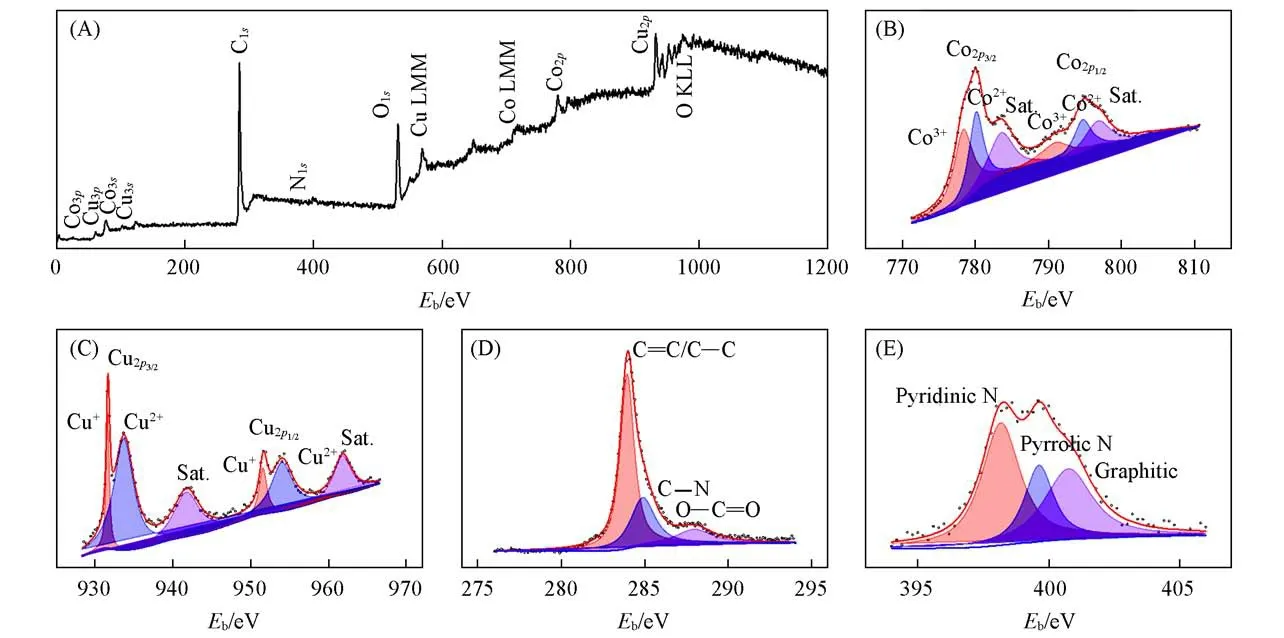
Fig.4 XPS spectra of Cu2O/Co3O4@C composite material(A)Survey scan;(B)Co2p;(C)Cu2p;(D)C1s;(E)N1s.
为进一步表征复合材料的孔结构,图5(A)和(B)分别给出了Cu2O和Cu2O/Co3O4@C复合材料的氮气吸附-脱附等温曲线及孔径分布.可见,Cu2O/Co3O4@C复合材料的比表面积和孔隙率都远高于Cu2O立方体材料.吸附-脱附等温曲线和孔径分布图均表明Cu2O/Co3O4@C复合材料为微孔、介孔和大孔同时存在的层级孔道结构,这不仅能够增加材料的比表面积,提供更多的反应活性位点,而且能够改善电解液的浸润并缩短电子/离子传输路径;同时还有利于缓解反复充放电过程中的体积应变[6,25,26].
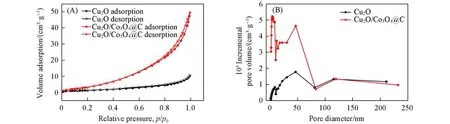
Fig.5 N2 adsorption-desorption isotherm(A)and pore size distribution(B)of Cu2O and Cu2O/Co3O4@C composite material
2.2 材料的电化学性能
图6(A)给出了Cu2O/Co3O4@C复合材料的循环伏安曲线.在首次扫描中,自初始开路电位向阴极还原方向扫描,首先在0.90,0.85和0.40 V处出现3个还原峰,其中位于0.90和0.85 V的两个叠加还原峰分别对应于Cu2O中Cu+的还原以及Co3O4中Co3+和Co2+的还原,同时伴随着Li2O的生成[16],符合氧化物负极材料转化反应的储锂机理;而在0.40 V处的还原峰则对应着电解质的部分不可逆分解和固体电解质界面(SEI)膜的形成[17],与首次放电曲线的形状[图6(B)]和首次充放电过程84%的库伦效率[图6(C)]相吻合.位于1.45和2.00 V处的两个氧化峰,对应于Cu单质向Cu2O和Co单质向Co3O4的氧化转变.在后续循环扫描中,由于材料中部分氧空位和异质结构界面内建电场的存在,复合材料的两对氧化/还原峰逐渐宽化且峰电位差逐渐缩小并趋于稳定;相应地,后续的放电曲线也基本重合[图6(B)],后续充放电循环的库伦效率也稳定在接近100%[图6(C)],充分说明Cu2O/Co3O4@C复合材料具有很好的电化学反应可逆性.从图6(B)还可见,Cu2O/Co3O4@C复合材料在0.5 A/g电流密度下的首次放电比容量达到了1504 mA·h/g,并在10次循环后依旧稳定在1136 mA·h/g,而0.1 A/g电流密度下的首次放电比容量则达到了2065 mA·h/g[图6(D)],远高于其基于金属全部还原所对应的理论容量.这是纳米金属氧化物的特殊反应机理所致,除发生MxOy+2yLi++2ye-==xM0+yLi2O的过渡金属氧化/还原反应之外,Li2O还可能会进一步发生表面转化反应,并伴有部分界面赝电容同时贡献可逆容量[27~30].复合材料纳米化的特殊形貌和多孔的高比表面积及其异质结构的设计,为可逆的氧化/还原反应和表面转化反应提供了更充分的活性位点及界面赝电容,从而使得该材料呈现高于其理论值的放电比容量,并具有高度可逆性.

Fig.6 Electrochemical performance of Cu2O/Co3O4@C composite material CV profiles at a scan rate of 0.1 mV/s between 0.1 V and 3.0 V(A),charge/discharge curves at 0.5 A/g(B),cycling performance and coulombic efficiencies at 0.5 A/g(C),rate performance(D)and long-life cycling performance(E)at 1 A/g
由图6(D)可见,随着放电倍率的增大,Cu2O/Co3O4@C复合材料仍然保持较高的比容量,在0.5,1.0和2.0 A/g电流密度下的可逆放电比容量分别为650,500和360 mA·h/g.这充分说明得益于Cu2O/Co3O4异质结构的构建和颗粒表面原位包覆氮杂碳的协同作用,Cu2O/Co3O4@C复合材料的电子导电性和离子电导率均得到显著提升,从而使得材料在大电流密度下的电化学反应极化较小,表现出优异的倍率性能.
0.5 A/g电流密度下的循环曲线[图6(C)]和1.0 A/g电流密度下的长循环曲线[图6(E)]均表明,Cu2O/Co3O4@C复合材料具有很好的循环稳定性.在前几次循环中,由于SEI膜的形成和反复氧化/还原反应中材料结晶度的降低以及转化反应过程中颗粒的界面重构和伴生的Li2O脉络逐渐形成,材料放电比容量呈现下降趋势;之后,由于锂化诱导的激活和金属氧化物的逐渐活化,以及高反应活性界面层的逐步构建,材料的可逆放电容量又逐渐有所回升并在之后趋向于稳定.材料优异的循环性能充分表明,Cu2O/Co3O4@C双壳/核异质结构的设计和成功构建,能够有效抑制材料在反复充放电过程中的体积效应,保证了很好的结构缓冲能力和稳定性及反应可逆性.
为进一步印证Cu2O/Co3O4@C异质结构对体积膨胀的抑制作用和其结构稳定性,将0.5 A/g电流密度下循环100次后的电池拆解并用EC清洗极片后,通过SEM观察其充放电循环后的形貌变化.由图7(A)和(B)可见,除了极片制作过程中添加的PVDF黏结剂和乙炔黑导电剂在颗粒表面均匀覆盖之外[31],Cu2O/Co3O4@C复合材料在经历100次循环后,颗粒形状和尺寸基本保持不变.对循环后电极的SEM照片[图7(B)]进行能谱分析[图7(C)~(F)],Co,Cu,C和O元素的分布情况表明复合材料颗粒很好地保持了Cu2O/Co3O4@C的初始形貌和双壳/核结构,这也进一步验证了Cu2O/Co3O4@C异质结构的设计和成功构建,确实能够有效抑制复合材料在反复充放电过程中的体积效应,从而保持良好的反应可逆性和循环稳定性.

Fig.7 SEM images(A,B)and EDS maps of Co(C),Cu(D),C(E)and O(F)of Cu2O/Co3O4@C composite material after 100 cycles at 0.5 A/g
Cu2O/Co3O4@C异质结构复合材料呈现出优异的电化学性能,为进一步探究其电化学机制和Li+在复合材料结构中的扩散动力学,分别在首次和第2,5,20,50次循环后的1.0 V充电电位下进行了交流阻抗测试.图8(A)给出了不同循环次数后的Nyquist图及其拟合曲线,插图为其等效电路,拟合结果列于表1.可见,Nyquist图由中高频区域的半圆和低频区的直线组成.其中,高频区半圆始端与ZRe的交点代表电极附近的溶液电阻(Re),半圆则代表着电解液与电极材料之间的电荷转移及氧化还原反应电阻(Rsf+ct)和双电层电容及界面赝电容(CPE),低频区的斜线对应于Li+固相扩散的Warburg阻抗(W0),是整个电极过程的动力学速率控制步骤.由表1可见,不论是首次或经过多次充放电循环后,溶液电阻始终稳定维持在很小的数值,这主要是由于Cu2O/Co3O4@C复合材料较高的比表面积和表面层级多孔形态有利于电解液的充分浸润,并且说明复合材料的形貌和孔隙结构得以在反复循环过程中得到很好的保持,这与图7展示的形貌保持一致.值得关注的是,代表电解液与电极材料之间电荷转移及氧化还原反应综合动力学的Rsf+ct也呈现较低数值,且在反复循环过程中始终保持稳定在低值,说明Cu2O/Co3O4@C复合材料的结构设计和原位氮杂碳包覆及表面层级多孔的协同作用,有效降低了电化学极化并提升电化学反应的可逆性和反应动力学,同时能够抑制循环过程中的体积应变效应,从而得以呈现如前所述的优良循环性能和倍率特性.
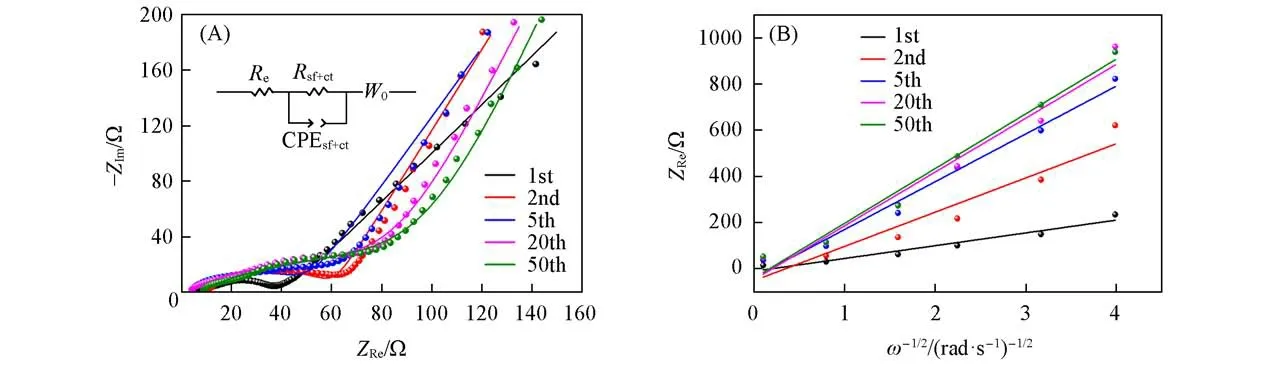
Fig.8 Nyquist plots and fitting curves(A)and the relationship between Z Re andω-1/2(B)of Cu2O/Co3O4@C composite material after diverse cycles(A)Inset shows the equivalent circuit diagram.
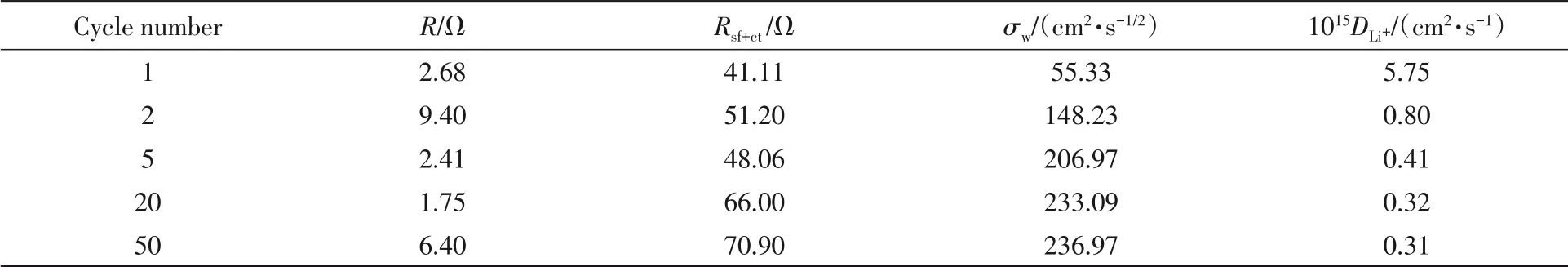
Table 1 EIS fitting results of Cu2O@Co3O4/C composite material after diverse cycles

式中:R(8.314 J·K-1·mol-1)为气体摩尔常数;T(室温298 K)为温度;A为电极与电解质之间的接触面积(此处代入电极片的几何面积0.784 cm2);n为每摩尔反应的得失电子数;F(96485 C/mol)为法拉第常数;cLi(0.0571 mol/cm3)为电极中Li的浓度.
低频区的Warburg阻抗代表着Li+在电极内的固相扩散行为,可利用式(1)和式(2)进一步计算锂离子扩散系数DLi+[32].交流阻抗的实部ZRe可用式(1)表示,其中ω为低频区域的角频率.如图8(B)所示,ZRe与ω-1/2呈线性关系,斜率为σw.根据线性关系拟合的斜率σw可进一步由式(2)计算锂离子扩散系数DLi+.σw和DLi+的计算结果也列于表1.
由DLi+的计算结果可知,除首次循环与部分不可逆转化反应相关的较低角频率外,Cu2O/Co3O4@C复合材料在后续循环中始终保持相对较高的DLi+值,除前面数次循环中由于电极极化造成的轻微下降外,在20次循环后就基本保持不变.这与循环曲线变化规律(图6)和经过100次充放电后材料形貌(图7)良好保持一致,也进一步从电极反应动力学的角度印证了材料优异的离子导电性和循环稳定性,说明Cu2O/Co3O4@C复合材料结构设计的协同作用,能够显著改善电极反应动力学,降低欧姆极化和扩散极化,保证电极过程有更高的反应速率和更好的可逆性、稳定性,从而使得材料展现出优异的综合电化学性能.
3 结 论
采用简单液相法制备了Cu2O立方体,并利用ZIF-67和ZIF-8双MOF衍生的多孔结构Co3O4@C多面体小颗粒,自组装在Cu2O纳米立方体表面,成功构建了层级多孔Co3O4和氮杂碳双壳层的Cu2O/Co3O4@C异质结构复合材料.结果表明,该复合材料用作锂离子电池负极材料时呈现出优异的综合电化学性能,在0.1和0.5 A/g电流密度下的首次放电比容量分别达到2065和1504 mA·h/g,在0.5,1.0和2.0 A/g电流密度下的可逆放电比容量分别为650,500和360 mA·h/g,在1 A/g电流密度下循环350次后仍有530 mA·h/g的高可逆放电容量.优异的电化学性能得益于异质结构设计、形貌调控、表面多孔特性和缺陷氮杂碳的协同作用,使得复合材料获得更高的电子/离子传输能力,并有效缓解反复充放电过程中的体积应变.异质结构复合材料的设计构建为锂离子电池高能量密度负极材料的开发提供了新的视角.

