不同剂量伊马替尼治疗胃肠间质瘤患者的血药浓度和不良反应临床研究*
黄烽如,孙鲁宁,钱 伊,张 强,徐 皓,王永庆
(南京医科大学第一附属医院,江苏 南京 210029)
伊马替尼是首个被批准用于治疗胃肠间质瘤(GIST)的蛋白酪氨酸激酶抑制剂[1],临床获益高,近50% 的晚期 GIST 患者存活超过 5 年[2-3]。伊马替尼常见药品不良反应(ADR)有腹泻、水肿、疲劳、肌肉痉挛、恶心、皮疹等[4]。研究表明,伊马替尼的血药浓度与ADR 发生密切相关,高血药浓度易导致白细胞减少和肝功能障碍[5]。本研究中基于医院的单中心、观察性伊马替尼Ⅳ期临床试验,对接受伊马替尼治疗的GIST 患者开展了血药浓度和ADR 的监测和随访。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄29 ~82 岁;身体状况良好,无主要器官疾病;接受伊马替尼治疗至少4 周;复发风险评估多为中危和高危。本研究经医院医学伦理委员会批准,患者签署知情同意书。
病例选择与分组:选取我院2014 年12 月至2017年11 月接受伊马替尼口服治疗的GIST 患者173 例,按伊马替尼剂量的不同分为 300 mg 组(27 例)、400 mg 组(130 例)、600 mg 组(10 例)、其他组(6 例)。
1.2 伊马替尼血药浓度监测
患者接受伊马替尼(Gleevec,诺华制药)的剂量为400 mg/d;对于疾病进展或术后复发的患者,建议将原剂量增至600 mg/d;对伊马替尼600 mg/d 无反应者推荐将剂量增至800 mg / d;如不耐受伊马替尼或发生严重 ADR 者,剂量调整为 200 ~ 300 mg / d,甚至停用伊马替尼治疗。入组第1 个月及之后每3 个月进行伊马替尼血药浓度监测。于给予伊马替尼前和3 h 后采集患者静脉血 6 ~8 mL,肝素抗凝共 2 次。采集血样,于4 ℃下3 000 r/min 离心10 min,收集上层血浆。所有血浆样本置-80 ℃冰箱中保存,待测,采用高效液相色谱-串联质谱(HPLC - MS /MS)法监测血药峰浓度和谷浓度[6]。
1.3 ADR 评估
根据美国国家癌症研究院(NCI)不良事件评价标准 CTCAE 4.0,制订 GIST 患者 ADR 评价表。随访期间,记录和评估ADR 的严重程度,若出现严重ADR,则给予专科治疗,并对严重ADR 患者进行定期随访,直至病情稳定。
1.4 统计学处理
2 结果
2.1 患者基本信息
共纳入173 例经病理诊断为GIST 并口服伊马替尼治疗的患者,基本信息见表1。由于发生ADR,31 例患者剂量减为 100,200,300 mg/d;由于疾病进展,10 例患者剂量增至 600 mg/d。2 例(1.16%)因严重白细胞减少和间质性肺炎停药,停药时间最长为45 d,缓解后,继续服用原剂量伊马替尼。中位随访时间为21 个月(6 ~42 个月),患者年龄 29 ~82 岁,平均 57.5 岁。随访期间,6 例患者因病情进展而死亡,无病例失访。
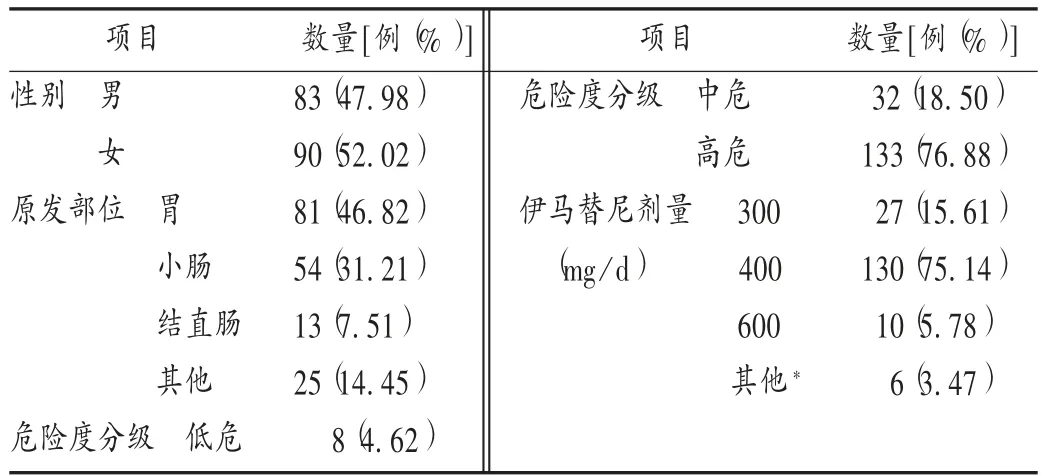
表1 173 例胃肠道间质瘤患者基本信息(n =173)Tab.1 Basic information of 173 patients with GIST(n = 173)
2.2 伊马替尼血药浓度
173 例GIST 患者服用伊马替尼的平均谷浓度(Cmin)为(1.45 ±0.79)μg/mL (0.26 ~5.13 μg/mL),平均峰浓度(Cmax)为(2.63 ± 1.07)μg /mL(0.72 ~ 7.63 μg /mL)。各剂量组伊马替尼血药浓度分布见图1 A 和图1 B。300 mg 组和400 mg 组血药浓度比较,差异均无统计学意义(P > 0.05);600 mg 组伊马替尼峰、谷浓度均显著高于其他组(P <0.01)。共 120 例患者随访时间达 24 个月,其伊马替尼血药浓度在第15 天达峰浓度,2 个月后逐渐下降。详见图1 C。

图1 给药1 个月后伊马替尼剂量与血药浓度的关系及2 年内血药浓度变化(*P <0.05,***P <0.001)A.Peak concentration of imatini after one month of administration(n =173) B.Trough concentration of imatini after one month of administration(n =173)C.Plasma concentration of imatinib within two years(n = 120)Fig.1 The correlation between imatinib dose and plasma concentration after one month of administration and the change of plasma concentration within two years(*P <0.05,***P <0.001)
2.3 各组ADR 发生情况
由表2 可见,90%以上的ADR 严重程度为Ⅰ~Ⅱ级。水肿 77 例(46.11%)、皮炎皮疹 73 例(43.71%)和白细胞减少61 例(36.53%),为服用伊马替尼患者中最常见的 ADR。此外,Ⅲ级间质性肺炎 2 例(1.20% )[7],神经系统紊乱 7 例(4.19% ),Ⅲ级贫血 1 例(0.60% )。但严重ADR 相对较少。随着给药剂量的增加,各类型ADR发生率逐渐增加。167 例患者总体 ADR 发生率为79.04%。600mg 组 ADR 发生率(90.00% ),高于 300mg 组(66.67% )和 400 mg 组(80.76% );水肿、恶心呕吐、疲劳和Ⅲ级及以上ADR 发生率均显著高于300 mg 组和400 mg 组。600 mg 组人均 ADR 发生例次为 2.50 例次,显著高于 300 mg 组(1.04 例次)和 400 mg 组(1.52 例次)。详见图2。在随访中发现,严重ADR 患者减药或停药后由于血药浓度下降,ADR 症状逐渐缓解。
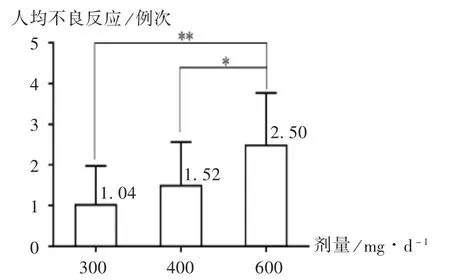
图2 各剂量组药品不良反应人均发生例次(*P < 0.05,**P < 0.01)Fig.2 Cases of ADR per capita in each dose group(*P < 0.05,**P < 0.01)

表2 各剂量组胃肠道间质瘤患者ADR 发生情况[例(%)]Tab.2 The incidence of ADR in patients with GIST in each dose group [case(%)]
3 讨论
本研究结果显示,600 mg 组的血药浓度显著高于300 mg 组和 400 mg 组,这与 YOO 等[8]的研究结果一致。目前普遍认为,检测伊马替尼的血药浓度对于GIST的用药指导和剂量调整具有重要指导意义。治疗初期,伊马替尼血药浓度 > 1 100 ng /mL[9],能显著提高患者的治疗获益率。本研究为Ⅳ期临床研究,患者能得到较严格的用药指导和监测,可很好地避免低血药浓度和药物暴露不足。伊马替尼治疗GIST 是长期过程,患者难以完全遵从医嘱严格、规范服药,从而导致疗效不佳[10]。因此,积极开展伊马替尼血药浓度的监测和用药指导尤为重要。此外,相较于检测药物总浓度,检测游离药物浓度与药物疗效更密切[11],因此开展伊马替尼游离药物浓度监测及游离药物浓度与疗效和ADR 相关性研究值得进一步关注。
目前,关于伊马替尼治疗GIST 患者的血药浓度与ADR 相关性的大样本研究较少,主要原因为伊马替尼血药浓度监测开展不足,患者依从性较低,因此可从服药剂量初步分析患者因血药浓度发生ADR 的类型和概率,可提前针对高剂量服药患者进行用药和ADR 宣教。本研究中发现,伊马替尼治疗GIST 后最常见的ADR 为水肿,其次为白细胞减少和皮疹。ADR 严重程度多为Ⅰ~Ⅱ级,多可耐受,无需干预[12]。当发生Ⅲ级及其以上 ADR 时,需及时减量或停药,通常症状会有所缓解。考虑到恶心和疲劳等的主观性和本研究样本量的局限性,需要更大样本量和客观的ADR 评价标准来研究ADR 发生特点。
伊马替尼主要由肝脏CYP3A4 和CYP3A5 酶代谢为活性代谢产物[13-14],且伊马替尼是 P - 糖蛋白和乳腺癌耐药蛋白的底物[15-17]。考虑基因多态性的存在,会导致酶活性差异较大,使伊马替尼体内代谢、转运过程存在差异,最终导致个体间血药浓度变异较大,影响ADR 的发生[18-19]。另有研究表明,白细胞介素 13 和重组人趋化因子14 相关位点的基因多态性分别与白细胞减少症和皮疹的发生相关[20]。因此,相关位点的基因多态性对伊马替尼的血药浓度和ADR 均有明确影响,随着研究的深入,可用于预测患者用药后血药浓度的范围及ADR 发生风险。
综上所述,需加强服用伊马替尼治疗GIST 期间患者的血药浓度监测和ADR 观察,一旦发现ADR,应及时调整并制订个性化药物治疗方案,以确保患者的用药安全,实现治疗获益最大化。

