脂肪细胞去分化及其调控机制研究进展
凌德凤,王力仪,单体中
(浙江大学动物分子营养学教育部重点实验室,浙江大学饲料科学研究所,浙江杭州 310058)
脂肪发育、沉积和代谢与动物的生长、生产、肉品质及人类健康密切相关。脂肪组织主要由脂肪细胞、成纤维细胞、血管内皮细胞、组织细胞和间充质干细胞等组成[1]。在哺乳动物体内,脂肪组织按照沉积部位可以分为皮下脂肪、内脏脂肪和肌内脂肪;按照颜色、形态、结构和功能的不同可以分为白色脂肪组织、米色脂肪组织和棕色脂肪组织。一方面,脂肪沉积直接影响畜禽的肉品质[2];另一方面,脂肪过度沉积与肥胖、糖尿病、心血管疾病、动脉粥样硬化等疾病密切相关[3]。因此,研究脂肪发育和沉积的调控机制具有重要意义。
一直以来,人们普遍认为分化是一个单向过程,但也有研究发现成熟脂肪细胞可以在体外去分化,形成具有分裂和增殖能力的去分化脂肪(Mature Adipocyte-Derived Dedifferentiated Fat,DFAT)细 胞[4],DFAT 细胞具有多向分化潜能,可以再分化形成脂肪细胞、骨细胞、软骨细胞、骨骼肌细胞、血管细胞和神经细胞等[5-10]。此外,Wang 等[11]研究发现,在妊娠末期和哺乳期,乳腺的脂肪细胞会发生脂质丢失变成前脂肪细胞样细胞的形态;Bi 等[12]研究发现,成熟脂肪细胞中高表达Notch 信号可诱导成熟脂肪细胞发生去分化。因此,脂肪细胞的去分化既可以发生在体外也可以发生在动物体内。本文在阐述脂肪细胞去分化的基础上,重点综述了DFAT 细胞的分化潜能、脂肪细胞去分化的调控机制及其在猪上的相关研究进展,为通过调控脂肪细胞去分化进而改善动物胴体和肉品质、提高人类健康水平提供一定的理论依据。
1 成熟脂肪细胞的形成与去分化
成熟脂肪细胞是由起源于中胚层的间充质干细胞逐步分化形成,包括间充质干细胞定向分化为前体脂肪细胞,前体脂肪细胞再进一步分化为成熟脂肪细胞(图1),其中有多种转录调控因子和信号通路参与,如过氧化物酶体增殖物激活受体γ(Peroxisome Proliferators Activate Receptors,PPARγ)、CCAAT/增强子结合蛋白(CCAAT/Enhancer Binding Proteins,C/EBPs)和信号传导及转录激活蛋白1(Signal Transducer and Activator of Transcription-1,STAT1)等[13]。成熟脂肪细胞的去分化是单房圆形指环状脂肪细胞逐渐丢失胞质中的脂质,变为成纤维细胞样细胞形态的DFAT 细胞的过程,DFAT 细胞是具有自我更新和多向分化潜能的细胞[14-15]。目前体外和体内脂肪细胞的去分化均已被发现和证实。

图1 成熟脂肪细胞形成与去分化
1.1 体外去分化 1986 年,Sugihara 等[4]首次利用天花板培养法获得具有分裂和增殖能力的去分化细胞,天花板培养法是一种利用脂肪细胞的漂浮性,将充满培养基的培养瓶倒置,使其附着于培养瓶底部的方法。Nobusue 等[16]从绿色荧光蛋白转基因小鼠皮下脂肪组织中分离出没有间质血管细胞且高度均匀的成熟脂肪细胞,利用天花培养法建立了DFAT 细胞系,同时证明获得的DFAT 细胞在体外培养至少22 代后仍具有增殖和分化能力。由于传统的天花板培养法需要消耗大量的试剂和细胞,宋子仪等[17]用普通培养皿加细胞载玻片的组合方式,使成熟脂肪细胞发生去分化,体外培养至第14 天基本都去分化为不含脂滴的成纤维细胞样细胞,并证明成熟脂肪细胞去分化是脂质分解和脂质形成相互平衡的结果。此外,Jumabay 等[18]开发了一种与天花板培养法不同的方法,即将分离的脂肪细胞置于培养基中悬浮培养24 h,接着将上清液接种到载有70 μm 过滤器的培养板中培养5 d,去分化的脂肪细胞通过过滤器黏附在培养板底部,而未去分化的脂肪细胞则被去除。
体外研究证实了DFAT 细胞不能表达与成熟脂肪细胞相关的标志物,如脂联素(Adiponectin,ADPN)、脂肪酸结合蛋白(Fatty Acid Binding Protein,FABP4)、脂蛋白脂酶(Lipoprotein Lipase,LPL)和PPARγ[19],却能表达与干细胞相关的标志物,如Oct4、Sox2、c-Myc和NANOG[20],这些结果表明DFAT 细胞具有干细胞特性。同时,有研究表明DFAT 细胞在不同的诱导介质中具有不同的分化潜能,DFAT 细胞与心肌细胞共培养时能够表达心脏标志物,表明DFAT 细胞有向心肌细胞分化的潜力[21]。DFAT 细胞在成骨诱导培养基中培养21 d 后可以表达成骨分化标志物Runt 相关转录因子2(Runt-Related Transcription Factor 2,Runx2),表明DFAT 细胞有向骨细胞分化的潜力[19]。
1.2 体内去分化 近年来,许多研究发现,在泌乳过程中脂肪细胞和乳腺上皮细胞的形态发生变化,乳腺导管上皮细胞扩张形成腺泡结构时,脂肪细胞丢失脂滴并去分化为成纤维细胞样细胞[11,22-23]。Morroni 等[24]研究发现,在啮齿类动物乳腺退化期,脂肪细胞是扩展形成乳腺的主体。因此,乳腺是研究脂肪细胞在体内生理状态下动态变化和脂肪细胞去分化的良好模型。Liao 等[25]将组织扩张器置于大鼠腹股沟脂肪组织下,通过注水使其逐渐扩张,在不同的时间点收集腹股沟脂肪组织,并进行形态学、组织学、细胞学和基因表达分析,结果显示扩大后的脂肪组织中的脂滴逐渐消失,变成成纤维细胞样细胞,且PPARγ、ADPN 和C/EBPα的表达量不断下降,提示成熟脂肪细胞发生去分化。另外,在病理条件下,成熟脂肪细胞也会发生去分化,如通过对小鼠模型进行谱系示踪发现,在皮肤纤维化、创伤愈合和乳腺癌变等条件下[26-28],脂肪细胞能够发生去分化。
体内研究证实了DFAT 细胞不能表达与成熟脂肪细胞相关的标志物,如FABP4、脂肪酸合酶(Fatty Acid Synthase,FASN)、葡萄糖转运酶-4(Glucose Transport Proteins 4,GLUT4)、瘦素(Leptin)和LPL[29],却能表达与前体脂肪细胞相关的标志物,如血小板源性生长因子受体α多肽(Platelet—Derived Growth Factor Receptor Alpha,PDGFRA),血小板源性生长因子受体β多肽(Platelet—Derived Growth Factor Receptor Alpha,PDGFRB)、淋巴细胞抗原6 重复位点蛋白6A 抗体(Lymphocyte Antigen 6 Complex,locus A Ly6a)、Cd34和整合素β1(Fibronectin Receptor Beta Subunit,Itgb1)[11]。有研究表明,DFAT 细胞在不同的诱导介质中具有不同的分化潜能,在大鼠急性心肌梗死模型中,移植的DFAT 细胞在梗死心肌中有效累积,并在移植8 周后表达横纹肌肌动蛋白[21]。在大鼠椎间盘退变模型中,移植的DFAT 细胞促进了椎间盘再生,提高了椎间盘高度,提示DFAT 细胞移植可能是治疗椎间盘退变的可行方法。
2 DFAT 细胞的分化潜能
目前,关于动物脂肪沉积的研究较为广泛,但没有关注如何合理利用成熟脂肪细胞的去分化能力靶向调控特定组织的脂肪沉积,如皮下脂肪和肌内脂肪;此外,DFAT 细胞的多向分化潜能也可以应用于临床研究。因此,从肉类科学和机体健康的角度出发,深入了解DFAT 的多向分化潜能具有重要意义。DFAT 细胞可分化脂肪细胞、肌肉细胞、骨细胞和软骨细胞、内皮细胞以及成神经细胞等多种细胞(图2)。
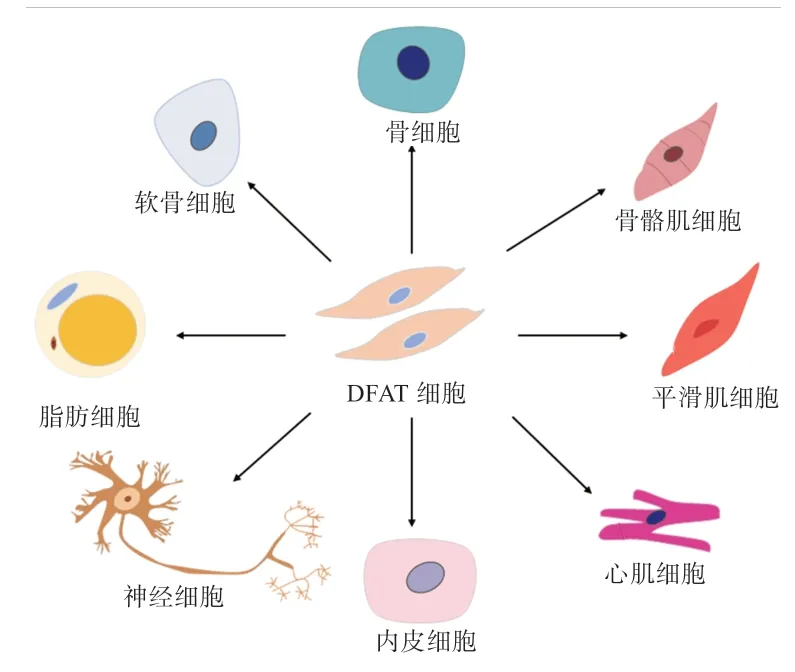
图2 DFAT 细胞再分化
2.1 成脂分化 许多研究证实,DFAT 细胞可以重新分化为前体脂肪细胞[16,30-31]。Takahashi 等[14]证明小鼠DFAT 细胞无需特殊处理即可成脂分化,而人类DFAT细胞则需要诱导成脂。Sun 等[32]从猪背长肌中分离纯化得到成熟脂肪细胞,经天花板培养为DFAT 细胞后,在体外成脂诱导条件下,细胞质中脂质堆积且PPARγ、C/EBPα、LPL和ADPN等基因的表达模式与脂肪前体细胞诱导成脂相似,说明DFAT 细胞可以再分化为成熟脂肪细胞。此外,DFAT 细胞已被证明具有体内成脂能力,Nobusue 等[16]将DFAT 细胞和3T3-L1 细 胞直接注射到小鼠胸骨皮下,发现注射DFAT 细胞的小鼠2 周后无需诱导即可生成脂肪垫,而注射3T3-L1 细胞的小鼠并未生成新的脂肪垫。Chen 等[33]研究发现,肌内脂肪来源的DFAT 细胞的PPARγ和C/EBPα的mRNA 相对表达水平高于内脏脂肪来源的DFAT 细胞,说明肌内脂肪来源的DFAT 细胞的成脂能力强于内脏脂肪来源的DFAT 细胞。
2.2 成肌分化 DFAT 细胞可以分化为骨骼肌细胞、平滑肌细胞和心肌细胞。有研究表明,DFAT 细胞在体外成肌诱导过程中,骨骼肌细胞的标志基因生肌决定因子(Myogenic Determination Gene,MyoD)和肌细胞生成素(myogenin,myoG)的表达量显著升高,随后细胞融合,形成表达肌球蛋白重链的多核细胞[34]。这些结果表明,从成熟脂肪细胞中分离纯化的DFAT 细胞可以在体外再分化为骨骼肌细胞。Pastor 等[35]将DFAT细胞移植到尿道括约肌扩张的大鼠模型中,发现对照组大鼠尿道平滑肌和外横纹肌层萎缩,而DFAT 细胞移植组大鼠平滑肌和横纹肌数量增加,说明DFAT 细胞有助于尿道平滑肌的恢复。此外,也有研究表明,10%~15%的DFAT 细胞能够在体外自发分化为心肌细胞,而且将DFAT 细胞注入缺血大鼠心脏中可诱导新生血管形成并促进心脏组织的康复[21,36]。
2.3 成骨和成软骨分化 DFAT 细胞是高度均匀同质的细胞系,在骨重建的临床应用上具有重大潜力。有研究表明,将DFAT 细胞接种到钛纤维网中,在成骨培养基中培养14 d,成骨细胞分化的终末期标志物骨钙素(Osteocalcin,OCN)和钙沉积显著升高,说明DFAT 细胞已分化为成骨细胞[37]。Okita 等[7]用全反式视黄酸处理DFAT 细胞,发现成骨相关转录因子Runx2、osterix 以及骨特异性碱性磷酸酶(Bone-Specific Alkaline Phosphatase,BAP)、骨桥素(Osteopontin,OPN)、OCN 等mRNA 相对表达量显著升高,而且,将全反式视黄酸处理过的DFAT 细胞通过扩散盒法移植到小鼠体内,可以观察到这些细胞在无宿主细胞参与的情况下可以形成异位骨样组织。Kishimoto 等[38]比较人DFAT 细胞和颊脂垫脂肪干细胞(Adipose-Derived Stem Cells,ASCs)的成骨分化能力发现,DFAT 细胞的BAP 含量和钙沉积量均高于ASCs,说明DFAT 细胞的成骨分化能力强于ASCs。有研究表明,将人DFAT细胞接种到成软骨诱导培养基后,软骨细胞标志物II 型胶原免疫染色呈阳性,阿尔辛蓝染色也呈阳性,提示有软骨性蛋白多糖的聚集,同时,软骨细胞早期分化标志基因SOX9 和成熟软骨细胞标志基因蛋白多糖和蛋白聚糖的mRNA 相对表达量也显著升高,这些结果说明人DFAT 细胞可以再分化为软骨分化[5]。此外,Okita 等[7]将DFAT 细胞接种到含有锶的成骨分化培养基中,14 d后发现成软骨标志基因I 型胶原α1 链基因的mRNA 相对表达量显著升高,说明锶可以促进DFAT 细胞的成软骨分化。
2.4 成血管分化 在血管生成过程中,由内皮细胞形成的新血管腔募集周细胞和平滑肌细胞,为血管提供一个理化环境的支持。Jumabay 等[39]观察到,在成熟脂肪细胞去分化过程中,造血细胞相关的细胞表面抗原CD10、CD24、CD40 和髓系细胞相关的细胞表面抗原CD13、CD44、CD86 表达增加,且在基质凝胶中培养的DFAT 细胞可以形成稳定的管状结构,并且检测到内皮标志物CD31 和血管内皮钙黏蛋白,提示DFAT 细胞可以重新分化为内皮细胞。在后肢缺血小鼠模型研究中,研究人员将DFAT 细胞注射到缺血性肌肉组织中,与对照组相比,DFAT 细胞移植小鼠血流量比值显著升高、成熟血管密度显著增加,说明DFAT 细胞在后肢缺血模型中可以促进新生血管生成和成熟;在低氧以及与血管内皮细胞共培养条件下发现,DFAT 细胞可以分泌血管生成因子,进一步通过免疫荧光染色发现DFAT 细胞可以再分化为周细胞[40]。
2.5 成神经分化 与ASCs 一样,DFAT 细胞也具有成神经的潜力,可以表达脑源性和胶质细胞系源性神经营养因子[15]。有研究表明,DFAT 细胞可以表达巢蛋白、β3-微管蛋白和胶质纤维酸性蛋白等神经标志物,将DFAT 细胞注射到脊髓损伤诱导的运动障碍的大鼠模型体内,可促进其运动功能恢复,而且在注射部位检测到表达β3-微管蛋白的移植细胞,同时,这些细胞也可以表达脑源性和胶质细胞系源性神经营养因子[41]。因此,推测DFAT 细胞可以再分化为神经细胞。
3 脂肪细胞去分化的调控机制
目前,关于脂肪细胞去分化已有相关研究报道,但对其去分化机制还知之甚少。一般来说,脂肪生成所需的关键基因和通路对脂肪细胞去分化也起到关键作用。研究表明,PPARγ是脂肪生成的主要调节因子[42],TGF-β[43]、Wnt[44]和Notch[45]信号通路主要起到抑制脂肪生成的作用,这些因子和通路也与脂肪细胞去分化密切相关(图3)。

图3 脂肪细胞去分化的调控机制
3.1 PPARγ作为脂肪生成的主要调节因子,PPARγ在脂肪细胞的去分化过程中发挥重要作用。脂肪肉瘤是软组织恶行肿瘤中最常见的一种,在50 多种间充质来源的恶性肿瘤中,其发病率约为20%[46]。Tontonoz 等[47]研究发现,PPARγ和类维生素A 受体的特异性配体可以刺激去分化脂肪肉瘤细胞再分化,是治疗脂肪肉瘤的有效药物。有研究表明,在Notch 信号驱动的脂肪肉瘤小鼠模型中,基因表达谱显示PPARγ通路相关的基因及其配体被抑制,通路分析进一步揭示了PPARγ相关通路被抑制,表明PPARγ信号的缺乏是Notch 驱动脂肪肉瘤发生的主要原因,而且PPARγ激动剂罗格列酮可以有效阻止脂肪肉瘤的发生[12]。近年来,越来越多的临床实验利用PPARγ激动剂治疗由于缺乏PPARγ引起的癌症[48-50]。
3.2 转化生长因子-β(Transforming Growth Factor-β,TGF-β) TGF-β也被证明能够直接调控脂肪细胞的去分化过程。有研究表明,TGF-β1 在人成熟脂肪细胞去分化过程中表达量显著升高,而且TGF-β1 的激活可显著促进脂肪细胞去分化[51]。在博来霉素诱导的小鼠真皮纤维化模型中,用TGF-β1 处理真皮层脂肪细胞24 h后,发现脂肪细胞特异性标志物围脂滴蛋白(Perilipin)和成肌纤维细胞标志物α-平滑肌肌动蛋白(α-Smooth Muscle Actin,α-SMA)存在共表达现象;DNA 芯片结果显示,TGF-β1 诱导真皮层脂肪细胞纤维化过程中,与纤维生成相关的基因表达上调,而与脂肪生成相关的基因表达下调,其中Wnt5a和分泌型卷曲相关蛋白2(Secreted Frizzled Related Protein 2,FRP2)的基因表达增加,表明TGF-β1 也可以通过影响其他途径来调控去分化[26]。
3.3 Wnt Wnt 信号通路也被证明与去分化有关,这与它抑制脂肪生成的作用一致。脂肪组织中的许多种细胞都可以分泌经典的Wnt 信号配体[52],其中Wnt3a 配体已被确定为3T3-L1 脂肪细胞去分化的增强剂[53],可以上调脂肪细胞中几种典型的未分化标志物,包括前脂肪因子-1(Preadipocyte factor-1,Pref-1)、Wnt10b和GATA2[52]。在高渗环境诱导的脂肪细胞去分化模型中,10 d 后观察到多数脂肪细胞脂滴消失,剩余脂肪细胞的数量和大小减少,同时,经典Wnt 信号通路相关基因Wnt7a、FZD5和SOX2显著升高[54]。用Wnt 配体分泌抑制剂IWP2 处理高渗环境下的小鼠脂肪细胞发现其去分化率显著降低,当通过添加外源性Wnt3a 配体挽救经典Wnt/β-catenin 信号通路时,高渗诱导的去分化得以恢复;等张性条件下,在无IWP2 的情况下,用外源性Wnt3a 配体处理脂肪细胞时,Wnt/β-catenin 信号通路增强,小鼠脂肪细胞去分化比例增加[54]。用3T3-L1 脂肪细胞和胰腺癌细胞在体外进行细胞迁移侵袭实验,观察到成纤维细胞样细胞的出现,同时发现成熟脂肪细胞典型的标志基因Leptin、ADPN、GLUT4、HSL和PPARγ的mRNA 相对表达量显著下降,成纤维细胞标志基因α-SMA 和脂肪生成负调控因子基质金属蛋白酶-11(Matrix Metalloproteinase-11,MMP-11)的mRNA 相对表达量显著升高,而且共培养的胰腺癌细胞中Wnt5a基因和蛋白在共培养早期表达增加[53]。进一步研究发现,胰腺癌细胞释放的Wnt5a 靶向作用于3T3-L1 脂肪细胞的Wnt 信号通路,激活c-Jun 和活化蛋白-1(Activator protein-1,AP1)信号;在共培养体系中加入Wnt5a 受体竞争性抑制剂分泌型卷曲相关蛋白5(Secreted Frizzled Related Protein 5,SFRP5),可阻断3T3-L1 细胞下游Wnt 信号,并阻止其去分化[53]。
3.4 Notch 另一个驱动去分化的信号通路是Notch 信号通路。早期的研究报道了Notch 及其配体和受体在脂肪细胞分化过程中作用并不一致,在体外环境下,Notch信号通路的激活可以抑制或促进脂肪生成[45,55-56]。Bi等[12]报道了脂肪细胞特异性激活Notch 信号(Ad/NICD)的小鼠在组织学形态、解剖定位和基因表达特征上与人去分化脂肪肉瘤相似,表现为肿瘤细胞中混杂有含脂滴的细胞,在肿瘤周围的纤维血管间质发现了脂肪细胞,说明Notch 信号的激活可以促进成熟脂肪细胞去分化;RT-PCR 结果显示,Ad/NICD 小鼠体内Notch信号通路相关基因Hes1、Heyl和Hey1的表达量显著升高,用γ-分泌酶抑制剂DAPT 抑制脂肪肉瘤细胞中Notch 信号的表达后,发现Notch 信号的靶基因Hes1的表达量显著下降,且能抑制脂肪肉瘤细胞的增殖[12],提示Notch信号的表达可以正向调控成熟脂肪细胞去分化。
4 猪脂肪细胞去分化的研究进展
在猪上,关于脂肪细胞去分化的研究主要集中在皮下和肌内脂肪细胞去分化及其DFAT 细胞的再分化成脂等相关研究。
4.1 皮下脂肪细胞 皮下脂肪组织是研究猪脂肪细胞去分化最常用的脂肪组织。高霞等[57]采集1 月龄仔猪的背部皮下脂肪组织,经天花板培养法进行去分化,培养至12 d 时,细胞质和培养基内几乎看不到脂滴,细胞完成去分化,接着进行成脂再分化发现,PPARγ的表达量在诱导早期较低,随后逐渐上升,说明猪DFAT 细胞具有类间充质干细胞的特性,且具有很强的成脂再分化潜能。Peng 等[19]采集5 日龄长白猪皮下脂肪细胞进行去分化,在去分化过程中,具有单个大脂滴的圆形成熟脂肪细胞逐渐转变为成纤维细胞样细胞,且成脂标志物PPARγ、FABP4、LPL和ADPN的表达量显著上升,流式细胞分析结果显示猪DFAT 细胞与间充质干细胞具有相似的细胞表面抗原,如CD44、CD29 和CD90 等。Matsumoto 等[5]从成年公猪背部分离皮下脂肪细胞进行天花板培养,经流式细胞分析后发现,与脂肪源性干细胞或基质细胞相比,DFAT 细胞具有高度同质的细胞群;PCR 结果显示成熟脂肪细胞相关的标志基因的表达量显著下降,而间充质干细胞相关的标志基因(如RUNX2和SOX9)的表达量显著升高,提示猪DFAT 细胞具有多向分化潜能。
4.2 肌内脂肪细胞 肌内脂肪沉积是影响猪肉品质的主要因素,获得高度纯化的肌内前体脂肪细胞是研究肌肉组织中脂肪细胞分化和代谢的关键。Sun 等[32]从猪背长肌中分离出成熟脂肪细胞,经天花板培养去分化为高度同质的DFAT 细胞,接着进行成脂诱导再分化发现,在诱导过程中,细胞质中脂质聚积且PPARγ、C/EBPα、LPL 和ADPN 的表达模式与脂肪前体细胞成脂诱导一致。Chen 等[33]从约克夏猪和长白猪的半腱肌分离出成熟脂肪细胞,去分化后接种于完全培养基中,在完全培养基中培养16 d,细胞质中脂质含量不断增加,PCR 结果显示C/EBPα、PPARγ、FABP4和FASN的表达量显著升高,提示猪DFAT 细胞可以在体外自发再分化为成熟脂肪细胞。
5 小结与展望
目前,针对脂肪细胞去分化的研究大多集中在临床医学上(如皮肤愈合和再生、癌症的发展、许多其他病理条件下),然而关于如何利用成熟脂肪细胞的去分化能力增加特定组织的脂肪沉积(如肌内脂肪等)却研究甚少。因此,脂肪细胞去分化的靶向调控是提高肉品质的新途径。尽管目前对脂肪细胞去分化的调控机制有初步认识,但仍有许多科学问题值得探究:①触发成熟脂肪细胞去分化的核心调节网络是什么?②不同部位成熟脂肪细胞的去分化能力是否一致?③不同脂肪组织源性的DFAT 细胞的再分化潜能和多向性是否存在差异?④DFAT 细胞重新进入成脂分化过程的启动机制和前体脂肪细胞分化机制是否一致?⑤是否可以利用营养策略调控体内脂肪细胞去分化进而改善猪胴体性状和肉品质?因此,关于脂肪细胞去分化的调控机制仍需深入研究,进而为脂肪细胞生物学的研究以及畜牧生产和人类机体健康调控提供理论和实践依据。

