壳寡糖对三氧化二砷致大鼠肝细胞毒性的保护作用
郑雯静,杨靖亚,刘克海
壳寡糖对三氧化二砷致大鼠肝细胞毒性的保护作用
郑雯静,杨靖亚*,刘克海
(上海海洋大学食品学院,上海 201306)
为研究壳寡糖(COS)对三氧化二砷(ATO)致大鼠正常肝细胞(BRL-3A)毒性的保护作用,测定三氧化二砷和壳寡糖对BRL-3A细胞的增殖抑制率、三氧化二砷诱导壳寡糖预处理BRL-3A细胞的细胞存活率、细胞内乳酸脱氢酶(LDH)水平、丙二醛(MDA)、谷胱甘肽S-转移酶(GST)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和线粒体膜电位(MMP)的变化。结果表明,三氧化二砷对BRL-3A细胞的半数抑制浓度(IC50)为19.8 μmol·L-1,壳寡糖浓度低于230 μmol·L-1时对细胞并未产生损伤。壳寡糖预处理BRL-3A细胞24 h,三氧化二砷再处理细胞24 h,通过检测以上指标表明壳寡糖预处理能够降低LDH水平至176.23% ± 5.87%,从而降低三氧化二砷引起的细胞毒性;壳寡糖可显著抑制三氧化二砷引起的脂质过氧化对机体造成的损伤作用,MDA相对释放含量降低至191.91%± 2.89%;壳寡糖显著提高了抗氧化酶GST、SOD和CAT的活性,分别提高至86.20% ± 1.41%、90.09% ± 1.33%和61.29% ± 0.21%,提高细胞的抗氧化能力,降低三氧化二砷引起的细胞氧化应激损伤;壳寡糖预处理可减缓三氧化二砷引起的线粒体膜电位的降低,降低三氧化二砷对细胞的线粒体产生的伤害。壳寡糖对三氧化二砷引起的大鼠肝细胞的细胞毒性损伤起到了有效地保护作用。
壳寡糖;三氧化二砷;细胞毒性;氧化损伤;保护作用
壳寡糖(Chitosan oligosaccharide,COS)是壳聚糖的降解后的产物,又名β-1,4-寡糖-葡萄糖胺,是不同寡糖的混合物[1]。COS因具有强于壳聚糖的溶解性、抗氧化性和免疫作用等而受到广泛关注。COS的抗氧化活性在体内外得到证实,COS可逆转LPS诱导的GSH活性、降低CAT活性和升高MDA水平[2]。
砷是土壤和水中的天然成分,是众所周知的人类致癌物[3]。长期燃烧含砷的煤取暖或者饮用含砷的水源,是生活中导致砷中毒的主要原因[4]。三氧化二砷是剧毒药品,因其安全剂量到中毒剂量之间的剂量差值较小,导致作为药物时会产生较多不良反应,大大限制了其临床应用[5]。
氧化应激是因氧化作用和抗氧化作用失去平衡导致生化生理发生异常。砷中毒的作用机制包括氧化还原代谢失衡。砷作用后产生过量的氧化物引起抗氧化酶(GST、SOD和CAT等)活力降低[6]。有研究表明,ATO诱导的细胞凋亡与活性氧和氧化损伤有关[7]。氧化应激对人体造成很多损伤,这和很多疾病都有很大的关系[8-10]。有研究表明, COS有很好的抗氧化能力[11-13]。通过利用抗氧化剂降低活性氧和氧化损伤,为减轻ATO的毒副作用提供了很大的可能性。
本试验以大鼠正常肝细胞(BRL-3A)作为研究对象,研究ATO对BRL-3A细胞毒性作用和COS对ATO致BRL-3A细胞毒性的保护作用并探讨其可能的作用机制。
1 材料与方法
1.1 材料
BRL-3A细胞购买于中国科学院上海生命科学研究院细胞库;胎牛血清、噻唑蓝(MTT)购于上海仕寰生物科技有限公司;DMEM高糖培养基购于美国Hyclone公司;PBS缓冲液、100×青霉素-链霉素溶液购于生工生物工程(上海)股份有限公司。Western及IP细胞裂解、乳酸脱氢酶(LDH)、丙二醛(MDA)、线粒体膜电位(MMP)购于碧云天生物技术。谷胱甘肽S转移酶(GST)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)购于南京建成生物工程研究所。
二氧化碳培养箱,赛默飞世尔科技有限公司;超净工作台,苏州净化设备有限公司;CT14RD离心机,上海天美生化仪器设备工程有限公司;SYNERGY2酶标仪,美国伯腾仪器有限公司;AE31倒置生物显微镜,麦克奥迪实业集团有限公司;HH-S11-2-S恒温水浴锅,上海新苗医疗器械制造有限公司。
1.2 方法
1.2.1 细胞培养 BRL-3A细胞用DMEM高糖培养基(10%胎牛血清、1%青霉素和1%链霉素)培养于5% CO2、37 ℃的恒温恒湿培养箱中,细胞长满培养皿底部后筛选出生长至80%左右状态良好的细胞,用0.25%胰蛋白酶进行细胞消化,一部分细胞用于后续实验,剩余细胞传代培养。
1.2.2 MTT法测定BRL-3A细胞增殖抑制率 细胞培养操作如1.2.1,细胞于DMEM培养基(5%胎牛血清(体积分数,下同))中吹至均匀单细胞悬液,取密度为每孔5´103个的细胞悬液于96孔板内培养24 h。弃培养基后加入含不同浓度的ATO(0、0.8、4、20、100和500 μmol·L-1)或COS(0、7.812 5、31.25、125、500和2 000 μmol·L-1)培养基培养24 h后,每孔加10 μL MTT溶液,混匀后避光继续培养4 h,弃去96孔板中的液体,加150 μL DMSO于96孔板,在微型振荡器上充分震荡10 min,酶标仪检测吸收光(检测波长:570 nm;参考波长:655 nm)。
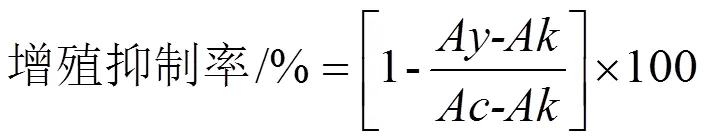
式(1)中:为ATO/COS处理组吸光度;为培养基组吸光度;为无药物处理组吸光度。
1.2.3MTT法测定ATO诱导COS预处理的BRL-3A细胞的细胞存活率细胞铺板操作如1.2.2。培养24 h弃培养基后加入含不同浓度COS(0、25、50、100和200 μmol·L-1)的培养基培养24 h,弃培养基再加入含不同浓度的ATO(0、5、10和 20 μmol·L-1)的培养基继续培养24 h后,每孔加10 μL MTT,轻轻拍打混匀避光继续培养4 h,弃去96孔板中的液体,每孔加150 μL DMSO,在微型振荡器上充分震荡10 min,酶标仪检测吸收光(检测波长为570 nm,参考波长为655 nm)。

式(2)中:为COS预处理ATO再处理组吸光度;为培养基组吸光度;为无药物处理组吸光度。
1.2.4 LDH法测定细胞毒性细胞铺板操作如1.2.3。培养24 h弃培养基后加入含不同浓度COS(0、100和200 μmol·L-1)的培养基继续培养24 h后,弃去培养基再加入含不同浓度ATO(0、5和10 μmol·L-1)的培养基继续培养24 h,于结束培养前1 h取出96孔板并向最大酶活性对照孔中加入100 μL(1´)释放剂,轻晃使其与细胞充分接触继续孵育1 h。结束培养后,根据乳酸脱氢酶(LDH)细胞毒性检测试剂盒的说明书进行操作。
1.2.5 细胞内氧化还原指标的测定 (1)待测蛋白样品的制备及蛋白浓度测定。取密度为每皿1´106个的细胞于10 cm细胞培养皿中培养24 h,弃培养基后加入含不同浓度COS(0、100和200 μmol·L-1)的培养基继续培养24 h后,弃培养基再加入含不同浓度ATO(0、5和10 μmol·L-1)的培养基继续培养24 h,结束培养后在冰上进行操作,根据Western及IP细胞裂解液说明书进行操作,–80℃保存备用。使用考马斯亮蓝法检测蛋白浓度。
(2)细胞内氧化还原指标的测定。根据MDA检测试剂盒、GST活性检测试剂盒、SOD活性检测试剂盒和CAT活性检测试剂盒的说明书进行操作。
1.2.6 JC-1检测细胞中线粒体膜电位(MMP)的变化 取细胞接种于6孔板,密度为1´105个·mL-1,每孔2 mL。培养24 h后弃去培养基加入含不同浓度COS(0、100和200 μmol·L-1)的培养基培养24 h后,弃去培养基再用加入含有不同浓度ATO(0、5和10 μmol·L-1)的培养基继续培养24 h后。按照线粒体膜电位说明书进行操作。
1.2.7 COS预处理对ATO诱导的BRL-3A细胞形态的影响细胞铺板和分组如1.2.6。实验结束后,于倒置显微镜下对各组细胞进行拍照。
1.3 数据处理与统计
数据均表示为“平均值±标准差(Mean ± SD)”;显著性分析采用SPSS统计分析软件进行方差分析。< 0.05表明结果有显著性差异。
2 结果与分析
2.1 ATO对BRL-3A细胞的半数抑制率(IC50)及COS对BRL-3A细胞的无损害作用浓度
ATO的浓度处于0.8 ~ 500 μmol·L-1范围时显著提高BRL-3A细胞的增殖抑制率并表现出良好的剂量-效应关系(表1),由改良寇氏法计算得到三氧化二砷对BRL-3A细胞的半数抑制浓度(IC50)为19.8 μmol·L-1。COS的浓度低于230 μmol·L-1时对细胞增殖无明显抑制作用,而当COS的浓度高于230 μmol·L-1时对细胞的增殖出现抑制作用,具体见表1。
2.2 COS对ATO诱导BRL-3A细胞存活率降低的影响
如图1所示,低浓度的COS(25、50、100和200 μmol·L-1)单独作用于BRL-3A细胞时,对细胞的存活率无显著影响。ATO单独处理组从5 μmol·L-1浓度开始显著降低细胞存活率。当COS预处理细胞时,升高细胞存活率最佳的是200 μmol·L-1COS处理组,可将5、10和20 μmol·L-1ATO单独处理的细胞存活率由73.76%±1.08%、63.68%±1.02%、12.68%±1.02%分别显著提高到83.98%±1.08%、84.54%±1.02%和38.39%±6.31%。因此,COS预处理BRL-3A细胞24 h后,可以减轻ATO对BRL-3A细胞产生的毒性作用。

表1 ATO/COS作用于BRL-3A细胞24 h对细胞增殖抑制率的影响

“*”表示ATO浓度相同时,COS预处理组与无COS处理组相比差异显著,P < 0.05;“#”表示COS预处理浓度相同时,ATO处理组与无ATO处理组相比差异显著,P < 0.05。
Figure 1 Effect of COS pretreatment on BRL-3A cells viability induced by ATO
2.3 COS预处理对细胞内LDH水平的影响
如图2所示,COS单独处理组与对照组相比细胞释放LDH水平无明显差异,而ATO(5 和10 μmol·L-1)单独处理细胞24 h后显著提高细胞释放LDH水平,分别提高至129.06%±7.47%和228.30%±18.68%。COS预处理BRL-3A细胞24 h后ATO再处理24 h,显著降低细胞释放的LDH水平。当100 μmol·L-1COS预处理时,细胞释放的LDH水平分别显著降低至109.43% ± 1.00%(5 μmol·L-1ATO)和174.34% ± 1.50%(10 μmol·L-1ATO)。当200 μmol·L-1COS预处理时,细胞释放的LDH水平分别显著降低至109.06% ± 0.53%(5 μmol·L-1ATO)和176.23% ± 5.87%(10 μmol·L-1ATO)。COS预处理效果均较好,均降低了ATO引起的LDH水平升高。说明COS可降低ATO引起的LDH水平升高从而对ATO致细胞毒性产生保护作用。

不同字母表示差异显著,P < 0.05。下同。
Figure 2 Effect of COS pretreatment on the release of LDH of BRL-3A cells induced by ATO

图3 COS预处理对ATO引起的BRL-3A细胞内脂质过氧化的影响
Figure 3 Effect of COS pretreatment on ATO-induced lipid peroxidation in BRL-3A cells
2.4 COS预处理对细胞内MDA含量的影响
如图3所示,COS单独处理组与对照组相比MDA含量无显著性差异,而ATO(5 和10 μmol·L-1)单独处理细胞后细胞内的MDA相对含量显著升高,其含量分别为180.09%±10.05%和302.61%± 11.98%。当100 μmol·L-1COS预处理时,细胞内的MDA相对含量显著降低,可将MDA含量由180.09%±10.05%降低到146.51%±7.36%,将302.61%±11.98%降低到214.06%±8.77%。当200 μmol·L-1COS预处理时,可将MDA含量由180.09%±10.05%降低到145.08%±7.11%,由302.61%±11.98%降低到191.91%±2.89%。说明COS可抑制ATO引起的脂质过氧化对BRL-3A细胞产生的损伤,从而达到保护作用。
2.5 COS预处理对细胞内氧化还原平衡的影响
如图4所示,COS单独处理组与对照组相比抗氧化体系无显著性差异,而ATO(5 和10 μmol·L-1)单独处理细胞后可显著降低细胞内的GST、SOD和CAT的活性。ATO(5 和10 μmol·L-1)单独处理时细胞内GST相对活性分别为71.06%±1.32%、55.06%±1.88%。当100 μmol·L-1COS预处理时,细胞内的GST相对活性显著升高至69.38%±1.66%(10 μmol·L-1ATO)。当200 μmol·L-1COS预处理时,细胞内的GST相对活性分别显著升高至85.32%± 1.66%(5 μmol·L-1ATO)和86.20%±1.41%(10 μmol·L-1ATO)(图4(a))。当100 μmol·L-1COS预处理时,细胞内的SOD相对活性由75.11%±11.04%(5 μmol·L-1ATO)显著升高至90.09%±1.33%。(图4(b))。ATO(5 μmol·L-1和10 μmol·L-1)单独处理时细胞内CAT相对活性分别为51.44%±0.31%和51.94%± 0.27%。当100 μmol·L-1COS预处理时,细胞内的CAT相对活性分别显著升高至61.58%±0.42%(5 μmol·L-1ATO)和57.95%±0.15%(10 μmol·L-1ATO)。当200 μmol·L-1COS预处理时,细胞内的CAT相对活性分别显著升高至61.55%±0.33%(5 μmol·L-1ATO)和61.29% ± 0.21%(10 μmol·L-1ATO)(图4(c))。
COS处理组(100 和200 μmol·L-1)均可以提高ATO诱导的GST、SOD和CAT活性。由图4可知,200 μmol·L-1COS预处理效果相对比较好。研究结果表明COS预处理可显著增强抗氧化酶GST、SOD和CAT的活性和细胞抗氧化能力。COS对ATO引起的细胞氧化应激损伤起到了有效的保护作用,使细胞回归于平衡的氧化还原状态。
2.6 COS预处理对ATO引起的BRL-3A细胞线粒体膜电位变化的影响
如图5所示,COS单独处理组与对照组相比红绿荧光强度比值无明显差异,即线粒体膜电位不受壳寡糖影响。ATO(5 和10 μmol·L-1)单独处理组使得红绿荧光强度比值有显著的降低,即线粒体膜电位下降。COS预处理后可显著提高红绿荧光强度比值,说明COS预处理可显著提高ATO导致的MMP降低,从而降低ATO对线粒体产生的伤害。
2.7 COS预处理对ATO诱导的BRL-3A细胞形态的影响
如图6所示,COS单独处理组细胞的密度和细胞形态均正常,呈贴壁生长状态、多边形或梭形、细胞形态饱满。ATO单独处理时,随着ATO浓度升高而细胞密度降低,且呈椭圆形的细胞量增多。当100 μmol·L-1COS和200 μmol·L-1COS预处理时,能够有效减轻ATO导致的细胞密度下降并改善细胞的形态。

图4 COS预处理对BRL-3A细胞内抗氧化体系的影响
Figure 4 Effect of COS pretreatment on antioxidant system in BRL-3A cells

图5 COS预处理对ATO引起BRL-3A细胞内线粒体膜电位变化的影响
Figure 5 Effect of COS pretreatment on changes of mitochondrial membrane potential induced by ATO in BRL-3A cells

图6 COS预处理对ATO诱导的BRL-3A细胞形态的影响
Figure 6 Effect of COS pretreatment on changes of morphological induced by ATO in BRL-3A cells
3 讨论与结论
研究壳寡糖对三氧化二砷致BRL-3A细胞毒性的保护作用并探讨其机制。BRL-3A细胞产生的氧化应激反应引起细胞凋亡,这可能是导致三氧化二砷对BRL-3A细胞产生毒性的重要原因。壳寡糖可以通过平衡细胞原有的抗氧化防御体系来降低细胞死亡率,从而显著地降低三氧化二砷产生的毒性,这可能与提高细胞内抗氧化酶活性和降低脂质过氧化有关。
乳酸脱氢酶释放被看作一种细胞膜体系完整性的重要指标,正常生理条件下,LDH是存在于胞浆内不能穿过细胞膜;当细胞发生凋亡或坏死时,细胞浆内的LDH释放到培养基里,导致产生细胞毒性[14]。本实验结果表明,100和200 μmol·L-1壳寡糖预处理可降低三氧化二砷引起的细胞LDH水平的升高,说明壳寡糖能降低三氧化二砷引起的LDH释放。丙二醛(MDA)是脂质过氧化的最终产物,当细胞发生氧化应激而产生脂质氧化时,MDA水平便会升高,MDA被广泛用作氧化应激的标志[13, 15]。本试验结果表明,100和200 μmol·L-1壳寡糖预处理可降低三氧化二砷引起的脂质氧化产生的MDA的水平升高,说明壳寡糖能有效抑制三氧化二砷引起脂质过氧化对机体造成的损害作用。氧化应激是由过多的氧化自由基引起的,这些自由基直接与生物分子反应,破坏脂质、蛋白质、DNA及细胞结构和功能,导致细胞或器官损伤[16-17]。当细胞受损时,原本稳定的氧化还原体系就会发生改变。超氧化物歧化酶、过氧化氢酶和谷胱甘肽S转移酶是细胞内重要的抗氧化酶类[18]。100和200 μmol·L-1壳寡糖预处理均可以升高三氧化二砷诱导的GST、SOD和CAT活性。壳寡糖预处理能显著提高抗氧化酶GST、SOD和CAT的活性从而提高细胞的抗氧化能力。在一定程度上,壳寡糖对三氧化二砷引起的细胞氧化应激损伤起到了有效的保护作用并使细胞处于平衡的氧化还原状态。结果表明:100和200 μmol·L-1的壳寡糖对5和10 μmol·L-1三氧化二砷引起的BRL-3A细胞毒性有显著的保护作用。线粒体膜通透性的转变是细胞凋亡的早期迹象。凋亡中的线粒体功能障碍与线粒体膜对大分子(包括与凋亡过程相关的离子)的特殊通透性有关。线粒体膜电位下降表明细胞凋亡可以通过一种独特的荧光阳离子染料JC-1来检测[19]。壳寡糖预处理可显著升高三氧化二砷引起的线粒体膜电位的降低,从而减轻三氧化二砷对线粒体造成的伤害,降低细胞凋亡率。壳寡糖预处理能够有效减轻三氧化二砷导致的细胞密度下降并改善细胞形态。
综上所述,壳寡糖能够显著减轻三氧化二砷对大鼠肝细胞造成的细胞毒性,这可能与壳寡糖提高细胞本身抗氧化能力有关。本研究对于壳寡糖和三氧化二砷联合使用以减轻三氧化二砷的毒性提供了依据,具有一定的理论价值和实际意义。
[1] FANG I M, YANG C M, YANG C H. Chitosan oligosaccharides prevented retinal ischemia and reperfusion injury via reduced oxidative stress and inflammation in rats[J]. Exp Eye Res, 2015, 130: 38-50.
[2] LI X C, DING X M, PENG X, et al. Effect of chitosan oligosaccharides on antioxidant function, lymphocyte cycle and apoptosis in ileum mucosa of broiler[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2017, 23(4): 571-577.
[3] WANG Z X, JIANG C S, LIU L, et al. The role of Akt on arsenic trioxide suppression of 3T3-L1 preadipocyte differentiation[J]. Cell Res, 2005, 15(5): 379-386.
[4] 王晨璐. 砷暴露致肝纤维化系统评价及差异蛋白组学分析[D]. 乌鲁木齐: 新疆医科大学, 2017.
[5] 刘建群, 彭财英, 舒积成, 等. 南天竹提取物对三氧化二砷致肝毒性的保护作用[J].时珍国医国药, 2015, 26(4): 772-773.
[6] 张爱君. 砷中毒对抗氧化酶系统的影响[J].中国地方病防治杂志, 2014, 29(1): 21-24.
[7] CHEN C, JIANG X, LAI Y, et al. Resveratrol protects against arsenic trioxide-induced oxidative damage through maintenance of glutathione homeostasis and inhibition of apoptotic progression[J]. Environ Mol Mutagen, 2015, 56(3): 333-346.
[8] JOMOVA K, VALKO M. Advances in metal-induced oxidative stress and human disease[J]. Toxicology, 2011, 283(2/3): 65-87.
[9] LI L, LI W, JUNG S W, et al. Protective effects of decursin and decursinol angelate against amyloid β-protein-induced oxidative stress in the PC12 cell line: the role of Nrf2 and antioxidant enzymes[J]. Biosci Biotechnol Biochem, 2011, 75(3): 434-442.
[10] LEE S, PARK Y, ZUIDEMA M Y, et al. Effects of interventions on oxidative stress and inflammation of cardiovascular diseases[J]. World J Cardiol, 2011, 3(1): 18-24.
[11] LIU H T, LI W M, XU G, et al. Chitosan oligosaccharides attenuate hydrogen peroxide-induced stress injury in human umbilical vein endothelial cells[J]. Pharmacol Res, 2009, 59(3): 167-175.
[12] XU Q, MA P, YU W, et al. Chitooligosaccharides protect human embryonic hepatocytes against oxidative stress induced by hydrogen peroxide[J]. Mar Biotechnol(NY), 2010, 12(3): 292-298.
[13] QIAO Y, BAI X F, DU Y G. Chitosan oligosaccharides protect mice from LPS challenge by attenuation of inflammation and oxidative stress[J]. Int Immunopharmacol, 2011, 11(1): 121-127.
[14] DAI X, CHANG P, ZHU Q, et al. Chitosan oligosaccharides protect rat primary hippocampal neurons from oligomeric β-amyloid 1-42-induced neurotoxicity[J]. Neurosci Lett, 2013, 554: 64-69.
[15] LAN R X, LI S Q, CHANG Q Q, et al. Chitosan oligosaccharides protect sprague dawley rats from cyclic heat stress by attenuation of oxidative and inflammation stress[J]. Animals (Basel), 2019, 9(12): E1074.
[16] LAN R X, CHANG Q Q, AN L L, et al. Dietary supplementation with chitosan oligosaccharides alleviates oxidative stress in rats challenged with hydrogen peroxide[J]. Animals (Basel), 2019, 10(1): E55.
[17] SNEZHKINA A V, KUDRYAVTSEVA A V, KARDYMON O L, et al. ROS generation and antioxidant defense systems in normal and malignant cells[J]. Oxid Med Cell Longev, 2019, 2019: 6175804.
[18] LÜ J M, LIN P H, YAO Q, et al. Chemical and molecular mechanisms of antioxidants: experimental approaches and model systems[J]. J Cell Mol Med, 2010, 14(4): 840-860.
[19] SALIDO M, GONZALEZ J L, VILCHES J. Loss of mitochondrial membrane potential is inhibited by bombesin in etoposide-induced apoptosis in PC-3 prostate carcinoma cells[J]. Mol Cancer Ther, 2007, 6(4): 1292-1299.
Protective effect of chitosan oligosaccharide against the toxicity of arsenic trioxide toward Buffalo rat liver cells
ZHENG Wenjing, YANG Jingya, LIU Kehai
(College of Food Sciences & Technology, Shanghai Ocean University, Shanghai 201306)
To study the protective effect of chitosan oligosaccharide (COS) against the toxicity of arsenic trioxide (ATO) toward normal Buffalo rat liver cells (BRL-3A), we determined the proliferation inhibition rate of BRL-3A cells induced by arsenic trioxide and chitosan oligosaccharide, cell survival rate of BRL-3A cells pretreated with chitosan oligosaccharides induced by arsenic trioxide, lactate dehydrogenase (LDH) release, malondialdehyde (MDA) assay, glutathione s-transferase (GST) activity, superoxide dismutase (SOD) activity, catalase (CAT) activity and mitochondrial membrane potential (MMP). The results showed that the IC50of ATO to BRL-3A cells was 19.8 μmol·L-1, while COS did not cause damage when it was below 230 μmol·L-1. BRL-3A cells were pretreated with COS for 24 h, and then ATO was applied to the cells for another 24 h. Through the detection of LDH, MDA, GST, SOD, CAT and MMP, COS pretreatment could reduce the level of LDH release to 176.23% ± 5.87% induced by ATO, thus reduced the cytotoxicity induced by ATO; COS could effectively inhibit the damage caused by ATO-induced lipid peroxidation, and relative release content of MDA decreased to 191.91% ± 2.89%; COS could significantly increase the activities of antioxidant enzymes GST, SOD and CAT, increased to 86.20% ±1.41%, 90.09% ±1.33% and 61.29% ±0.21%, respectively, improve the antioxidant capacity and defense ability of cells, and reduce the oxidative stress damage induced by ATO; COS pretreatment could inhibit the decrease of mitochondrial membrane potential induced by ATO and reduce the damage of ATO to mitochondria; COS pretreatment could retard the decrease of mitochondrial membrane potential induced by arsenic trioxide and reduce the mitochondrial damage caused by arsenic trioxide. Therefore, chitosan oligosaccharide has a certain protective effect on the toxic damage of BRL-3A induced by arsenic trioxide.
chitosan oligosaccharide; arsenic trioxide; cytotoxicity; oxidative damage; protective effect
S865.127
A
1672-352X (2021)03-0412-06
10.13610/j.cnki.1672-352x.20210706.021
2021-7-7 10:34:33
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1659.042.html
2020-08-15
国家自然科学基金( 81572989)资助。
郑雯静,硕士研究生。E-mail:zheng_wenjing@126.com
杨靖亚, 副教授。E-mail:jyyang@shou.cn

