水稻稻瘟病拮抗稀有放线菌的筛选及防治效果
阮宏椿,石妞妞,杜宜新,陈福如
(福建省作物有害生物监测与治理重点实验室/福建省农业科学院植物保护研究所,福州 350013)
由稻瘟病菌Magnaportheoryzae引起的稻瘟病(rice blast)是一种重要的水稻真菌病害,可引起水稻大幅减产,甚至颗粒无收。据统计,每年由稻瘟病引起的水稻减产可达10%~30%,损失的稻米足以养活超过6000万人[1]。目前,防治稻瘟病的主要措施包括选育种植抗病品种和化学药剂防治,而抗病品种由于病原菌群体的遗传变异速度较快而丧失抗性,化学药剂防治具有防效高、成本低、操作方便等优点,是防治稻瘟病的有效方法,但也存在病原菌抗药性、农产品农药残留、环境污染等问题[2-4]。因此,利用生物或其代谢产物防治稻瘟病具有环境友好、残留低、不易使病原菌产生抗药性等优点[5,6]。随着人们生活水平逐步提高,环境保护意识逐渐增强,生物防治已成为植物病害防治研究的一个重要方向。
近年来,生防菌及其代谢产物防治稻瘟病研究取得了一定的进展。常用于水稻稻瘟病生防的微生物主要有真菌、细菌(放线菌)[7]。放线菌中产色链霉菌Streptomycesgriseochromogenes产生的灭瘟素−S[8]、春日链霉菌S.kasugaensis产生的春雷霉素[9]已用于稻瘟病防治。另有研究表明,娄彻氏链霉菌S.rochei[10]、灰色链霉菌S.griseus[11]、吸水链霉菌S.hygroscopicus[12]对稻瘟病菌也有较好的抑制作用。王栋等[13]从云南分离到的抗菌高丽菌Kribbellaantibioticasp.nov.对灰霉病、稻纹枯病、稻瘟病具有较强防治作用。链霉菌UPMRS4对稻瘟病菌菌丝生长抑制率达98.32%,孢子悬浮液浸种可降低67.9%的发病率[14]。涂链霉菌OsiSH−2对稻瘟病菌菌丝生长抑制率达75.3%,孢子悬浮液喷洒叶片可将自然发病的稻瘟病发病程度降低59.64%[15]。放线菌是极具代谢多样性的微生物,世界上已发现的抗生素约有2/3是由放线菌产生的[16]。随着分离方法的不断改进,那些传统分离方法难以分离到的稀有放线菌被开发利用,近年来从稀有放线菌中的游动放线菌属Actinoplanes、小双孢菌属Microbispora、拟无枝菌酸菌属Amycolatopsis、糖多孢菌属Saccharopolyspora发现了多种抗生素[17]。研究表明,药用植物根际的微生物,长期受药用植物根系分泌物质的影响,其产生生物活性物质的比例也显著高于其他植物根际土壤微生物[18]。南方红豆杉Taxuschinensisvar.mairei是一种非常重要的药用植物资源,含有抗癌物质紫杉醇[19]。张盼盼等[20]从红豆杉植株和根际土壤中分离到111株放线菌,其中33株具有抑菌活性。因此,从红豆杉根际土壤分离的稀有放线菌中筛选出对水稻稻瘟病有良好抑菌效果的拮抗菌株,对开展水稻稻瘟病生物防治具有重要的意义。
本研究以水稻稻瘟病菌为靶标菌,从红豆杉根际土壤中分离筛选稀有放线菌菌株,通过形态特征观察、生理生化测定和16S rRNA、recA、gyrB和rpoB基因序列分析进行菌株鉴定,并进行防效测定。研究结果可为水稻稻瘟病的生物防治提供新的生防资源,为进一步在生产上应用提供参考。
1 材料与方法
1.1 供试材料
土壤样本:江西井冈山(北纬26°74′80″,东经114°28′92″)红豆杉根际周围,去除表面的土壤,采集5~20 cm深处的土壤样品,自然风干后,于4 ℃冰箱保存。
靶标病原真菌:水稻稻瘟病菌M.oryzae、大豆炭疽病菌Colletotrichumtruncatum、芦笋茎枯病菌Phomopsisasparagi、水稻稻曲病菌Ustilaginoideavirens、蘑菇褐腐病菌Mycogoneperniciosa由福建省农业科学院植物保护研究所分离、鉴定并保存。
供试水稻品种:广陆矮4号、甬优9号。
供试药剂:75%三环唑可湿性粉剂,由江苏丰登作物保护股份有限公司生产。
培养基:放线菌分离培养基为改良的HVA培养基[21](淀粉2 g,KNO30.5 g,KCl 1.7g,MgSO4·7H2O 0.5 g,Na2HPO40.5 g,CaCO30.02 g,FeSO4·7H2O 0.01 g,硫胺素0.5 mg,烟酸0.5 mg,泛酸0.5 mg,对−氨基苯甲酸0.5 mg,核黄素0.5 mg,维生素B6 0.5 mg,肌醇0.5 mg,生物素0.25 mg,琼脂18 g,蒸馏水1000 mL,pH 7.2,加入终浓度为100 ppm的重铬酸钾);靶标病原真菌培养基为PDA培养基;放线菌鉴定培养基为察氏培养基、葡萄糖天冬素培养基、甘油天冬素培养基、无机盐淀粉培养基、ISP−2培养基、燕麦粉培养基、高氏一号培养基、桑塔氏培养基、明胶液化培养基、牛奶的凝固与胨化培养基、淀粉水解琼脂培养基、硝酸盐还原培养基,碳、氮源利用基础培养基[22]。
1.2 放线菌的分离纯化
采用平板稀释法分离土壤中的放线菌[23]。将土样用研钵磨碎,称取样品1 g悬浮于9 mL无菌水中,于摇床中40 ℃、180 r/min振荡培养30 min后静置5 min,依次稀释10倍,分别配制成10−2、10−3、10−4的悬浮液,分别吸取不同浓度的悬浮液各0.1 mL加入到改良的HVA培养基(加入终浓度为100 ppm的重铬酸钾)平板上,均匀涂布后倒置于培养箱中,28 ℃培养,5 d后挑取不同的单菌落划线纯化,纯化后的菌株采用甘油法保藏于−80 ℃冰箱。
1.3 拮抗放线菌的筛选
以水稻稻瘟病菌为靶标菌,采用平板对峙法[24],对分离到的放线菌进行初筛。将放线菌在PDA培养基靠边缘两侧划线接种,3 d后在平板中央接入直径5 mm的水稻稻瘟病菌菌饼,以不接放线菌为空白对照,3次重复,28 ℃倒置培养,7 d后测量菌落直径和抑菌带宽度。选择抑菌带宽,抑菌活性强且长势旺的菌株进行抑菌谱测定。
1.4 拮抗放线菌ST7-2抑菌谱
拮抗放线菌ST7−2接入ISP2液体培养基中,装液量为80 mL/250 mL三角瓶,接种量5%,置于25 ℃、180 r/min摇床中振荡培养7 d得发酵液,于4 ℃、10000 r/min冷冻离心机中离心10 min,取上清用22 µm微孔滤膜过滤得无菌发酵滤液,备用。参考姚锦爱等[25]方法,测定拮抗放线菌ST7−2对水稻稻瘟病菌、水稻稻曲病菌、芦笋茎枯病菌、大豆炭疽病菌、蘑菇褐腐病菌的抑制效果。将无菌发酵滤液10 mL加入到90 mL的PDA培养基中,混合后倒入培养皿中,在平板中央接入直径5 mm的病原菌菌饼。28 ℃培养7 d后,测量菌落生长直径,以PDA培养基为对照,重复3次,计算拮抗放线菌ST7−2无菌发酵滤液对病原菌菌丝生长的抑制率。抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
1.5 拮抗放线菌ST7-2的鉴定
1.5.1 拮抗放线菌ST7−2形态学观察 采用插片法[26],将拮抗放线菌ST7−2划线接种于察氏培养基、葡萄糖天冬素培养基、甘油天冬素培养基、无机盐淀粉培养基、ISP−2培养基、燕麦粉培养基、高氏一号培养基、桑塔氏培养基上,置于28 ℃下培养,7 d后观察有无基内菌丝及菌丝颜色,可溶性色素,菌落生长情况,观察有无气生菌丝及菌丝形态。
1.5.2 拮抗放线菌ST7−2生理生化特征 参照《链霉菌鉴定手册》[23]的方法,测定拮抗放线菌ST7−2明胶液化、牛奶的凝固与胨化、淀粉水解、硝酸盐还原及碳、氮源的利用等生理生化特征。
1.5.3 拮抗放线菌ST7−2的分子鉴定 用细菌基因组DNA快速提取试剂盒(天根生化科技(北京)有限公司)提取拮抗放线菌ST7−2的DNA。扩增16S rRNA、recA基因[27]、gyrB基因[28]和rpoB基因[29],与NCBI数据库中的序列进行Blast比对,利用MEGA 7软件构建系统发育进化树。
1.6 拮抗放线菌ST7-2对水稻稻瘟病的防效
1.6.1 室内防效测定 以水稻稻瘟病菌为靶标菌,开展室内苗期防效测定,参照杜宜新等[30]方法。将广陆矮4号水稻种子播种于25 cm×50 cm育秧盘内,稻瘟病菌分生孢子配制成1×105孢子/mL的悬浮液,备用。试验设接种水稻稻瘟病菌+无菌水、接种水稻稻瘟病菌+拮抗放线菌ST7−2发酵液、接种水稻稻瘟病菌+拮抗放线菌ST7−2发酵液10倍稀释液、接种水稻稻瘟病菌+75%三环唑WP1700倍液4个处理,每处理1盘,3次重复;水稻3叶1心期,喷雾接种水稻稻瘟病菌,每处理10 mL,2 h后再进行分组均匀喷施,处理1喷无菌水50 mL,处理2喷拮抗放线菌ST7−2发酵液50 mL,处理3喷拮抗放线菌ST7−2发酵液10倍稀释液50 mL,处理4喷75%三环唑WP 1700倍液50 mL,用塑料膜遮盖保湿,并用遮光布覆盖,24 h后去除遮光布和塑料膜,在25 ℃~28 ℃温室内保湿6 d,参照石妞妞等[31]的标准调查发病情况,每处理调查50株,计算病情指数和防治效果。
1.6.2 田间防效测定 在福建省南平市建阳区水稻种植基地(东经 117°90′14″,北纬 27°36′50″),常年稻瘟病重病田块,水稻品种为甬优9号。试验设无菌水、拮抗放线菌ST7−2发酵液、拮抗放线菌ST7−2发酵液10倍稀释液、75%三环唑WP1700倍液、4个处理,3次重复,共计12个小区,随机排列,每小区30 m2,每小区用药量2000 mL。于水稻破口期开始喷雾处理,7 d后,各小区均重复喷施1次;于水稻蜡熟期,采用5点取样法,每个小区调查50穗,参照GB/T 17980.19—2000《农药田间药效试验准则(一)》[32]调查穗瘟的病情,并计算病情指数和防治效果。
1.7 数据统计与分析
利用Excel 2007、SPSS软件进行数据统计分析,采用LSD多重比较法进行差异性检验。
2 结果与分析
2.1 放线菌分离和拮抗菌筛选
从供试土壤样品中分离获得11株具有抗菌活性的放线菌,ST2−6、ST7−2和ST8−4 3株放线菌对水稻稻瘟病菌抑菌带宽度大于10 mm(表1),其中菌株ST7−2抑菌带宽度为17.33 mm,且长势旺,因此,本研究选择ST7−2进行下一步试验(图1)。

表1 11株放线菌对水稻稻瘟病菌的抑菌效果Table 1 The inhibition effect of 11 actinomyces strains on M.oryzae
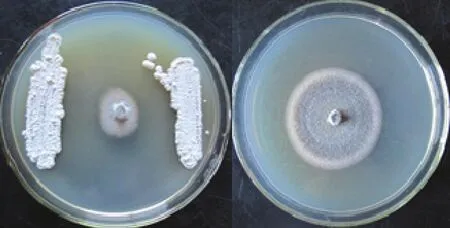
图1 菌株ST7-2 对水稻稻瘟病菌的平板对峙效果Fig.1 Dual culture plates of control and inhibition of M.oryzae by strain ST7-2
2.2 拮抗放线菌ST7-2的抑菌谱
抑菌谱测定结果表明(表2,图2),菌株ST7−2 无菌发酵滤液对供试的5种植物病原真菌都有不同程度的抑制作用,其中对水稻稻曲病菌抑制作用最强,抑制率为76.82%,对芦笋茎枯病菌和水稻稻瘟病菌菌也具有较强的抑制作用,抑制率分别为60.60%和48.11%,对蘑菇褐腐病菌和大豆炭疽病菌的抑制率分别为15.13%和14.94%。
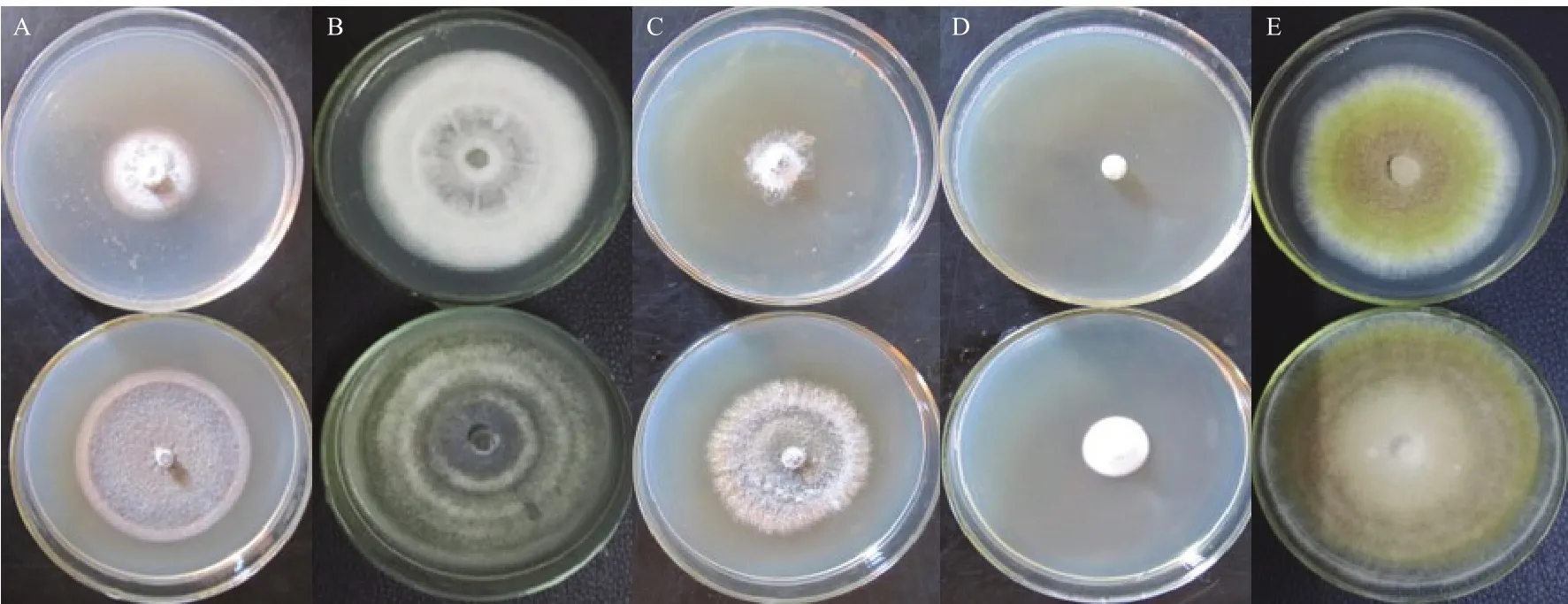
图2 菌株ST7-2无菌发酵滤液对植物病原菌的平板抑制效果Fig.2 Inhibition of mycelia growth of 5 fungal pathogens by sterile fermentation filtrate of strain ST7-2
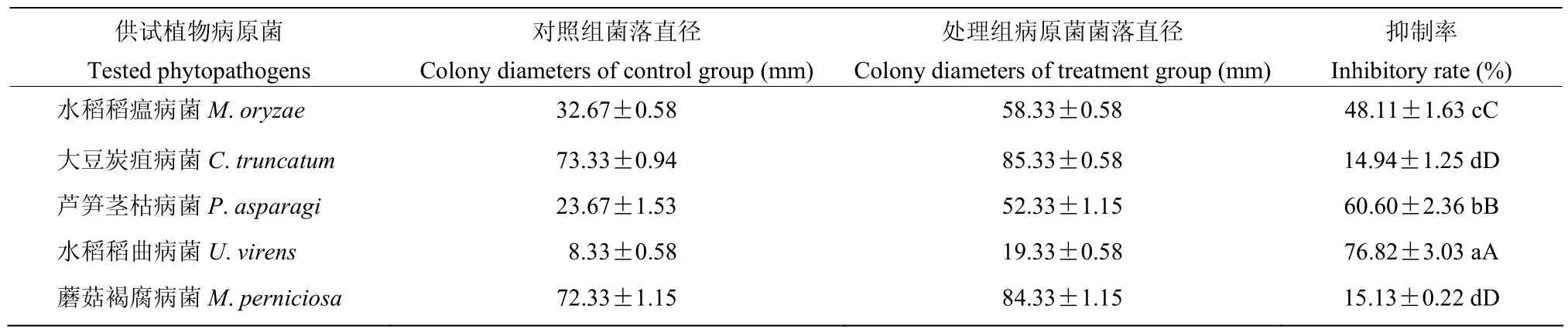
表2 放线菌ST7-2无菌发酵滤液对5种病原菌的抑制作用Table 2 Inhibition of mycelia growth of 5 fungal pathogens by sterile fermentation filtrate of strain ST7-2
2.3 拮抗放线菌ST7-2鉴定
2.3.1 形态特征 ST7−2在高氏一号培养基中菌落灰白色,表面干燥,近圆形,气生菌丝白灰色及乳黄色,基内菌丝酪黄色,孢子丝直、柔曲、钩状、松敞及紧密螺旋形,孢子椭圆形,柱形,无可溶性色素产生(表3);在高氏一号、无机盐淀粉、ISP−2、燕麦粉、桑塔氏培养基上生长良好,在察氏、葡萄糖天冬素、甘油天冬素培养基上生长一般;除在察氏、葡萄糖天冬素培养基上无气生菌丝,在其他培养基上均可产生气生菌丝,气生菌丝量在甘油天冬素培养基上产生较少,在其他培养基上生长茂盛,气生菌丝在各培养基上颜色不一,多为不同深浅的白色或灰色;基内菌丝的颜色也有多种,多为白色、黄色和绿色;在8种培养基中均无可溶性色素产生。
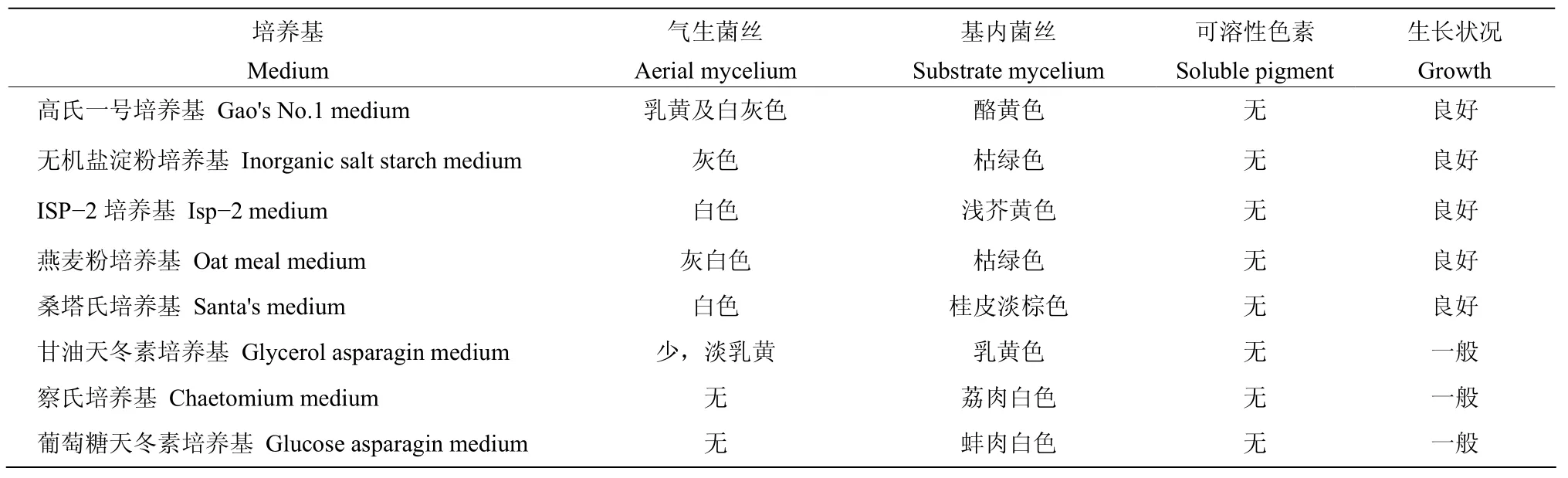
表3 菌株ST7-2在不同培养基上的培养特征Table 3 Culture characters of strain ST7-2 on different media
2.3.2 生理生化特征 生理生化试验结果(表4)表明,菌株ST7−2碳源能利用葡萄糖、甘露糖、甘露醇、乳糖、半乳糖、麦芽糖、蜜二糖、棉籽糖、海藻糖、果糖、核糖、糖原、苦杏仁苷、肌醇、甘油、葡萄糖酸钠,不能利用山梨糖、山梨醇、蔗糖、松三糖、鼠李糖、木糖、菊糖、阿拉伯糖、水杨苷、赤藓醇、苹果酸钠、马尿酸钠、琥珀酸钠;氮源能利用L−脯氨酸,不能利用L−丙氨酸、L−赖氨酸、L−苏氨酸;能凝固、胨化牛奶;硝酸盐还原、明胶液化、酪氨基酸酶、淀粉酶试验均为阴性。结合形态特征观察,初步将菌株ST7−2鉴定为链霉菌属Streptomycessp.。
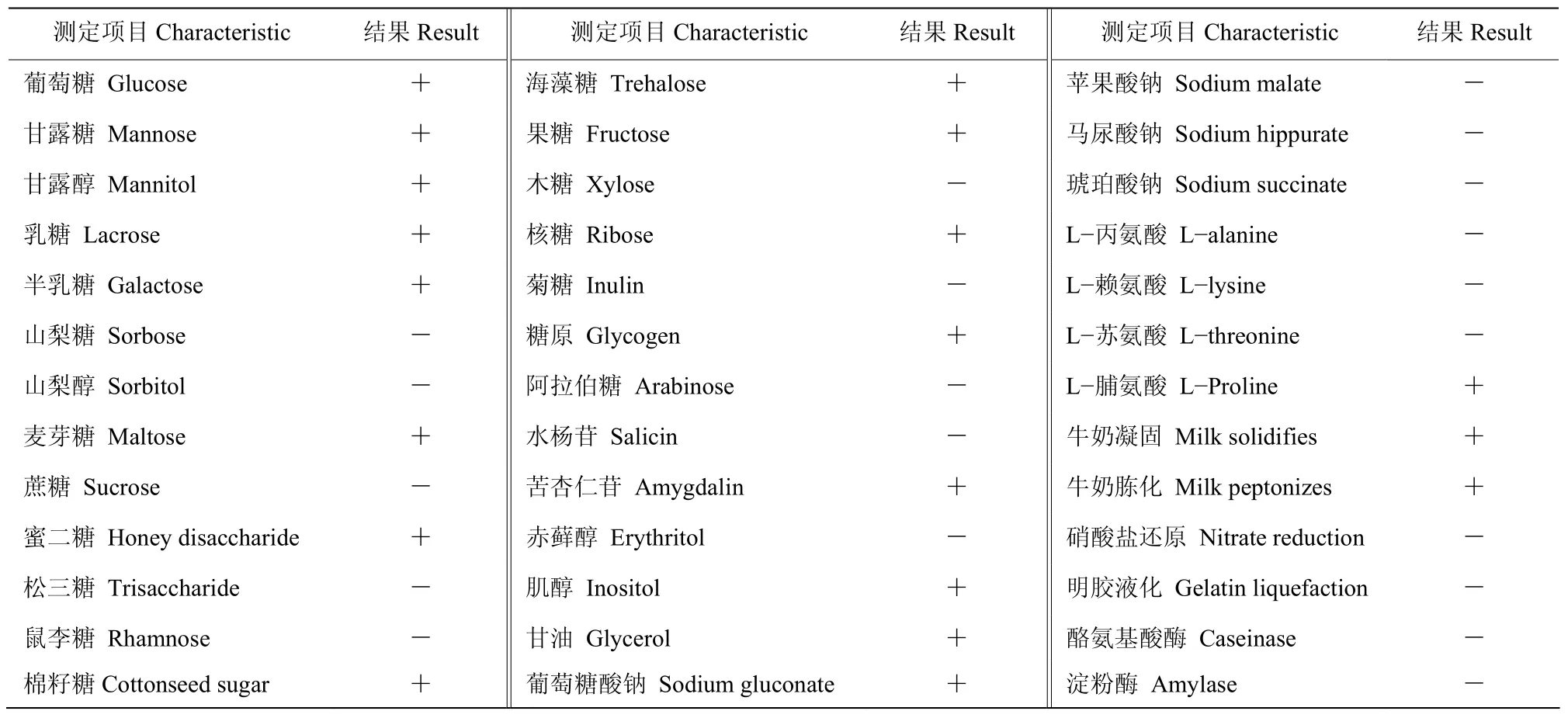
表4 菌株ST7-2的生理生化特征Table 4 Physiological and biochemical characteristics of strain ST7-2
2.3.3 分子鉴定 菌株ST7−2的16S rRNA、recA、gyrB和rpoB基因扩增片段长度分别为1364、806、906和785 bp,提交到Genbank获得的登录号分别为MW067371、MW071166、MW071167和MW071168。同源性比对(图3)发现,菌株ST7−2的16S rRNA序列与利巴尼链霉菌S.libani、吸水链霉菌S.hygroscopicus、杀结节链霉菌S.tubercidicus、黑链霉菌S.nigrescens、狭霉素链霉菌S.angustmyceticus、扁平链霉菌S.platensis、暗黑漆链霉菌S.atrolaccus的相似性达99%以上;recA基因序列与杀结节链霉菌S.tubercidicus的相似性达99.60%;gyrB基因序列与杀结节链霉菌的相似性达100%;rpoB基因序列与杀结节链霉菌的相似性达99.44%;在recA、gyrB、rpoB基因序列系统发育树上,与杀结节链霉菌聚为一簇。结合形态和生理生化特征,最终确定ST7−2为杀结节链霉菌。

图3 基于16S rRNA (A)、recA (B)、gyrB (C)和rpoB (D)构建菌株ST7-2的系统发育树Fig.3 Phylogenetic tree of strain ST7-2 based on the sequence of 16S rRNA (A), recA (B), gyrB (C) and rpoB (D)
2.4 拮抗放线菌ST7-2的防治效果测定
2.4.1 室内防效 室内苗期防效测定结果表明,菌株ST7−2发酵液及其10倍稀释液能有效降低水稻稻瘟病菌的病情指数,其防治效果分别为82.76%和62.94%。菌株ST7−2发酵液处理和75%三环唑WP 1700倍液处理组的防治效果分别为82.76%和81.01%,无显著差异(表5,图4)。
2.4.2 田间防效 清水对照处理的水稻穗瘟病情指数15.41,而菌株ST7−2发酵液和75%三环唑WP处理的穗瘟病情指数明显减轻,病情指数为2.96~4.07;菌株ST7−2发酵液10倍液防治效果较低,仅为40.86%;菌株ST7−2发酵液处理防治效果为73.57%,低于75%三环唑WP 1700倍液的防治效果(表5,图4)。

图4 菌株ST7-2对水稻稻瘟病的室内防治效果Fig.4 Control effects of strain ST7-2 on rice blast in the lib
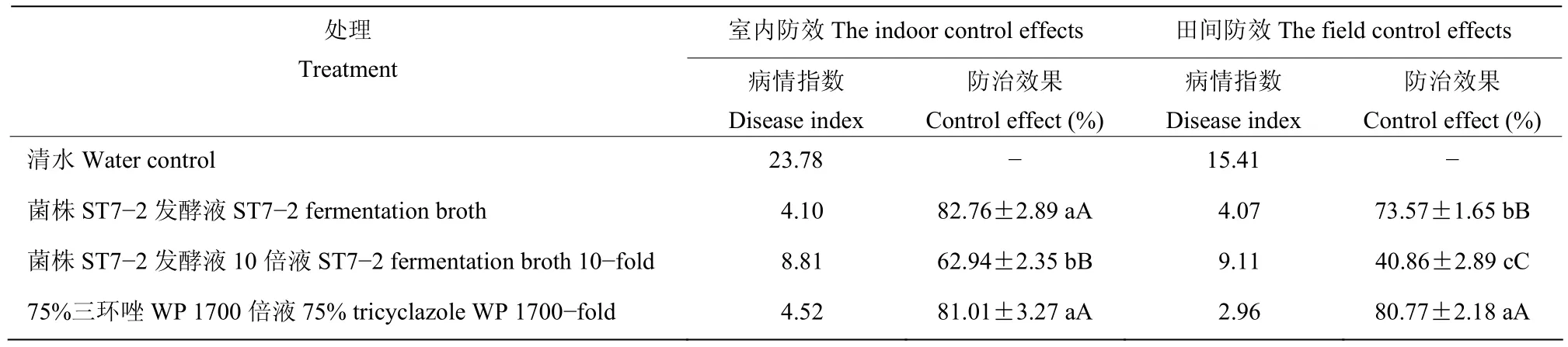
表5 菌株ST7-2对水稻稻瘟病的防治效果Table 5 Control effects of strain ST7-2 on Rice blast
3 讨论
迄今世界上已发现的抗生素约50%是由链霉菌产生的[33],随着对链霉菌的大量筛选,从链霉菌中获得新的活性物质的几率大大降低,研究者提高并改进分离方法,得到常规方法难分离到的稀有放线菌,从中发现了大量有价值的抗生素。本研究从土壤样品中分离到11株稀有放线菌,通过筛选发现菌株ST7−2对水稻稻瘟病菌的抑菌效果最强,通过形态特征、生理生化特征观察和16S rRNA、recA、gyrB与rpoB基因序列分析,确定该菌株为链霉菌属的杀结节链霉菌。菌株ST7−2对水稻稻瘟病菌有较好的抑制效果,抑菌带宽度达17.33 mm,其发酵液对水稻稻瘟病菌的室内防效可达82.76%,与75%三环唑WP 1700倍液无显著差异,田间试验的防治效果达73.57%,略低于75%三环唑WP 1700倍液处理。菌株ST7−2对水稻稻瘟病菌丝生长的抑制率低于链霉菌UPMRS4和涂链霉菌OsiSH−2,但是对病害防治效果高于UPMRS4和 OsiSH−2[14,15]。
链霉菌的应用于生物防治除了利用活体竞争作用、诱导或提高植物抗病性外,很重要的是利用其代谢产物防治病害。研究表明,杀结节链霉菌是一种稀有放线菌,其代谢产物杀结核菌素 tubercidin具有很强的生物活性[34]。杀结节链霉菌NBRC13090代谢产物tubercidin 对白色念珠菌,结核分枝杆菌和粪链球菌具有生物活性[34]。Ratti等[35]从Solanunlycocarpum中分离到一株杀结节链霉菌,经测定其对金黄色葡萄球菌、大肠杆菌和白色念珠菌具有抗菌活性,其粗提物对金黄色葡萄球菌和大肠杆菌具有抗菌活性。菌株ST7−2粗提物对多种病原真菌都有抑菌活性,不仅对水稻稻瘟病菌和水稻稻曲病菌抑菌活性强,菌丝生长抑制率为48.11%和76.82%,而且对芦笋茎枯病菌、蘑菇褐腐病菌和大豆炭疽病菌等也有较好的拮抗作用,菌丝生长抑制率分别为60.60%、15.13%和14.94%。
生防菌应用于生产,土壤有机质、温度、湿度等外界环境的不稳定性是拮抗菌面临的一个重要问题,本研究中菌株ST7−2在室内和田间试验都表现出较好的防效,可替代三环唑等部分生产中防控稻瘟病的常用化学药剂,生防应用前景广阔。本研究仅对ST7−2活菌及其粗提物防治稻瘟病进行研究,后续将进一步分析其代谢产物中的抑菌活性物质,明确其抑菌机制,以期更好地利用拮抗菌株防控作物致病菌。

