外源褪黑素和脱落酸对干旱胁迫下猕猴桃幼苗生理特性的影响
刘芯伶,彭玉婷,王云梅,夏 惠,梁 东,胡容平
(1.四川农业大学园艺学院, 四川 成都 611130;2.四川省农业科学院植物保护研究所,四川 成都 610066)
近年来随着全球气温变暖及降水量在时空分布上不均衡的加剧,干旱已成为影响全球农业发展的重要非生物因素[1-2]。猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl.),与其他果树相比,猕猴桃叶片大而薄,叶背被毛,茎具髓心,根为肉质浅根,这些形态结构特征使其对水分胁迫较为敏感[3]。土壤干旱常常会使猕猴桃根系受损,导致其生长受到抑制,同时造成果实综合品质的下降,严重时还会引起叶片的大面积焦枯脱落,甚至导致树体死亡,给农户造成巨大的经济损失[3]。因此,提高猕猴桃抗旱性,已成为其产业发展亟待解决的主要问题之一。
植物生长调节物质是一类少量存在于植物体内,但对植物的生长发育过程起着重要作用的小分子物质,包括生长素、褪黑素、脱落酸、水杨酸、茉莉酸甲酯等。近年研究发现植物生长调节物质在提高植物的抗逆性方面也起着积极的调节作用[4]。褪黑素(melatonin,MT)是一种新型植物激素,广泛存在于植物体内,具有吲哚类物质结构,可作为抗氧化剂和信号分子在提高植物对冷害[5]、干旱[6]、盐胁迫[7]及重金属胁迫[8]等非生物逆境的抗逆性方面起着积极作用。脱落酸(abscisic acid,ABA)对植物生长、发育、抗逆性、气孔运动和基因表达等都有重要调节功能[9-10],在植物响应干旱胁迫的ABA依赖途径中起着信号传导的关键作用[11]。
多见单独施用MT或ABA提高植物耐旱性的相关研究报道,但关于两者混合施用对植物干旱胁迫的效果及其生理机理的研究还比较少。本试验通过单一或混合施用MT和ABA的试验,综合分析生长指标、光合特性及抗氧化酶活性等的变化,探究混合施用MT和ABA对干旱胁迫的效果及其作用的生理机制,以期为其在猕猴桃生产应用提供理论依据,为二者在其他果树上的应用提供参考。
1 材料与方法
1.1 材料
试验材料为盆栽猕猴桃实生苗。于2019年1月选取‘金实1号’的饱满种子4℃层积,2个月后进行4℃、12 h与25℃、12 h交替的变温催芽处理。待种子露白后播入穴盘(基质为草炭土∶椰壳∶珍珠岩=2∶2∶1),放于温度为25℃±2℃、光强为4 860 μmol ·m-2·s-1(12 h/12 h)的培养室中生长。待第1片真叶展开后,开始浇1/2 Hoagland营养液,每周浇一次,其间补充清水。
1.2 试验处理
6月中旬,幼苗长至6片真叶,将其移至营养钵(20 cm×20 cm)中,基质为草炭土∶椰壳∶珍珠岩=2∶2∶1,每个营养钵植入3株幼苗,转移到室外避雨棚内,常规管理。2周后待幼苗适应遮雨棚环境,选取长势一致的实生苗90盆,平均分为5组进行处理:对照组(CK)、干旱处理组(DCK)、褪黑素处理组(MT+D)、脱落酸处理组(ABA+D)、褪黑素和脱落酸处理组(MT+ABA+D)。重复3次,每重复6盆。干旱处理前,对MT+D处理和MT+ABA+D处理用100 μmol·L-1褪黑素溶液进行根灌,每2 d 1次,共4次,每次200 mL;其他处理根灌等量清水。第4次根灌褪黑素的次日(设为干旱处理0 d),除CK组正常浇水外,其余处理均进行干旱处理,控制浇水,于干旱的第0、2、4、6、8、10天,对脱落酸处理ABA+D和MT+ABA+D叶面喷施10 mL ABA溶液,浓度为25 μmol·L-1,其余处理组则叶面喷施等量清水。干旱处理的第20天采取各处理组植株从下往上数第4~8节位的叶片,用于相关生理指标测定。
1.3 测定项目及方法
随机选取每处理组中9株幼苗用于生长指标的测定,株高、根长使用直尺测定,茎粗使用游标卡尺测定茎基部直径,干重取整株清洗后置于烘箱烘至恒重称重;光合指标使用便携式光合仪(LI-6400,LI-COR Inc.,美国)于晴天上午测定;叶绿素含量测定参照Zegaoui Z等[12]的方法;叶片相对含水量测定参照李合生等[13]的方法;叶片水势使用叶片水势仪(型号WP4C)测量;脯氨酸含量测定参照李合生等[12]的方法;可溶性蛋白含量采用G-250染色法[12]测定;可溶性糖含量采用蒽酮比色法[12]测定;过氧化氢(H2O2)含量采用紫外分光光度计法[12]测定;相对电导率(REL)测定参照向地英等[14]的方法;丙二醛(MDA)含量采用硫代巴比妥酸法[12]测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法[15]测定,过氧化物酶(POD)活性采用愈创木酚显色法[16]测定,过氧化氢酶(CAT)活性采用比色法[15]测定。
1.4 数据分析
试验数据均采用平均值±标准误表示,其统计分析与图表绘制利用Excel 2010软件进行,显著性分析则利用SPSS 20.0软件,采用单因素方差分析(one-way ANOVA)法进行LSD检验(p<0.05)。
2 结果与分析
2.1 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗生长指标的影响
单一施用脱落酸(ABA)或混合施用褪黑素(MT)和ABA可在一定程度上缓解干旱胁迫对猕猴桃幼苗各生长指标产生的影响(表1)。ABA+D、MT+ABA+D处理组的鲜重分别较DCK处理组高66%和104%左右,差异显著。MT+ABA+D处理组的干重较DCK处理组高110%左右,差异显著。植株的根长、茎粗、株高,单一或混合施用MT或ABA均未对其产生显著影响。
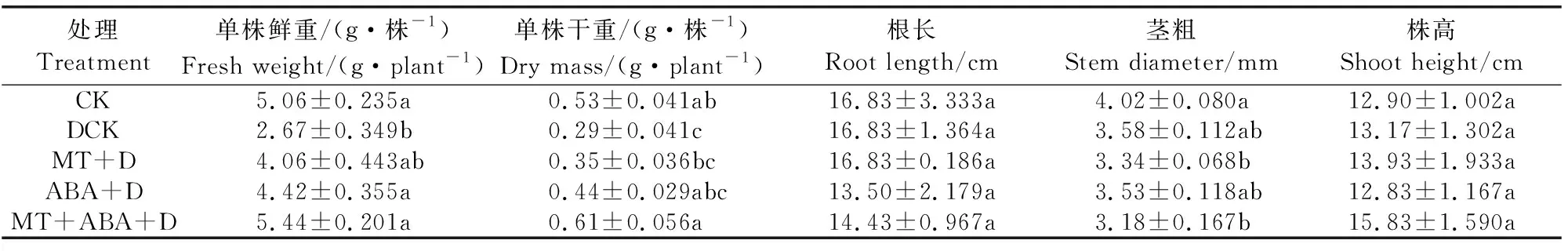
表1 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗生长指标的影响
2.2 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗光合指标的影响
干旱胁迫导致植物光合速率降低[17],而单一或混合施用MT和ABA可一定程度上提高干旱胁迫下猕猴桃幼苗的净光合速率。如表2所示,MT、MT+ABA处理组的净光合速率分别较DCK处理组高36%和29%左右(p>0.05),且ABA+D处理组的效果最佳,较DCK处理组高40%左右,差异显著。气孔导度、胞间CO2、蒸腾速率、水分利用率,单独或混合施用MT或ABA均未对其产生显著影响。
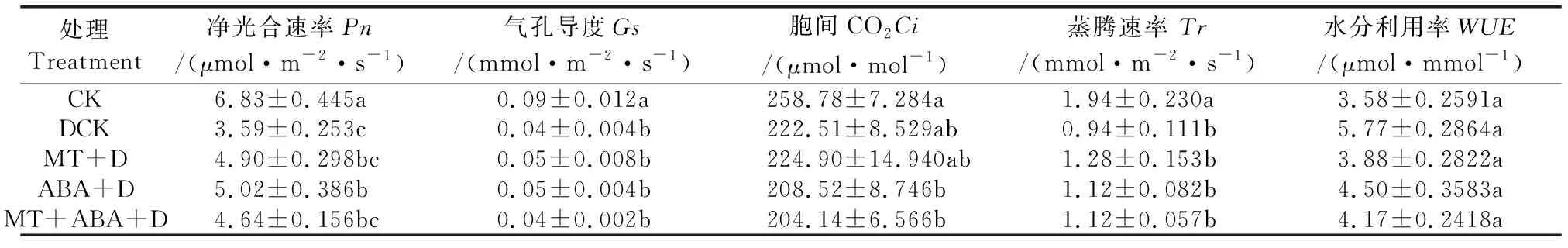
表2 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗光合指标的影响
2.3 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片光合色素的影响
干旱胁迫下,植物叶片片层结构受到破坏,导致叶绿素分解[18],单一或混合施用MT和ABA可缓解干旱引发的叶绿素含量下降。如图1A所示,ABA+D和MT+ABA+D处理组的叶绿素a含量分别较DCK处理组高6%和18%左右(p>0.05)。如图1B所示,ABA+D和MT+ABA+D处理组的叶绿素b含量分别较DCK处理组高7%和18%左右(p>0.05)。如图1C所示,MT+D和ABA+D处理组的总叶绿素含量分别较DCK处理组高1%和7%左右(p>0.05),MT+ABA+D处理组的效果最佳,较DCK处理组高20%左右,差异显著。

图1 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶绿素a、叶绿素b和总叶绿素含量的影响Fig.1 Effect of MT and ABA on chlorophyll a, chlorophyll b, and total chlorophyllcontent in kiwifruit seedlings under drought stress
2.4 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片相对含水量和水势的影响
植物叶片含水量能较好地指示植物对干旱胁迫的敏感性和耐受性[19-20],而叶片水势可指示叶片吸水和保水的能力,是反映体内细胞水分状况的重要生理指标。叶片水势参与细胞气孔的调节,干旱胁迫下叶片水势降低,气孔关闭,水分散失减少[21]。如表3所示,MT或MT和ABA的施用可以提高叶片相对含水量和叶片水势,增加植物对干旱的耐受性。MT+D和MT+ABA+D处理组叶片相对含水量分别较DCK组高9%和4%左右(p>0.05)。MT+D、ABA+D和MT+ABA+D处理组的叶片水势分别较DCK处理组高39%、35%、32%左右,差异显著。

表3 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片相对含水量、叶片水势的影响
2.5 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片渗透调节物质含量的影响
脯氨酸、可溶性蛋白、可溶性糖是植物体内最主要的渗透调节物质,干旱胁迫下渗透调节物质大量积累,以降低细胞水势,维持细胞吸水能力[22]。如图2A所示,外源激素处理组中,MT+ABA+D处理组的脯氨酸含量最低,较MT+D处理组低78%左右(p>0.05),较ABA+D处理组低126%左右,差异显著。如图2B所示,外源激素处理组中,MT+ABA+D处理组的可溶性蛋白含量最高,较MT+D处理组高10%左右(p>0.05),较ABA+D处理组高3.5%左右(p>0.05)。如图2C所示,外源激素处理组中,ABA+D处理组的可溶性糖含量最高,较MT+D处理组高70%左右,差异显著,较ABA+D处理组高51%左右,差异显著。

图2 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片脯氨酸、可溶性蛋白、可溶性糖含量的影响Fig.2 Effect of MT and ABA on the proline, soluble protein and soluble sugarcontent in kiwifruit seedling under drought stress
2.6 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片膜脂过氧化程度的影响
逆境会导致细胞膜的选择透性降低或丧失,以致细胞内物质大量外渗,引起叶片浸出液电导率变化,因此相对电导率可反映膜受伤害程度[23]。单一或混合施用MT或ABA可降低相对电导率,缓解干旱引发的细胞膜伤害。如图3A所示,MT+D、ABA+D和MT+ABA+D处理组的相对电导率分别较DCK处理组低7%、8%、18%左右(p>0.05)。丙二醛含量可衡量脂质氧化程度[24],MT或MT和ABA的施用可降低幼苗叶片膜脂化程度,缓解干旱引发的细胞膜伤害。如图3B所示,MT+D与MT+ABA+D处理组的MDA含量分别较DCK处理组低66%、44%左右,差异显著。MT或ABA均可降低H2O2含量。如图3C所示,MT+D、ABA+D和MT+ABA+D处理组的H2O2含量较DCK处理组低7%、13.5%、6.5%左右,差异显著。

图3 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片相对电导率、丙二醛(MDA)和H2O2含量的影响Fig.3 Effects of MT and ABA on the relative electrolytic leakage, MDA and H2O2 contentin kiwifruit seedling leaves under drought stress
2.7褪黑素和脱落酸处理对干旱胁迫下猕猴桃叶片抗氧化酶活性的影响
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)3种抗氧化酶的主要功能是去除活性氧自由基并防止其过度积累[25],单一或混合施用MT和ABA对这3种抗氧化酶的作用效果各不相同。如图4A所示,MT+D处理组的SOD活性较DCK处理组高134%左右,差异显著。如图4B所示,MT+D处理组的POD活性较DCK处理组低12%左右,差异显著,而ABA+D与MT+ABA+D处理组的POD活性则分别较DCK处理组高41%与35.5%左右,差异显著。但MT、ABA及MT+ABA均未对CAT活性产生明显影响(图4C)。

图4 褪黑素与脱落酸对干旱胁迫下猕猴桃幼苗叶片SOD、POD和CAT活性的影响Fig.4 Effect of MT and ABA on activity of SOD, POD and CATin kiwifruit seedling leaves under drought stress
3 讨 论
土壤水分不足时,植物根系吸收的水分不足以弥补叶片蒸腾作用损失的水分,会导致叶片含水量降低,光合速率受限,生长受阻。单独或混合施用外源激素MT和ABA可一定程度提高干旱胁迫下植物的叶片水势与净光合速率,改善猕猴桃幼苗在干旱胁迫状态下生长的状态。试验表明,单独施用MT可提高干旱环境中猕猴桃的叶片水势与叶片相对含水量,这在其他植物的相关研究中鲜见报道,但有研究表明ABA可增加植株在干旱条件下的保水能力[26]。本试验中ABA表现出了防止干旱胁迫下猕猴桃幼苗叶绿素分解,增加净光合速率与干物质积累的作用。值得注意的是,混合施用MT和ABA的作用与单独施用ABA一致,但效果较单独施用ABA显著。推测,MT可激活ABA依赖型途径中与保水相关的部分响应元件来提高植物的叶片水势与叶片相对含水量,而同时施用MT与ABA,会导致植物ABA依赖型途径中与光合和生长相关的响应元件较单独施用ABA被更多或更强烈地激活,从而使得通过ABA依赖型途径完成的干旱胁迫响应机制的作用效果更佳,但此推论尚待进一步研究和验证。
研究表明,单独施用外源MT和ABA可以提高植物的渗透调节物质含量[27-28],该机制对植物适应干旱环境下的水分胁迫,维持正常生长与细胞吸水能力起到至关重要的作用[29-30]。试验表明,对处于干旱环境中的植物单独施用ABA可使植株中的脯氨酸、可溶性蛋白和可溶性糖3种渗透调节物质的含量较CK组有所升高,而单独施用MT仅使可溶性蛋白含量较CK组有所提高。值得注意的是,混合施用MT和ABA的作用效果与单独施用MT相似,作用效果不如单独施用ABA显著。推测,MT介导可溶性蛋白这一渗透调节物质激活ABA依赖型途径响应元件,而同时施加MT与ABA,则降低了植物ABA依赖型途径中与渗透相关的响应元件对ABA的敏感度,这或与MT升高了叶片水势与叶片相对含水量,减缓了干旱导致的猕猴桃渗透胁迫强度有关。
干旱胁迫会导致植物活性氧自由基产生和清除的代谢平衡被破坏,引发或加剧细胞的膜脂过氧化,对植物细胞膜造成伤害[31-32]。本试验中,单独施用MT可降低植株的MDA含量与H2O2含量,而单独施用ABA则只降低H2O2含量。二者联合施用时,作用效果与单独施用MT时相似,这是由于MT除可通过ABA依赖型途径降低细胞膜脂过氧化程度外,还可直接参与活性氧自由基的清除,故其保护细胞膜的作用更为强大。这也与王云梅等[33]研究得出的MT与ABA组合处理具有与MT处理类似的缓解氧化损伤的效果的结论相一致。
相关研究表明,单独施用MT和ABA可以提高抗氧化相关酶SOD、POD与CAT活性,减缓膜脂过氧化带来的伤害[27-28,33]。本试验中,单独施用MT和ABA对SOD、POD活性的影响表现出了相反的作用,MT提高SOD活性,降低POD活性,而ABA则降低SOD活性,提高POD活性,但二者均未对CAT活性产生显著影响。二者混合施用时的作用效果与单独施用ABA类似。综合来看,单一或混合施用MT和ABA对干旱胁迫下猕猴桃幼苗的抗氧化酶的活性变化的影响效果差异不大,SOD、POD、CAT 3种抗氧化酶的活性始终处于一个相对平衡的状态。
综合来看,单独施用MT利于增强干旱环境中猕猴桃的保水能力与抗氧化能力,关于MT提高植物抗氧化能力的报道较多,但关于其可提高保水能力的报道却鲜见,有相关研究提及ABA可提高保水能力[26]。表明MT或可通过ABA依赖型途径来增强植物的保水能力,这在前人相关研究中未见报道,其具体的作用机制仍有待进一步研究。而混合施用MT和ABA的作用效果与单独施用ABA的效果类似,主要通过改善光合作用来实现干旱胁迫下的猕猴桃最优生长,这与王云梅等[33]在施用ABA浓度未表现出对葡萄干旱胁迫的缓解效果的情况下得出的 MT与ABA组合处理的效果与MT处理类似,主要通过缓解干旱引起的氧化损伤来提高抗旱性的结论不同,却在一定程度上印证了MT可通过ABA依赖型途径来完成干旱胁迫响应机制这一结论。MT与ABA两者混合施用对植物胁迫的缓解效果及作用机理的研究鲜见报道,且大多与生理机制有关,并未深入到分子水平,MT与ABA组合处理的作用原理与机制仍存在大量空白,尚不清晰,有待进一步研究。
4 结 论
褪黑素(MT)可使干旱胁迫下猕猴桃的叶片相对含水量、叶片水势和SOD活性分别提高9%、39%和134%左右,而MDA与H2O2含量降低66%与7%左右。ABA可提高叶绿素含量、净光合速率、干物质积累和POD活性7%、40%、52%和41%左右,降低H2O2含量13.5%左右。MT+ABA处理的效果与ABA处理类似,可分别增加净光合速率、干物质的积累量与POD活性29%、110%与35.5%左右,降低MDA与H2O2含量44%、6.5%左右。表明MT利于提高植株的保水能力,降低膜脂过氧化程度。ABA和MT+ABA处理利于提高光合作用,使植株在水分限制条件下积累更多干物质。

