丹参酒炙过程中炮制时间、颜色与化学成分含量的相关性
徐斌 张强 刘亮镜


中圖分类号 R283.3 文献标志码 A 文章编号 1001-0408(2021)14-1715-06
DOI 10.6039/j.issn.1001-0408.2021.14.09
摘 要 目的:评价丹参酒炙过程中炮制时间、颜色与化学成分含量的相关性。方法:用黄酒制备不同炮制时间(7~15 min)的丹参酒炙品,采用高效液相色谱法测定丹参及其酒炙品中丹酚酸B、丹参酮ⅡA和5-羟甲基糠醛(5-HMF)的含量;采用色差仪测定两者的色度值[红绿色轴分量(a*)、黄蓝色轴分量(b*)、明度(L*)]并计算总色差值(ΔE);采用Spearmans rho、Kendalls Tau-b检验考察炮制时间、色度值与化学成分含量的相关性。结果:丹参饮片中丹酚酸B、丹参酮ⅡA、5-HMF的含量分别为17.9~70.6、2.3~3.1、0 mg/g;丹参酒灸品中丹酚酸B、丹参酮ⅡA、5-HMF的含量分别为14.8~68.4、1.1~3.9、0.7~34.4 mg/g。丹酚酸B含量先降低再增加,约在9、11 min达到高峰后逐渐降低;丹参酮ⅡA含量先增加,约在7 min达到高峰后逐渐降低;5-HMF在炒制13 min后含量急剧增加。以丹参为标样的丹参酒炙品的ΔL*为-5.369~2.553、Δa*为-1.098~0.321、Δb*为-1.471~2.355,ΔE为0.217~5.397。Spearmans rho、Kendalls Tau-b检验的结果均显示,ΔE与丹参炮制时间(相关系数分别为0.517、0.389)、5-HMF含量(相关系数分别为0.549、0.405)均呈正相关(P均小于0.01);丹参酮ⅡA含量与Δb*(相关系数分别为-0.509、-0.391)、炮制时间(相关系数分别为-0.556、-0.420)、5-HMF含量(相关系数分别为-0.545、-0.392)均呈负相关(P均小于0.01);5-HMF含量与炮制时间(相关系数分别为0.957、0.870)呈正相关(P均小于0.01)。结论:丹参酒炙过程中丹参酮ⅡA、5-HMF的含量与炮制时间及颜色显著相关,即随着炮制时间增加和温度升高,其颜色由红黄色向黄绿色变化,在黑白程度上偏黑色;丹参酮ⅡA含量降低,5-HMF含量升高。
关键词 丹参;酒炙;5-羟甲基糠醛;丹参酮ⅡA;丹酚酸B;高效液相色谱法;色度值;相关性分析
Correlation between Processing Time, Color and Chemical Composition Content in the Wine-fried Process of Salvia miltiorrhiza
XU Bin1,ZHANG Qiang2,LIU Liangjing1(1. Pharmacy Division, Wuhu Hospital of TCM, Anhui Wuhu 241000, China; 2. School of Pharmacy, Anhui College of TCM, Anhui Wuhu 241003, China)
ABSTRACT OBJECTIVE: To evaluate the correlation between processing time, color and chemical composition content in the wine-fried process of Salvia miltiorrhiza. METHODS: Wine-fried S. miltiorrhiza with different processing time (7-15 min) was prepared by yellow rice wine. The contents of salvianolic acid B, tanshinone ⅡA and 5-HMF in raw and wine-fried S. miltiorrhiza were determined by HPLC. The colorimeter was used to determine their chromatic values [red-green axis component (a*), yellow-blue axis component (b*), lightness (L*)] and calculate the total color difference value(ΔE). Spearmans rho and Kendalls Tau-b test were adopted to validate the correlation between processing time, chromatic value and chemical composition content. RESULTS: The contents of salvianolic acid B, tanshinone ⅡA and 5-HMF were 17.9-70.6, 2.3-3.1, 0 mg/g in S. miltiorrhiza decoction pieces; the contents of them were 14.8-68.4, 1.1-3.9, 0.7-34.4 mg/g in wine-fried S. miltiorrhiza. The content of salvianolic acid B at first decreased and then increased, reaching the peak at about 9, 11 min, and then gradually decreased; the content of tanshinone ⅡA increased at first, reached its peak about 7 min, and then gradually decreased; the content of 5-HMF increased sharply after frying 13 min. The measurement results of chromaticity values were ΔL* -5.369-2.553, Δa* -1.098-0.321, Δb* -1.471- 2.355, ΔE 0.217-5.397. Results of Spearmans rho and Kendalls Tau-b test showed that ΔE was positively correlated with processing time (the correlation coefficient were 0.517, 0.389 respectively) and 5-HMF content (the correlation coefficient were 0.549, 0.405 respectively) (both P<0.01). The content of tanshinone ⅡA was negatively correlated with Δb*(the correlation coefficient were -0.509, -0.391 respectively), processing time (the correlation coefficient were -0.556, -0.420 respectively) and 5-HMF content (the correlation coefficient were -0.545, -0.392 respectively) (both P<0.01). The content of 5-HMF was positively correlated with the processing time (the correlation coefficient were 0.957, 0.870 respectively) (both P<0.01). CONCLUSIONS: The contents of tanshinone ⅡA and 5-HMF in the process of wine-fried process are significantly related to the time and color. With the increase of processing time and temperature,its color changes from red yellow to yellow green, and tends to be black in black and white; the content of tanshinone ⅡA is decreased and the content of 5-HMF is increased.
KEYWORDS Salvia miltiorrhiza; Wine-fried; 5-HMF; Tanshinone ⅡA; Salvianolic acid B; HPLC; Chromaticity value; Correlation analysis
丹参为唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎[1]。该药含有上百种活性成分,其中丹参酮类脂溶性成分具有抗凝血、抗血小板聚集、调血脂、抗炎、抗肿瘤等药理活性;酚酸类水溶性成分具有抗氧化、抗动脉粥样硬化、降血压等作用;丹参多糖具有抗肿瘤、免疫调节的作用[2]。丹参生品药性偏寒凉,酒炙后其寒凉之性缓和,活血祛瘀、调经止痛之功增强,故丹参酒炙品是一味常用中药[3]。丹参酒炙后的外观性状与内在质量均发生明显的变化,其性味、功能主治也有一定改变,目前有关丹参酒炙的研究大多集中于炮制前后的化学成分变化和以其中一两个成分含量增减为指标的炮制工艺考察[4-6],尚未见有关丹参酒炙过程中各主成分变化规律的系统研究。
美拉德反应是指羰基化合物(还原糖类)与氨基化合物(氨基酸、肽、蛋白质、胺等)之间经过缩合、聚合而最终生成一类棕褐色、结构复杂、聚合度不等的高分子聚合物的反应,该聚合物亦称为类黑精,5-羟甲基糠醛(5-HMF)是形成棕褐色类黑精的中间体之一[7]。丹参酒炙过程中可产生5-HMF,炮制品的颜色也随之由棕红色变为红褐色[1,4]。可见,5-HMF由美拉德反应产生,其含量变化可能与丹参的炮制程度、炮制品颜色具有相关性[4,7]。丹酚酸B和丹参酮ⅡA为丹参的主要活性成分,有研究发现,两者的含量在酒炙过程中可发生变化[5]。
色差仪是通过仪器模拟人眼对颜色进行判断,得到样品颜色的红原色刺激量值(X)、绿原色刺激量值(Y)和蓝原色刺激量值(Z),再根據国际照明委员会Lab颜色空间原理计算相应的色差值明度(L*)、红绿色轴分量(a*)、黄蓝色轴分量(b*),最终实现对颜色的准确量化[8]。基于此,本研究拟采用高效液相色谱法(HPLC)同时测定丹参及丹参酒炙品中丹酚酸B、丹参酮ⅡA、5-HMF的含量;拟通过色差仪对丹参及丹参酒炙品的颜色进行客观、数字化处理,对传统的颜色指标进行量化,分析其与丹酚酸B、丹参酮ⅡA、5-HMF含量的相关性,旨在为丹参炮制机制研究和炮制品质量控制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1200型HPLC仪及配备的紫外检测器、B.03.01色谱工作站(美国Agilent公司),汇思特HR110型色差仪(深圳翔邦自动化仪器设备有限公司),XP205型十万分之一电子天平、AE240型万分之一电子天平(瑞士Mettler Toledo公司),UPS-11-10T型优普系列超纯水器(成都优普净化科技有限公司),KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司),DFY-1000型(摇摆式)多功能高速中药粉碎机,CY-40型中药炒药机(温州顶历医疗器械有限公司)等。
1.2 主要药品与试剂
丹酚酸B对照品(批号111562-201514,纯度93.7%)、丹参酮ⅡA对照品(批号110766-201721,纯度99.5%)均购自中国食品药品检定研究院;5-HMF对照品(批号B21832,纯度≥98%)购自上海源叶生物科技有限公司;黄酒[批号WH1SC101,酒精度(11.0±1.0)%],购自安徽马头墙酒业有限公司;甲醇、乙腈均为色谱纯,水为超纯水。
8批丹参饮片(编号DS1~DS8)由安徽中医药高等专科学校药学院秦亚东副教授鉴定为唇形科植物丹参S. miltiorrhiza Bge.的干燥根及根茎。8批丹参饮片的来源信息见表1。
2 方法与结果
2.1 丹参酒炙品的制备
按2020年版《中国药典》(四部)“0213炮制通则”酒炙项下方法炮制[9]。取丹参饮片,每100 g用黄酒10 g拌匀,闷润2 h,待黄酒被吸尽;用文火将炒药机内部加热至200 ℃,加入上述闷润的饮片,炒制(7 min左右)至饮片表面温度达到(100±5)℃,得丹参酒炙样品A;继续炒制2 min左右至饮片表面温度达到(110±5)℃,表面有少量焦斑,得丹参酒炙样品B;继续炒制2 min左右至饮片表面温度达到(120±5)℃,表面有焦斑,得丹参酒炙样品C;继续炒制2 min左右至饮片表面温度达到(130±5)℃,表面有大量焦斑,得丹参酒炙样品D;继续炒制2 min左右至饮片表面温度达到(140±5)℃,表面焦黑,得丹参酒炙样品E;所有样品(编号JDS1A~JDS8E)放冷后,筛去焦屑。
2.2 5-HMF来源的确定
因为黄酒中含有5-HMF[10],为确定5-HMF的来源,故进行如下试验:精密量取黄酒1.0 mL,置于具塞锥形瓶中,按后文“2.3.2”项下方法制备阴性对照溶液,再按后文“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算5-HMF的含量。结果,5-HMF的含量为1.587 mg/mL。按炮制过程中黄酒的加入量(10%)来计算[9],得到丹参酒炙品中来源于黄酒的5-HMF含量为0.159 mg/mL;若按“2.3.2”项下方法制备,同法测定并计算5-HMF的质量浓度为0.006 36 μg(以10 μL进样),低于5-HMF含量检测的线性范围下限0.01 μg,故基本可判断丹参酒炙品中的5-HMF来源于美拉德反应,而非黄酒。
2.3 丹酚酸B、丹参酮ⅡA及5-HMF的含量测定
2.3.1 色谱条件 以Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~5 min,7%A,检测波长为280 nm;5~6 min,7%A→25%A,检测波长为 280 nm;6~17 min,25%A,检测波长为286 nm;17~18 min,25%A→68%A,检测波长为286 nm;18~35 min,68%A,检测波长为270 nm;35~40 min,68%A→7%A,检测波长为280 nm);柱温为20 ℃;流速为1.0 mL/min;进样量为10 μL。
2.3.2 供试品溶液的制备 取丹参饮片,粉碎(过三号筛),取粉末,约0.20 g,精密称定,置于具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定质量,超声(功率140 W,频率50 kHz)处理30 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。同法制得丹参酒炙品的供试品溶液。
2.3.3 混合对照品溶液的制备 分别精密称取丹酚酸B、丹参酮ⅡA、5-HMF对照品各适量,加甲醇制成上述3种成分质量浓度分别为319.7、49.0、20.0 μg/mL的单一对照品贮备液。精密量取上述各单一对照品贮备液5.0、1.6、1.0 mL,置于同一10 mL量瓶中,加甲醇稀释并定容,摇匀,得上述3种成分质量浓度分别为159.85、7.84、2.0 μg/mL的混合对照品溶液。
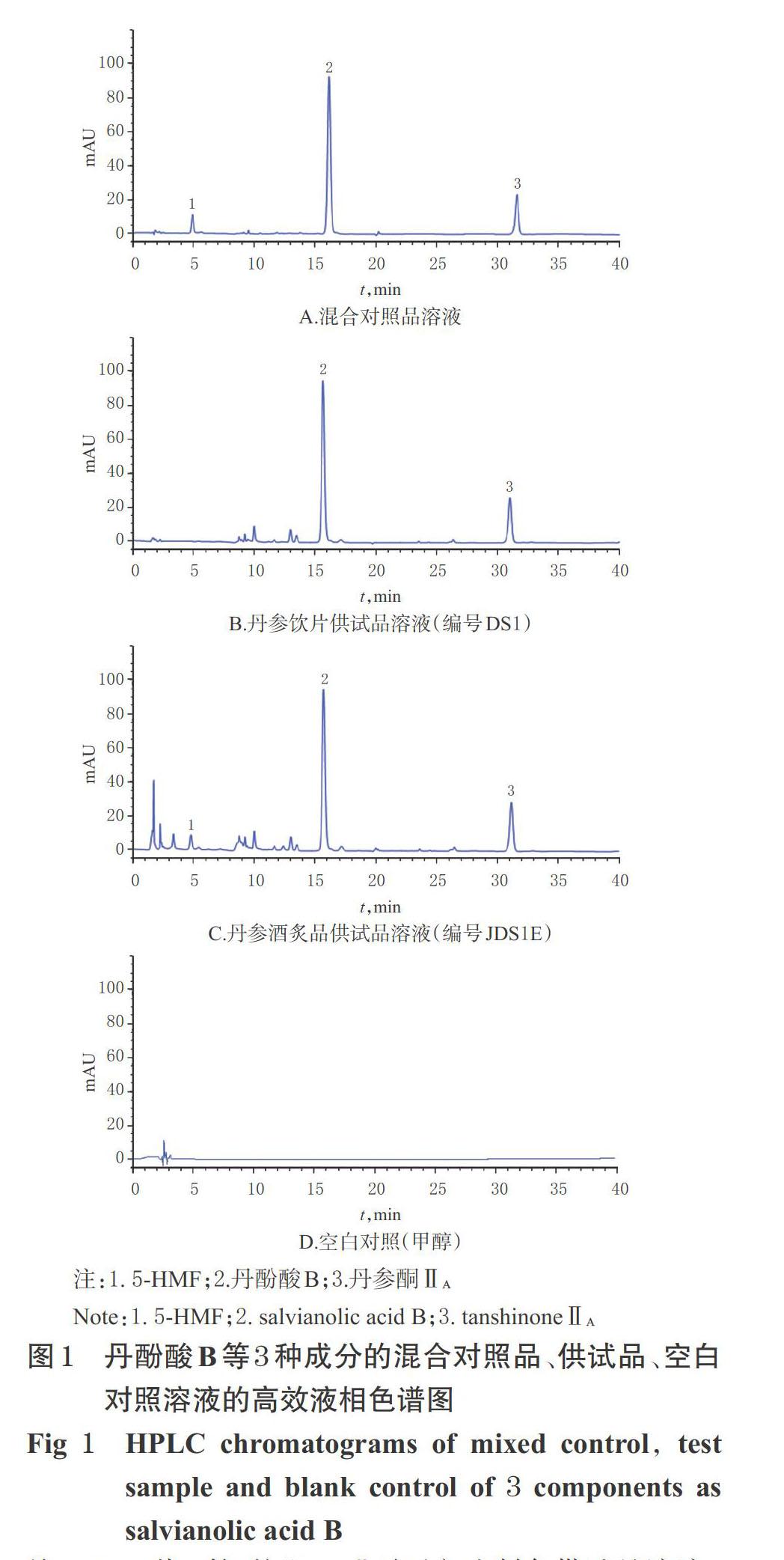
2.3.4 系统适用性试验 取上述各溶液,并以甲醇作为空白对照,按“2.3.1”项下色谱条件进样测定,记录色谱图。结果,各成分分离良好,分离度均大于1.5,理论板数均不低于6 000,空白对照对测定无干扰,详见图1。
2.3.5 线性关系考察 取“2.3.3”项下丹酚酸B、丹参酮ⅡA各单一对照品贮备液,分别以1、3、5、10、15 μL进样;取“2.3.3”项下5-HMF单一对照品贮备液,用甲醇稀释1倍后,再分别以1、3、5、10、15 μL进样,另取“2.3.3”项下5-HMF单一对照品贮备液,分别以10、15 μL进样,记录色谱图。以各待测成分的进样量(X,μg)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果,丹酚酸B的回归方程为Y=1 025X-14.804(r=0.999 9)、丹参酮ⅡA 为Y=5 603.9X-14.034(r=0.999 9)、5-HMF為Y=392.81X-1.132 6(r=0.999 9)。表明,丹酚酸B、丹参酮ⅡA、5-HMF检测进样量的线性范围分别为0.320~4.796、0.049~0.735、0.010~0.300 μg。
2.3.6 精密度试验 精密吸取“2.3.3”项下混合对照品溶液,按“2.3.1”项下色谱条件连续进样测定6次,记录峰面积。结果,丹酚酸B、丹参酮ⅡA、5-HMF峰面积的RSD分别为0.1%、0.3%、0.9%(n=6),表明仪器精密度良好。
2.3.7 重复性试验 取丹参酒炙品粉末(编号JDS1E),约0.20 g,共6份,按“2.3.2”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中3种待测成分的含量。结果,丹酚酸B、丹参酮ⅡA、5-HMF的平均含量分别为36.8、1.9、8.4 mg/g,RSD分别为1.0%、0.2%、1.0%(n=6),表明方法重复性良好。
2.3.8 稳定性试验 取“2.3.2”项下丹参酒炙品的供试品溶液(编号JDS1E),分别于室温下放置0、4、8、12、16、24 h时按“2.3.1”项下色谱条件进样测定,记录峰面积。结果,丹酚酸B、丹参酮ⅡA、5-HMF峰面积的RSD分别为1.0%、0.8%、1.1%(n=6),表明供试品溶液于室温下放置24 h内稳定性良好。
2.3.9 加样回收率试验 精密称取已知含量的丹参酒炙品(编号JDS1E)粉末,约0.10 g,共6份,加入与已知量相等的各待测成分的混合对照溶液(精密称取丹酚酸B、丹参酮ⅡA、5-HMF对照品适量,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制得上述成分质量浓度分别为4.012 3、0.209 5、0.884 3 mg/mL的混合对照溶液),按“2.3.2”项下方法处理,再按“2.3.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.3.10 样品含量测定 精密称取48批丹参饮片及丹参酒炙品粉末适量,按“2.3.2”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中3种待测成分的含量。每样品平行测定3次,结果见表3。
由表3可知,在丹参饮片经黄酒闷润后炒制的过程中,丹酚酸B含量呈先降低后增加再降低的趋势,约在炒制9、11 min时达到峰值,随后逐渐降低;丹参酮ⅡA含量总体呈先增加后降低的趋势(因本研究主要考察的是大多数药材的变化趋势,极个别会出现偏差,其原因很多,比如加热前期温度变化较快以及取样的速度,药材的粗细等),约在炒制7 min时达到峰值,随后逐渐降低;5-HMF的含量随炒制时间的延长而升高,且自炒制13 min(药材表面温度130±5 ℃)起该成分的含量急剧上升。
2.4 色度值的测定
2.4.1 测定方法、条件与参数计算 分别取丹参饮片及丹参酒炙品适量,粉碎后过五号筛,混合均匀。用标准板校正色差仪后,将各样品粉末分别置于粉末测试盒中,测定色度值(L*、a*、b*),每样品平行测定3次,取平均值。色差仪测定条件为主光源D65,测量口径4 mm,其含光方式为含物体反射光中的镜面反射光。以L*=0为黑色,L*=100为白色,ΔL*= L*(样品)-L*(标样),Δa*=a*(样品)-a*(标样),Δb*=b*(样品)-b*(标样)(a*负值为绿色、正值为红色,b*负值为蓝色、正值为黄色,标样为丹参饮片,样品为丹参酒炙品);总色值差(ΔE)=[(ΔL*)2+(Δa*)2+(Δb*)2]1/2)[11]。
2.4.2 精密度考察 取丹参酒炙品(编号JDS1E)粉末适量,将其置于粉末测试盒中,在同日内按“2.4.1”项下参数条件连续测定6次。结果,L*、a*、b*的RSD分别为0.14%、0.74%、0.16%(n=6),表明方法精密度良好。
2.4.3 稳定性考察 取丹参酒炙品(编号JDS1E)粉末适量,将其置于粉末测试盒中,分别于室温下放置0、12、24、36、48、72 h时按“2.4.1”项下参数条件测定。结果,L*、a*、b*的RSD分别为0.46%、0.88%、0.89%(n=6),表明样品于室温下放置72 h内稳定性良好。
2.4.4 样品色度值的测定 以每批丹参饮片为标样,按“2.4.1”项下参数条件测定丹参饮片及丹参酒炙品的色度值并计算两者的ΔE。结果,丹参饮片及丹参酒炙品的L*分别为42.575~44.416、37.926~45.240,a*分别为1.624~2.750、1.212~2.365,b*分别为1.917~3.755、1.512~4.503,表明丹参饮片及丹参酒炙品颜色偏红色和黄色。丹参酒炙品的ΔL*为-5.369~2.553、Δa*为 -1.098~0.321、Δb*为-1.471~2.355,ΔE为0.217~5.397,表明在酒炙后,丹参颜色由红黄色向黄绿色变化,在黑白程度上偏黑色,详见表4。
2.5 成分含量的秩和检验分析
采用SPSS 20.0软件对数据进行统计分析。由于部分试验数据不符合正态分布,故采用秩和检验。检验水准α=0.05。经独立样本Kruskal-Wallis H检验,得丹参饮片及丹参酒炙品中5-HMF、丹参酮ⅡA含量组间比较,差异均有统计学意义(χ 2=43.272,P<0.001和χ 2=17.656,P<0.01),而丹酚酸B含量组间比较差异无统计学意义(χ2=4.772,P>0.05)。
2.6 相关性分析
2.6.1 色泽与炮制时间的相关性 采用SPSS 20.0软件进行相关性分析(下同)。Spearmans rho、Kendalls Tau-b检验结果均显示,ΔE与丹参炮制时间呈正相关,相关系数分别为0.517(P<0.01)、0.389(P<0.01),详见表5。
2.6.2 色泽与含量及含量之间的相关性 Spearmans rho、Kendalls Tau-b检验结果均显示,5-HMF含量与ΔE呈正相关,相关系数分别为0.549(P<0.01)、0.405(P<0.01);丹参酮ⅡA含量与Δb*呈负相关,相关系数分别为-0.509(P<0.01)、-0.391(P<0.01)。此外,5-HMF含量与丹参酮ⅡA含量呈负相关,相关系数分别为-0.545(P<0.01)、-0.392(P<0.01),详见表5。
2.6.3 含量与炮制时间的相关性 Spearmans rho、Kendalls Tau-b检验结果均显示,5-HMF含量与炮制时间呈正相关,相关系数分别为0.957(P<0.01)、0.870(P<0.01);丹参酮ⅡA含量与炮制时间呈负相关,相关系数分别为-0.556(P<0.01)、-0.420(P<0.01),详见表5。
3 讨论
2020年版《中国药典》(一部)丹参饮片项下的丹参酮类成分和丹酚酸B的含量测定均采用乙腈-磷酸溶液为流动相[1];文献报道的5-HMF含量测定则以乙腈-水和甲醇-水为流动相[12-13]。在参考上述文献的基础上,笔者经前期研究发现,当乙腈-0.1%磷酸溶液为流动相时能满足丹酚酸B、丹参酮ⅡA、5-HMF等3个成分的分离,故选择乙腈-0.1%磷酸溶液为流动相。同时,前期预实验结果还显示,温度对丹参酮ⅡA和丹酚酸B出峰时间的稳定性影响较大,但并未影响5-HMF的出峰时间,通过参考2020年版《中国药典》(一部)设定柱温为20 ℃[1]。结果,丹酚酸B、丹参酮ⅡA、5-HMF等3个成分均得到有效分离。
本研究结果显示,当炒制表面温度为100 ℃左右时,丹参酒炙品的颜色加深,随着炒制时间的延长,饮片表面温度每增加10 ℃,相同时间内5-HMF的含量增加约25%~200%;当温度高于130 ℃左右时,5-HMF的含量增加明显加快,表明美拉德反应速度加快。有研究发现,酒炙后丹参中丹参酮ⅡA的含量增加或降低[14-15],丹酚酸B的含量降低或升高,结果不一[16-17],这可能与丹参酒炙过程中的炒制时间和温度不同有关。本研究结果显示,丹酚酸B的含量呈先降低后增加再降低的趋势,丹参酮ⅡA的含量呈先增加后降低的趋势。有文献报道,丹参酒炙过程中隐丹参酮可转化为丹参酮ⅡA,这可能是其初期含量增加的原因之一[5]。因此,单仅以丹酚酸B和丹参酮ⅡA含量不低于某个值来评价丹参酒炙品的质量,具有一定的局限性。
本研究结果显示,丹参酒炙过程中丹参酮ⅡA、5-HMF的含量与炮制时间及颜色显著相关,即随着炮制时间延长和温度升高,其ΔE升高;丹参酮ⅡA含量降低,5-HMF含量升高。丹酚酸B约在酒炙9、11 min时达到峰值,丹参酮ⅡA约在酒炙7 min时达到峰值,而这两个时间点对应的5-HMF含量变化不大,在0.1%~0.2%之间,色差值ΔE在0.2~3.2之间。因此笔者认为,以丹酚酸B和丹参酮ⅡA含量、ΔE以及5-HMF含量来综合评价丹参酒炙品的炮制工艺更为合理,这与部分学者针对中药炮制品质量控制研究的结果一致[18]。同时,依据色差值及5-HMF的含量来判断丹参酒炙过程中的炮制终点,亦可避免主观评价的个体差异所带来的不良影响。
综上所述,丹参酒炙过程中丹参酮ⅡA、5-HMF的含量与炮制时间及颜色显著相关,即随着炮制时间增加和温度升高,颜色由红黄色向黄绿色变化,在黑白程度上偏黑色;丹参酮ⅡA含量降低,5-HMF含量升高。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:77-78.
[ 2 ] 万新焕,王瑜亮,周长征,等.丹参化学成分及其药理作用研究进展[J].中草药,2020,51(3):788-798.
[ 3 ] 奚亞亚,郑文华,曲丛丛,等.基于形性与生物活性结合的酒炙丹参炮制程度研究[J].中药材,2019,42(11):2538-2541.
[ 4 ] 崔伟亮,李慧芬,宋梦晗,等.丹参酒炙前后HPLC指纹图谱色谱峰归属比较[J].辽宁中医杂志,2019,46(8):1707-1709.
[ 5 ] 崔伟亮,李慧芬,张学兰,等. UPLC-QE/MS法分析丹参酒炙前后5种质变化合物[J].中成药,2019,41(4):844- 849.
[ 6 ] 谭利平,竹林,黄峥峥,等.差异性炮制方法对丹参药材中丹酚酸B的变化研究[J].世界中医药,2020,15(7):1008-1011.
[ 7 ] 韩易,赵燕,徐明生,等.美拉德反应产物类黑精的研究进展[J].食品工业科技,2019,40(9):339-345.
[ 8 ] 林华坚,张梓豪,孟江,等.干姜及其炮制品色差值与活性成分含量的相关性研究[J].中国药房,2020,31(10):1197-1202.
[ 9 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:31.
[10] 陈磊,彭宁,黄雪松.高效液相色谱法测定黄酒中的5-羟甲基糠醛[J].食品科学,2009,30(24):369-371.
[11] 李云静,张建逵,赵玥,等.黄芩药材颜色及其有效成分的相关性[J].中国医药工业杂志,2017,48(7):1012-1016.
[12] 张乐,潘欢欢,刘飞,等.白术麸炒过程中5-羟甲基糠醛的含量变化规律及其与饮片温度、颜色变化的相关分析[J].中国实验方剂学杂志,2016,22(17):11-14.
[13] 夏满琼,徐瑶,王玉霞,等.“焦三仙”炮制过程中5-羟甲基糠醛的含量变化研究[J].中国医药导报,2017,14(19):8-11.
[14] 李慧芬,宋梦晗,崔伟亮,等.一测多评法测定丹参酒炙前后4种丹参酮类成分的含量[J].山东中医杂志,2018,37(5):416-419,428.
[15] 吴鹏,李慧芬,张学兰,等. HPLC-TOF/MS分析丹参酒炙前后化学成分的变化[J].中国实验方剂学杂志,2016,22(11):6-9.
[16] 刘江亭,李慧芬,崔伟亮,等.酒丹参研究进展[J].山东中医杂志,2018,37(5):432-434.
[17] 方欢乐,陈衍斌,卢新义,等.丹参在炮制大生产过程中丹酚酸B的损失情况研究[J].西北药学杂志,2016,31(5):455-459.
[18] 刘玉杰,仲瑞雪,杨添钧,等.中药炒焦物质基础及其质量评价研究思考与实践[J].中国中药杂志,2014,39(2):338-342.
(收稿日期:2021-03-01 修回日期:2021-06-15)
(編辑:陈 宏)

