α-硫辛酸对胰岛素抵抗HepG2细胞糖代谢紊乱的改善作用
安仙蓉 管俊欢 杨秀丽 吴先进 梁冰


中图分类号 R965;Q493.4 文献标志码 A 文章编号 1001-0408(2021)14-1703-06
DOI 10.6039/j.issn.1001-0408.2021.14.07
摘 要 目的:研究α-硫辛酸对胰岛素抵抗HepG2细胞糖代谢紊乱的改善作用。方法:采用MTT法测定25~1 000 ?mol/L α-硫辛酸对人肝癌细胞HepG2存活率的影响,以确定α-硫辛酸给药浓度。实验设阴性对照组、胰岛素抵抗组(1×10-7 mol/L胰岛素)、联合抵抗组(30 ?mol/L 亚砷酸钠+1×10-8 mol/L胰岛素)和α-硫辛酸低、中、高浓度组。按分组加入α-硫辛酸作用HepG2细胞12 h后,再分别给予相应浓度的亚砷酸钠或/和胰岛素继续培养24 h。采用葡萄糖氧化酶法检测细胞葡萄消耗量,比色法检测细胞己糖激酶、丙酮酸激酶活性,蒽酮法检测细胞糖原含量,Western blot法检测细胞中葡萄糖转运体4(GLUT4)、磷酸化糖原合成激酶3β(p-GSK3β)、GSK3β蛋白表达水平和磷酸化蛋白激酶B(p-Akt)/Akt、p-GSK3β/GSK3β比值。结果:25、50、100 ?mol/L的α-硫辛酸对细胞存活率无明显影响(P>0.05),且细胞存活率均大于96%,故将其作为后续研究的低、中、高浓度。与阴性对照组比较,胰岛素抵抗组、联合抵抗组细胞葡萄糖消耗量、己糖激酶和丙酮酸激酶活性、糖原含量、GLUT4和p-GSK3β蛋白表达水平、p-Akt/Akt和p-GSK3β/GSK3β比值均显著降低,GSK3β蛋白表达水平均显著升高(P<0.05)。与联合抵抗组比较,α-硫辛酸各浓度组细胞葡萄糖消耗量(α-硫辛酸低浓度组除外)、己糖激酶(α-硫辛酸低、中浓度组除外)和丙酮酸激酶(α-硫辛酸低、中浓度组除外)活性、糖原含量、GLUT4(α-硫辛酸低浓度组除外)、p-GSK3β蛋白表达水平和p-Akt/Akt(α-硫辛酸低、中浓度组除外)、p-GSK3β/GSK3β(α-硫辛酸低浓度组除外)比值均显著升高,GSK3β(α-硫辛酸低、中浓度组除外)蛋白表达水平均显著降低(P<0.05),且α-硫辛酸高浓度组细胞糖原含量、GLUT4蛋白表达水平、p-GSK3β/GSK3β比值和α-硫辛酸中、高浓度组细胞p-GSK3β蛋白表达水平的改善效果更明显(P<0.05)。结论:α-硫辛酸对胰岛素抵抗HepG2细胞的糖代谢紊乱具有一定的改善作用,其机制可能与增加葡萄糖消耗,增强糖代谢相关酶活性,提高糖原含量,上调Akt、GSK3β蛋白的磷酸化水平和GLUT4、p-GSK3β蛋白的表达水平,下调GSK3β蛋白的表达水平有关。
关键词 α-硫辛酸;人肝癌细胞HepG2;亚砷酸鈉;胰岛素抵抗;糖代谢紊乱;磷脂酰肌醇3-激酶/蛋白激酶B
Improvement Effects of α-lipoic Acid on Glucose Metabolism Disorder of Insulin Resistant HepG2 Cells
AN Xianrong1,GUAN Junhuan1,YANG Xiuli1,WU Xianjin1,LIANG Bing1,2(1. Dept. of Pharmacology, School of Basic Medical Sciences, Guizhou Medical University, Guiyang 550025, China; 2. Key Laboratory of Environmental Pollution and Disease Monitoring, Ministry of Education, Guiyang 550025, China)
ABSTRACT OBJECTIVE: To study the improvement effects of α-lipoic acid on glucose metabolism disorder of insulin resistant HepG2 cells. METHODS: The effects of 25-1 000 ?mol/L α-lipoic acid on survival rate of human hepatoma cell HepG2 were determined by MTT assay so as to determine the concentration of α-lipoic acid. Negative control group, insulin resistance group (1×10-7 mol/L insulin), combination resistance group (30 ?mol/L sodium arsenite+1×10-8 mol/L insulin), α-lipoic acid low- concentration, medium-concentration and high-concentration groups were set up. HepG2 cells were treated with α-lipoic acid for 12 h and then cultured with corresponding concentration of sodium arsenite or/and insulin for 24 h. The glucose oxidase method was used to detect the glucose consumption, colorimetric method was used to detect hexokinase activity and pyruvate kinase activity, and anthrone method was used to detect glycogen content. Western blot assay was used to detect the protein expression of GLUT4, p-GSK3β and GSK3β as well as the ratio of p-Akt/Akt and p-GSK3β/GSK3β. RESULTS: 25, 50, 100 ?mol/L α-lipoic acid had no significant effect on the survival rates of HepG2 cells (P>0.05), and survival rates of HepG2 cells were higher than 96%, so they were used as the low, medium and high concentration for follow-up study. Compared with negative control group, glucose consumption, the activities of hexokinase and pyruvate kinase, glycogen content, protein expression of GLUT4 and p-GSK3β, the ratio of p-Akt/Akt and p-GSK3β/GSK3β were decreased significantly in insulin resistance group and combined resistance group, while the protein expression of GSK3β was increased significantly (P<0.05). Compared with combination resistance group, the glucose consumption (except for α-lipoic acid low- concentration group), the activities of hexokinase (except for α-lipoic acid low-concentration and medium-concentration groups) and pyruvate kinase (except for α-lipoic acid low-concentration and medium-concentration groups), glycogen contents, protein expression of GLUT4 (except for α-lipoic acid low-concentration group) and p-GSK3β, the ratio of p-Akt/Akt (except for α-lipoic acid low-concentration and medium-concentration groups) and p-GSK3β/GSK3β (except for α-lipoic acid low-concentration groups) were increased significantly in α-lipoic acid groups, while protein expression of GSK3β (except for α-lipoic acid low-concentration and medium-concentration groups) was decreased significantly (P<0.05); glycogen content, protein expression of GLUT4 and the ratio of p-GSK3β/GSK3β in α-lipoic acid high-concentration group as well as the protein expression of p-GSK3β in α-lipoic acid medium-concentration and high-concentration groups were improved significantly(P<0.05). CONCLUSIONS: α-lipoic acid can improve the disorder of glucose metabolism in insulin resistant HepG2 cells, the mechanism of which may be associated with the increase of glucose consumption, the activities of glucose metabolism related enzymes and glycogen content, and expression up-regulation of the phosphorylation levels of Akt and GSK3β protein, the expression of GLUT4 and p-GSK3β proteins, down-regulation of the expression of GSK3β protein.
KEYWORDS α-lipoic acid; Human hepatoma cell HepG2; Sodium arsenite; Insulin resistance; Glucose metabolism disorder; PI3K/Akt
砷是广泛分布于自然界的非金属元素,具有较强的毒性,长期饮用含砷量较高的水会引起慢性砷中毒[1]。已有流行病学调查结果显示,环境砷暴露与糖尿病患病率或发病率增加有关,且砷暴露条件下的糖尿病特征与2型糖尿病相似[2-5]。因此,砷与糖尿病的关系成为砷中毒研究领域的热点问题之一。
α-硫辛酸是一种兼具水溶性和脂溶性的代谢抗氧化物,临床研究发现,该成分可促进体内葡萄糖的吸收,具有调节血糖平衡的作用[6]。此外,α-硫辛酸还能改善糖尿病周围神经病变引起的临床症状(如肢体麻木、烧灼感、刀割样痛、针刺样痛症状)[7-8]。不仅如此,α-硫辛酸还可解除重金属对巯基酶的毒性作用,促进大鼠体内重金属的外排,减少重金属在其体内的蓄积[9]。胰岛素抵抗是2型糖尿病发病的重要原因[10]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路是胰岛素信号转导的重要通路之一,其可通过调节下游葡萄糖转运体4(GLUT4)、糖原合成激酶3β(GSK3β)蛋白的表达来参与细胞的糖代谢过程,该通路的传递受阻与胰岛素抵抗的发生密切相关[11]。本课题组前期研究发现,一定浓度的亚砷酸钠与1×10-8 mol/L胰岛素联合可致人肝癌细胞HepG2产生胰岛素抵抗,提示砷可能具有加速或促进胰岛素抵抗形成的作用。基于此,本研究以α-硫辛酸为受试药物,基于PI3K/Akt信号通路探讨该成分对亚砷酸钠联合胰岛素所致胰岛素抵抗HepG2细胞糖代谢紊乱的改善作用,旨在为砷暴露下糖尿病治疗药物的研发提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括2001HY-6003型CO2培养箱(美国Thermo Fisher Scientific公司)、SW-CJ-2D型超净工作台(浙江苏净净化设备有限公司)、IX71型倒置显微镜(日本Hitachi公司)、Elx800 UV型酶标仪(美国BioTek公司)、722SP型可见分光光度计(上海棱光技术有限公司)、Universal HoodⅡ型凝胶成像分析仪(美国Bio-Rad公司)、WD-9405D型水平摇床和DYCZ-24DN型电泳仪(北京市六一仪器厂)、Allegray 64R Centrifuge型台式高速冷冻离心机(美国Beckman Coulter公司)等。
1.2 主要药品与试剂
亚砷酸鈉对照品(批号H4525,纯度97%)购自山东西亚化学工业有限公司;胰岛素对照品(批号J1001A,纯度96.8%)购自大连美仑生物技术有限公司;α-硫辛酸对照品(批号1077287,纯度>99%)购自美国Sigma公司;DMEM高糖培养基(批号8121089)购自美国Gibco公司;1%青霉素-链霉素双抗(批号J190005)购自美国HyClone公司;胎牛血清(批号19070506)购自浙江天杭生物科技股份有限公司;葡萄糖测定试剂盒(批号20200902137)购自上海荣盛生物药业有限公司;二甲基亚砜(DMSO)、MTT、糖原含量试剂盒、己糖激酶试剂盒、丙酮酸激酶试剂盒、RIPA细胞裂解液、BCA蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)制备试剂盒(批号分别为12130234、1117X054、20200903、20201211、20201112、20200916、20201030、20201116)均购自北京索莱宝科技有限公司;兔抗磷酸化Akt(p-Akt,Ser473位点)、Akt单克隆抗体(批号分别为P31749、4691S)均购自美国CST公司;兔抗GLUT4、磷酸化GSK3β(p-GSK3β,Ser9位点)、GSK3β、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体和辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号分别为NQ30、10016184、00083124、00047696、116154)均购自武汉三鹰生物技术有限公司;快速封闭液、化学发光试剂盒(批号分别为P0252、123119200731)均购自上海碧云天生物科技有限公司;其余试剂均为分析纯,水为超纯水。
1.3 细胞
人肝癌细胞HepG2购自中国科学院上海细胞库。
2 方法
2.1 细胞培养
HepG2细胞复苏后,接种在含10%胎牛血清、1%青霉素-链霉素双抗的DMEM高糖培养基中,置于37 ℃、5%CO2培养箱中培养(培养条件下同)。
2.2 α-硫辛酸的细胞毒性检测
采用MTT法进行检测。取对数生长期HepG2细胞,以6×103个/孔接种于96孔板中,培养24 h;弃去培养基,加入α-硫辛酸终浓度分别为25、50、100、200、500、1 000 ?mol/L的普通培养基(无血清,下同)200 ?L,记为α-硫辛酸组;另设不含药物的阴性对照组和不含细胞、不含药物的调零组,每组设3个复孔。培养12 h后,每孔加入5 mg/mL的MTT试剂20 ?L,培养4 h后,弃去板中液体,加入DMSO 150 ?L,避光振荡10 min,使用酶标仪在490 nm波长处检测各孔的光密度(OD)值,并计算各组的细胞存活率:细胞存活率(%)=(OD实验组-OD调零组)/(OD阴性对照组-OD调零组)×100%。实验重复3次。
2.3 分组与给药
以HepG2细胞为研究对象,建立胰岛素抵抗模型。实验设阴性对照组(只有细胞、不含药物)、胰岛素抵抗组(1×10-7 mol/L胰岛素,浓度参考文献[12]和前期研究结果设置)、联合抵抗组(30 ?mol/L亚砷酸钠+1×10-8 mol/L胰岛素,浓度参考前期研究结果设置)和α-硫辛酸低、中、高浓度组(25、50、100 ?mol/L,浓度参考α-硫辛酸细胞毒性实验结果设置)。将对数生长期HepG2细胞适量,按照各实验所需的密度接种于96孔板、6孔板或者细胞培养瓶中,培养24 h;弃去培养基,α-硫辛酸各浓度组加入相应浓度的含药普通培养基,其他组加入等体积的普通培养基,培养12 h;弃去培养基,联合抵抗组和α-硫辛酸各浓度组加入含有30 ?mol/L 亚砷酸钠和1×10-8 mol/L 胰岛素的普通培养基,胰岛素抵抗组加入含有1×10-7 mol/L胰岛素的普通培养基,阴性对照组加入等体积的普通培养基,继续培养24 h后进行后续检测。
2.4 细胞葡萄糖消耗量和细胞毒性检测
采用葡萄糖氧化酶法和MTT法分别进行检测。取对数生长期HepG2细胞,以6×103个/孔接种于96孔板中,按照“2.3”项下方法分组、给药、培养,另增设不含药物、不含细胞的空白对照组和1×10-8 mol/L胰岛素组,每组设3个复孔。每孔取培养基上清液2 ?L与葡萄糖测定试剂盒中反应试剂进行反应,严格按试剂盒说明书进行操作。反应完成后,使用酶标仪在505 nm波长处检测各孔的OD值,并计算各组细胞葡萄糖消耗量:葡萄糖含量(mmol/L)=(各组OD值/校准液OD值)×校准液浓度,葡萄糖消耗量(mmol/L)=空白对照组细胞上清液中葡萄糖含量-各实验组细胞上清液中葡萄糖含量。葡萄糖消耗量检测结束后,再按“2.2”项下MTT法进行检测并计算每组细胞存活率。实验重复3次。
2.5 细胞己糖激酶、丙酮酸激酶活性检测
采用比色法进行检测。取对数生长期HepG2细胞,以5×106个/瓶接种于细胞培养瓶中,按照“2.3”项下方法分组、给药、培养,每组设3个培养瓶。每组分别收集500万细胞,加入己糖激酶、丙酮酸激酶提取液各1 mL,裂解细胞后,于4 ℃下以8 000×g离心10 min,取上清液30 ?L,与己糖激酶、丙酮酸激酶试剂盒中的反应试剂进行反应,严格按相应试剂盒说明书进行操作。在上清液与己糖激酶反应试剂反应20 s、5 min 20 s时利用可见分光光度计在340 nm波长处检测各组的吸光度(A20 s、A5 min 20 s)值,并计算各组细胞的己糖激酶活性:己糖激酶(U/104 cell)=2.226×(A5 min 20 s-A20 s);在上清液与丙酮酸激酶反应试剂反应20 s、2 min 20 s时利用可见分光光度计在340 nm波长处检测各组的A20 s、A2 min 20 s值,并计算各组细胞的丙酮酸激酶活性:丙酮酸激酶(U/104 cell)=5.226×(A20 s-A2 min 20 s)。实验重复3次。
2.6 细胞糖原含量检测
采用蒽酮法进行检测。取对数生长期HepG2细胞,以5×106个/瓶接种于细胞培养瓶中,按照“2.3”项下方法分组、给药、培养,每组设3个培养瓶。每组分别收集500万细胞,加入糖原提取液750 ?L,裂解细胞后,于25 ℃下以8 000×g离心10 min,取上清液,备用。同时,增设空白组(水)、标准组(0.1 mg/mL葡萄糖標准溶液)。每组取上清液60 ?L,与糖原含量试剂盒中的反应试剂进行反应,严格按试剂盒说明书进行操作。反应完成后,使用酶标仪在620 nm波长处检测各组的A值,并计算各组细胞的糖原含量:糖原含量(?g/104 cell)=0.450×(A实验组-A空白组)/(A标准组-A空白组)/细胞数量×1 000。实验重复3次。
2.7 细胞中p-Akt、Akt、GLUT4、p-GSK3β、GSK3β蛋白表达水平检测
采用Western blot法进行检测。取对数生长期HepG2细胞,以6×105个/孔接种于6孔板中,按照“2.3”项下方法分组、给药、培养,每组设3个复孔。每组弃去上清液,裂解细胞后,于4 ℃下以15 294×g离心10 min,取上清液,采用BCA蛋白浓度测定试剂盒检测各组细胞的蛋白浓度。蛋白于100 ℃煮沸变性5 min。取变性蛋白样品进行SDS-PAGE分离,转膜,经快速封闭液室温封闭30 min后,加入p-Akt、Akt、GLUT4、p-GSK3β、GSK3β单克隆抗体(稀释比例均为1 ∶ 1 000)和GAPDH单克隆抗体(稀释比例为1 ∶ 5 000),于4 ℃孵育过夜;用TBST溶液洗膜10 min×3次,加入HRP标记的山羊抗兔IgG二抗(稀释比例为1 ∶ 5 000),室温孵育1.5 h;用TBST溶液洗膜10 min×3次,经化学发光液显色后,使用凝胶成像分析仪曝光成像。采用Image Lab 5.2.1软件对目的条带进行灰度值分析,计算目标蛋白的表达水平和磷酸化水平:目的蛋白的表达水平=目的蛋白灰度值/GAPDH灰度值,目的蛋白的磷酸化水平=磷酸化目的蛋白灰度值/总目的蛋白灰度值。实验重复3次。
2.8 统计学方法
采用SPSS 20.0软件对数据进行统计分析。数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检测。检验水准α=0.05。
3 结果
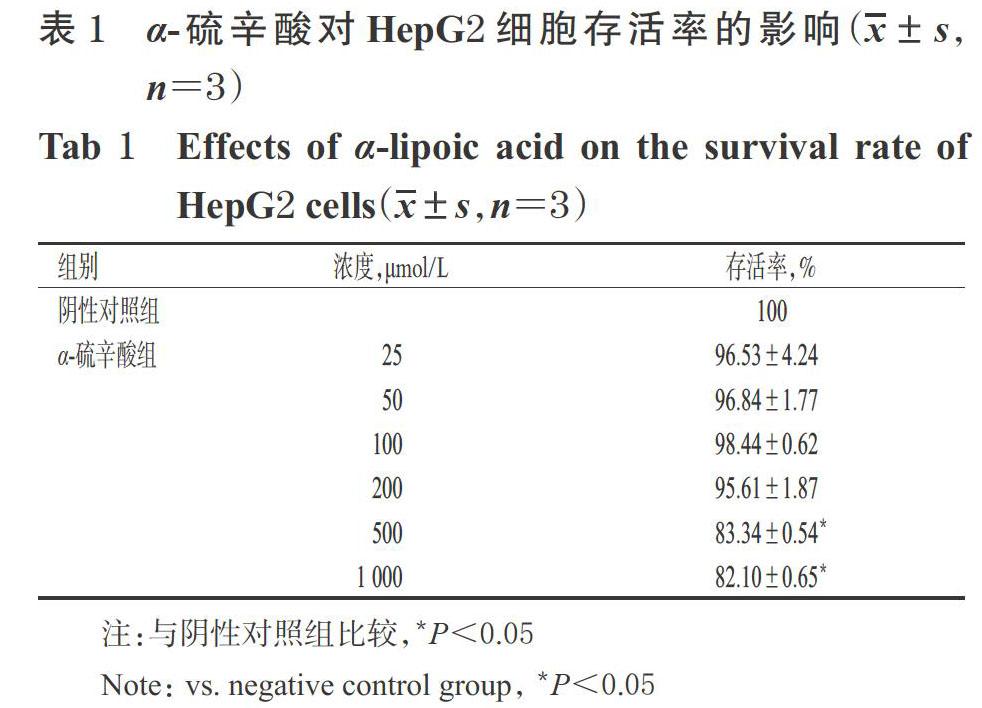
3.1 α-硫辛酸对HepG2细胞存活率的影响
与阴性对照组比较,α-硫辛酸25、50、100 ?mol/L组细胞的存活率均无显著变化(P>0.05),而α-硫辛酸500、1 000 ?mol/L组细胞的存活率均显著降低(P<0.05),详见表1。因此,后续实验选择25、50、100 ?mol/L作为α-硫辛酸的低、中、高浓度。
3.2 α-硫辛酸对HepG2细胞葡萄糖消耗量和存活率的影响
与阴性对照组比较,胰岛素抵抗组、联合抵抗组细胞的葡萄糖消耗量均显著降低(P<0.05),而其余各组细胞的存活率均无显著变化(P>0.05)。与联合抵抗组比较,α-硫辛酸中、高浓度组细胞的葡萄糖消耗量均显著升高(P<0.05),但两者组间比较差异无统计学意义(P>0.05),详见表2。
3.3 α-硫辛酸对HepG2细胞己糖激酶、丙酮酸激酶活性的影响
与阴性对照组比较,胰岛素抵抗组、联合抵抗组细胞的己糖激酶、丙酮酸激酶活性均显著降低(P<0.05)。与联合抵抗组比较,α-硫辛酸高浓度组细胞的己糖激酶、丙酮酸激酶活性均显著升高(P<0.05),详见表3。
3.4 α-硫辛酸对HepG2细胞糖原含量的影响
与阴性对照组比较,胰岛素抵抗组、联合抵抗组细胞的糖原含量均显著降低(P<0.05)。与联合抵抗组比较,α-硫辛酸低、中、高浓度组细胞的糖原含量均显著升高(P<0.05)。与α-硫辛酸低、中浓度组比较,α-硫辛酸高浓度组细胞的糖原含量均显著升高(P<0.05),详见表4。
3.5 α-硫辛酸对HepG2细胞中p-Akt、Akt、GLUT4、p-GSK3β、GSK3β蛋白表达水平的影响
与阴性对照组比较,胰岛素抵抗组、联合抵抗组细胞中GLUT4、p-GSK3β蛋白表达水平和p-Akt/Akt、p-GSK3β/GSK3β比值均顯著降低,GSK3β蛋白表达水平均显著升高(P<0.05)。与联合抵抗组比较,α-硫辛酸各浓度组细胞中GLUT4(α-硫辛酸低浓度组除外)、p-GSK3β蛋白表达水平和p-Akt/Akt(α-硫辛酸低、中浓度组除外)、p-GSK3β/GSK3β(α-硫辛酸低浓度组除外)比值均显著升高,GSK3β(α-硫辛酸低、中浓度组除外)蛋白表达水平均显著降低(P<0.05)。与α-硫辛酸低浓度组比较,α-硫辛酸中、高浓度组细胞中p-GSK3β蛋白表达水平均显著升高(P<0.05)。与α-硫辛酸中浓度组比较,α-硫辛酸高浓度组细胞中GLUT4蛋白表达水平和p-GSK3β/GSK3β比值均显著升高(P<0.05),详见图1、表5。
4 讨论
2型糖尿病主要表现为胰岛B细胞分泌胰岛素不足或外周组织(例如肝、脂肪、骨骼肌)发生胰岛素抵抗[13]。HepG2细胞是人肝癌细胞,其保留了大部分肝细胞生物学特征和代谢特点,是用于研究胰岛素抵抗发生机制和降糖药物作用机制的理想模型[14]。
本研究以α-硫辛酸作为受试药物,探讨其对亚砷酸钠联合胰岛素所致胰岛素抵抗HepG2细胞糖代谢紊乱的改善作用。首先,本研究通过MTT法检测了α-硫辛酸对HepG2细胞的毒性,结果发现,25、50、100 ?mol/L的α-硫辛酸对HepG2细胞的存活率均无明显影响,且细胞的存活率均在96%以上,因此选择25、50、100 ?mol/L作为后续实验中α-硫辛酸的低、中、高浓度。
已有研究表明,胰岛素抵抗时外周组织对葡萄糖的消耗量减少,造成机体血糖升高[15]。本研究通过测定葡萄糖消耗量发现,与阴性对照组比较,联合抵抗组细胞葡萄糖消耗量显著降低,而α-硫辛酸中、高浓度组细胞葡萄糖消耗量均显著高于联合抵抗组,由此说明α-硫辛酸可在一定程度上改善亚砷酸钠联合胰岛素所致的HepG2细胞胰岛素抵抗。
肝是葡萄糖代谢的主要场所之一,其可通过调控糖酵解、糖原合成来维持机体的血糖平衡[16]。己糖激酶是糖酵解途径中控制葡萄糖代谢速率的首个关键酶,丙酮酸激酶是糖酵解过程中催化磷酸烯醇丙酮酸和腺苷二磷酸转变成丙酮酸和腺苷三磷酸的磷酸基转移酶,两者都是糖酵解过程中重要的限速酶[17-18]。当肝细胞内己糖激酶和丙酮酸激酶活性下降时,会导致肝细胞对葡萄糖的利用减少,糖原合成降低,从而引发肝脏胰岛素抵抗[19]。本研究通过检测糖代谢相关酶活性及糖原含量发现,与阴性对照组比较,联合抵抗组细胞的己糖激酶、丙酮酸激酶活性和糖原含量均显著降低,提示细胞糖代谢发生了紊乱;而α-硫辛酸高浓度组细胞的己糖激酶、丙酮酸激酶活性和α-硫辛酸各浓度组细胞的糖原含量均显著高于联合抵抗组,且高浓度组细胞的糖原含量显著高于α-硫辛酸低、中浓度组。这说明α-硫辛酸可通过提高糖代谢相关酶活性和糖原含量来改善亚砷酸钠联合胰岛素所致的HepG2细胞胰岛素抵抗。
Akt是一种丝氨酸/苏氨酸蛋白激酶,Ser473位点的磷酸化是Akt活化的主要标志[20]。当肝细胞受到胰岛素刺激时,Akt蛋白磷酸化被激活,激活的Akt参与调控细胞的葡萄糖转运和糖原合成[21]。GLUT4是糖转运蛋白之一,p-Akt可使GLUT4发生易位,让GLUT4从细胞囊泡中转移并嵌入至细胞膜上,从而把葡萄糖从细胞外转移到细胞内[22]。GLUT4是维系机体血糖平衡的关键因子,故是抗糖尿病的靶点之一[23]。此外,p-Akt可使GSK3β的Ser9位点发生磷酸化,抑制GSK3β蛋白表达,激活细胞的糖原合成[24]。GSK3β可通过磷酸化失活来促进糖原合成,进一步增加细胞对葡萄糖的利用率,从而达到降血糖的目的,故近年来GSK3β被作为治疗糖尿病的新靶点之一[25]。本研究通过Western blot法检测糖代谢相关蛋白的表达水平发现,与阴性对照组比较,联合抵抗组细胞中GLUT4、p-GSK3β蛋白表达水平和p-Akt/Akt、p-GSK3β/GSK3β比值均显著降低,GSK3β蛋白表达水平显著升高。这提示亚砷酸钠联合胰岛素可降低GLUT4蛋白表达,造成葡萄糖转运的障碍,同时下调GSK3β蛋白磷酸化水平,造成糖原合成的异常,从而降低细胞对葡萄糖的利用率,导致糖代谢紊乱的发生。与联合抵抗组比较,α-硫辛酸各浓度组细胞GLUT4(α-硫辛酸低浓度组除外)、p-GSK3β蛋白表达水平和p-Akt/Akt(α-硫辛酸中、低浓度组除外)、p-GSK3β/GSK3β(α-硫辛酸低浓度组除外)比值均显著升高,GSK3β(α-硫辛酸中、低浓度组除外)蛋白表达水平显著降低。这提示α-硫辛酸可通过增加GLUT4蛋白表达来改善葡萄糖转运障碍,同时通过上调GSK3β蛋白磷酸化水平、抑制GSK3β蛋白表达来改善细胞糖原合成的异常,从而增加细胞对葡萄糖的利用率,改善亚砷酸钠联合胰岛素所致胰岛素抵抗HepG2细胞的糖代谢紊乱。
综上所述,α-硫辛酸对亚砷酸钠联合胰岛素所致胰岛素抵抗HepG2细胞的糖代谢紊乱具有一定的改善作用,其机制可能与增加葡萄糖消耗,增强糖代谢相关酶活性,提高糖原含量,上调Akt、GSK3β蛋白的磷酸化水平和GLUT4、p-GSK3β蛋白的表达水平,下调GSK3β蛋白的表达水平有关。本研究结果为砷暴露下糖尿病治疗药物的研发提供了实验基础,但糖代谢过程还受诸多因素调控,砷对糖代谢的影响有待进一步的深入研究加以证实。
参考文献
[ 1 ] KUO C C,MOON K A,WANG S L,et al. The association of arsenic metabolism with cancer,cardiovascular di- sease,and diabetes:a systematic review of the epidemiological evidence[J]. Environ Health Perspect,2017,125(8):087001.
[ 2 ] TSENG C H,TSENG C P,CHIOU H Y,et al. Epidemiologic evidence of diabetogenic effect of arsenic[J]. Toxicol Lett,2002,133(1):69-76.
[ 3 ] RAHMAN M,TONDEL M,AHMAD S A,et al. Diabetes mellitus associated with arsenic exposure in Bangladesh[J]. Am J Epidemiol,1998,148(2):198-203.
[ 4 ] CORONADO-GONZALEZ J A,DEL RAZO L M, GARCIA-VARGAS G,et al. Inorganic arsenic exposure and type 2 diabetes mellitus in Mexico[J]. Environ Res,2007,104(3):383-389.
[ 5 ] HUANG C F,CHEN Y W,YANG C Y,et al. Arsenic and diabetes:current perspectives[J]. Kaohsiung J Med Sci,2011,27(9):402-410.
[ 6 ] GOSSELIN L E,CHRAPOWITZKY L,RIDEOUT T C,et al. Matebolic effects of α-lipoic acid supplementation in pre-diabetics:a randomized,placebo-controlled pilot study
[J]. Food Funct,2019,10(9):5732-5738.
[ 7 ] 程明瑜. α-硫辛酸治療糖尿病周围神经病变患者的临床观察[J].大家健康旬刊,2016,10(4):150-151.
[ 8 ] 赵慧娟,赵令君,孙海峰. α-硫辛酸联合甲钴胺治疗老年糖尿病周围神经病变的临床疗效[J].中国老年学杂志,2017,37(6):1359-1360.
[ 9 ] GHOSH S,MISHRA R,BISWAS S,et al. α-lipoic acid mitigates arsenic-induced hematological abnorm-alities in adult male rats[J]. Iran J Med Sci,2017,42(3):242-250.
[10] GALICIA-GARCIA U,BENITO-VICENTE A,JEBAR S,et al. Pathophysiology of type 2 diabetes mellitus[J]. Int J Mol Sci,2020,21(17):6275.
[11] LUO W,AI L,WANG B F,et al. High glucose inhibits myogenesis and induces insulin resistance by down-regulating Akt signaling[J]. Biomed Pharmacother,2019,120:109498.
[12] 罗明,梁冰,陈文章,等.树豆酮酸A对HepG2细胞体外糖代谢影响[J].中国公共卫生,2016,32(7):928-930.
[13] LAAKSO M. Biomarkers for type 2 diabetes[J]. Mol Metab,2019,27(Suppl):S139-S146.
[14] 黎梓霖,金惠杰,方佳,等.芒果苷对胰岛素抵抗HepG2细胞糖脂代谢的影响[J].中国药房,2021,32(9):1082-1088.
[15] GHASEMI A,NOROUZIRAD R. Type 2 diabetes:an updated overview[J]. Crit Rev Oncog,2019,24(3):213-222.
[16] SHI H,YAO R,LIAN S,et al. Regulating glycolysis,the TLR4 signal pathway and expression of RBM3 in mouse liver in response to acute cold exposure[J]. Stress,2019,22(3):366-376.
[17] OYEDEMI S O,NWAOGU G,CHUKWUMA C I,et al.Quercetin modulates hyperglycemia by improving the pancreatic antioxidant status and enzymes activities linked with glucose metabolism in type 2 diabetes model of rats:in silico studies of molecular interaction of quercetin with hexokinase and catalase[J]. J Food Biochem,2020,44(2):e13127.
[18] LEWANDOWSKI S L,CARDONE R L,FOSTER H R,et al. Pyruvate kinase controls signal strength in the insulin secretory pathway[J]. Cell Metab,2020,32(5):736- 750.
[19] CAO C,LI C,CHEN Q,et al. Physicochemical characte- rization,potential antioxidant and hypoglycemic activity of polysaccharide from Sargassum pallidum[J]. Int J Biol Macromol,2019,139:1009-1017.
[20] WEI Y,ZHOU J,YU H,et al. Akt phosphorylation sites of Ser473 and Thr308 regulate Akt degradation[J]. Biosci Biotechnol Biochem,2019,83(3):429-435.
[21] 宋紫临,吴丽丽,秦灵灵,等. PI3K/Akt信号通路与糖尿病的研究进展[J].世界科学技术:中医药现代化,2019,21(6):1264-1269.
[22] FLORES-OPAZO M,BOLAND E,GARNHAM A,et al. Exercise and GLUT4 in human subcutaneous adiposetissue[J]. Physiological Report,2018,6(22):e13918.
[23] 吴宁,黄密,黄蕴,等.基于GLUT4靶点的抗糖尿病中药研究进展[J].中国药师,2018,21(12):2201-2205.
[24] BEUREL E,GRIECO S F,JOPE R S. Glycogen synthase kinase-3(GSK3):regulation,actions,and diseases [J].Pharmacol Ther,2015,148:114-131.
[25] 吴建军,王顺春.抑制2型糖尿病新靶点-糖原合成酶激酶3及其抑制剂的研究进展[J].中国糖尿病杂志,2018,26(10):864-870.
(收稿日期:2021-03-04 修回日期:2021-06-07)
(编辑:邹丽娟)

