抗可溶性肝抗原抗体阳性肝病患者的临床特征分析
钟艳丹 俞海英 郭银燕 丁巧云 曹兴国 彭姗姗 杨永峰
自身免疫性肝炎(autoimmune hepatitis, AIH)是一种病因不明的肝脏慢性炎症性疾病。AIH的诊断主要基于血清出现多种自身抗体、免疫球蛋白G(immunoglobulin G, IgG)水平和肝组织学改变[1]。国际自身免疫性肝炎小组(IAIHG)制定了AIH的诊断积分系统,用于临床最终诊断[2]。根据血清自身抗体的不同将AIH分为两型:1型AIH(AIH-1)的特征是抗核抗体(ANA)和(或)抗平滑肌抗体(SMA),或抗可溶性肝抗原抗体(抗-SLA)阳性,而2型AIH(AIH-2)是抗肝肾微粒体抗体-1型(抗LKM-1)和(或)抗肝细胞溶质抗原-1型(抗LC-1)阳性[1, 2]。然而,这些自身抗体大多缺乏特异性,在其他肝脏疾病如原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、慢性丙型肝炎(CHB)、慢性乙型肝炎(CHC)、非酒精性脂肪性肝炎(NASH)、药物性肝炎(DILI)、Wilson病等也可表现为抗体阳性[3]。
抗-SLA被认为是AIH的高度特异性标志物,与病情恶化有关[4]。本研究对不同病因肝病患者血清进行抗SLA及相关抗体检测,并对抗SLA阳性患者的临床特征、IAIHG-AIH评分、治疗和结局进行分析。
资料与方法
一、病例选择
对2017年1月至2021年10月在南京中医药大学附属南京医院(南京市第二医院)确诊为AIH、AIH/PBC重叠综合征、PBC、PSC、HCV、HBV、NASH、DILI、Wilson病患者的病历进行回顾性分析。完成自身抗体检测的患者被纳入研究。确诊或可能的AIH诊断参照IAIHG制定的诊断标准[2]。AIH/PBC重叠综合征,PBC、PSC、NASH、DILI和Wilson病的诊断参照文献[4-10]。血清抗-HCV阳性和HCV RNA阳性超过半年诊断为CHC, 血清HBsAg阳性和抗-HBc阳性超过半年诊断为CHB。AIH患者的治疗应答、缓解和复发参照AASLD指南制定的标准[1]。
二、实验室指标检测方法
采用雅培公司化学发光法检测血清抗HCV、HBsAg和抗-HBc。采用日本日立公司7170A特种蛋白全自动免疫仪检测IgG水平。采用罗氏(Cobas Ampliprep/Coasa Taqman)第二代实时PCR法检测HCV RNA和HBV DNA水平。采用间接免疫荧光法检测ANA、抗线粒体抗体(anti-mitochondrial antibody, AMA)、SMA、抗LKM-1。采用蛋白质印迹法检测抗SLA、抗LC-1。
三、统计学方法
采用SPSS 22.0统计软件进行数据处理。计量资料符合正态分布,以均数±标准差表示,采用Student’st检验;分类资料以例数(百分数)表示,采用Chi-squared检验。P<0.05为差异有统计学意义。
结 果
一、不同肝病患者自身抗体检测结果
共纳入853例肝病患者。其中AIH 176例,AIH /PBC 66例,PBC 114例,PSC 2例, CHC 121例,CHB 135例,NASH 104例,DILI 125例, Wilson病10例。患者血清ANA、抗SMA、抗LKM-1、AMA和抗SLA的检测结果见表1。

表1 853例不同肝病患者自身抗体检测结果[例(%)]
二、抗SLA阳性肝病患者的临床和实验室特征
18例抗SLA阳性的肝病患者中位年龄为42岁(4~68)岁,女性15例,其中4例患者确诊肝硬化。根据患者就诊的主诉,有症状的患者10例,无症状的患者8例。患者中7例检测到ANA,3例检测到SMA,6例同时检测到ANA和SMA,均未检测到抗LKM-1和抗LC-1。
3例AIH/PBC患者均有AMA阳性,其中1例患者同时有ANA和SMA阳性,另2例ANA阳性;2例AIH/PBC患者诊断为肝硬化;AIH/PBC患者采用熊去氧胆酸(UDCA)联合免疫抑制治疗(激素和/或硫唑嘌呤),所有患者对治疗均表现出良好的生化反应,其中1例患者在治疗维持期间出现复发。
在11例AIH患者中,9例患者有ANA和(或)SMA阳性;11例患者接受肝活检,其中2例为肝硬化;11例患者接受免疫抑制治疗(激素和/或硫唑嘌呤),均获得生化学缓解,有6例患者复发(停药后5例复发,缓解期1例复发)。
2例PBC患者表现出一些AIH的生化和组织学特征,但不满足AIH/PBC重叠综合征的诊断标准。1例CHB患者和1例DILI患者均伴有IgG水平的升高,是否原发疾病合并AIH值得探讨。所有患者仅用UDCA治疗均获得生化学缓解,随访期间未出现复发。
三、抗SLA阳性和阴性AIH患者的临床表现比较
抗SLA阳性患者和抗SLA阴性患者的年龄、性别、平均随访时间、血清ALT、总胆红素和IgG水平、肝硬化的发生率、IAIHG简化评分等差异均无统计学意义(均P>0.05)。根据该评分系统,11例抗SLA阳性患者均诊断为AIH(9例确定,2例可能),而153例抗SLA阴性患者被诊断为AIH(74%确定,19%可能)。抗SLA阳性患者对免疫抑制治疗的初始反应稍好,但停药后或缓解期间复发的概率较高,两组差异无统计学意义(均P>0.05)。同样,在抗SLA阳性和抗SLA阴性的患者中,因终末期肝病并发症引起的死亡率无统计学差异。见表2。
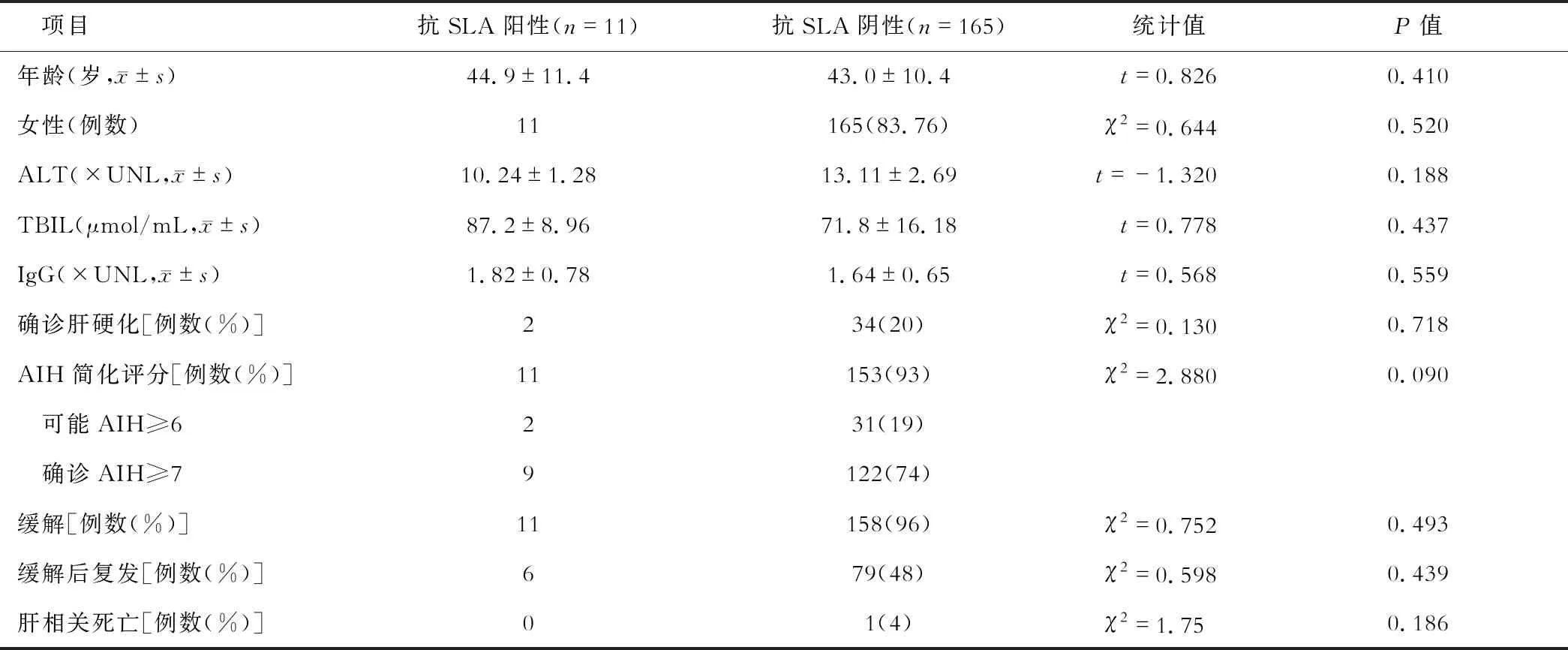
表2 抗SLA阳性和阴性AIH患者的临床特征、AIH评分、治疗反应和预后比较
讨 论
Manns等[11]首次在23例慢性活动性肝炎患者中检测到抗SLA。后来陆续有研究评估了来自不同国家的AIH患者抗SLA的临床意义和发生率,在这些研究中,抗SLA的阳性率为7%~30%[12-15]。
本研究中,18例抗SLA阳性患者中,AIH 11例,AIH/PBC 3例,PBC 2例,CHB 1例,DILI 1例,结果提示抗SLA对AIH有特异性。Eyraud等[16]评估了7年间收集的3975例患者的血清样本,发现仅81例患者检测到抗SLA阳性,其中72例患者诊断为AIH或AIH/PBC、AIH/PSC重叠综合征,另有3例丙型肝炎,3例DILI和3例患者诊断不明。Wies等[15]对2000例患有各种肝脏和非肝脏疾病的患者进行了评估,只在AIH和AIH/PBC重叠综合征患者中检测到抗SLA。在非AIH患者中检测到抗SLA的报道极少。但Vitozzi等[17]报告CHC患者中抗SLA阳性率为10%(5/48),高于其他已发表的文章,这种差异可能与检测抗SLA技术的敏感性不同有关。
Eyraud等[16]报道了3例抗SLA阳性的DILI患者,本研究中仅发现1例DILI患者出现抗SLA阳性。各种药物,包括呋喃妥因、双氯芬酸、米诺环素和阿托伐他汀,可以诱发AIH,仅根据实验室检查结果和组织学的表现难以区分。药物诱导的AIH患者需要短期治疗,停药后很少出现复发。另一方面,真正的AIH、非药物伪装患者需要长期的免疫抑制,并且在停止治疗后复发是很常见的。基于目前文献报道的抗SLA的高度特异性,考虑这些抗SLA阳性患者很有可能是药物诱发的AIH,而不是真正的DILI。
本研究中,2例PBC患者检测到抗SLA。Manns等[11]研究发现23例抗ALA阳性肝病患者中,有5例检测到AMA,其中3例有抗SLA和AMA同时阳性。抗SLA在PBC中的临床意义尚不完全清楚。本研究2例PBC患者对UDCA治疗有效,并且在随访期间没有复发。
本研究结果显示,在AIH患者中抗SLA的检出率为6%。其中,单独抗SLA阳性率为1%(2/176),与先前人群研究中的4%(18/434)相似[12]。此外,本研究观察到所有抗SLA阳性AIH患者的初始治疗均出现生化学缓解,与文献报道的免疫抑制治疗的有效率较高相符[12-14]。这提示抗SLA阳性与患者初始治疗应答不佳无关。研究显示抗SLA阳性AIH患者复发率高,预后差,肝移植术后复发率高[4, 12, 18]。
Baeres等[12]指出抗SLA与诱导缓解或停药后复发率较高有关,本研究也发现抗SLA阳性患者的复发率较高。
总之,本研究发现抗SLA的检出率很低,但对AIH的特异性很高。需要进一步建立大规模的人群研究来证实抗SLA对AIH预后的判断价值。

