抗凝血酶Ⅲ活性与慢加急性肝衰竭患者人工肝治疗结局的相关性
毛燕群 周学士 王霞 苏婷婷 杜合娟 过小叶 周凌霄 邱源旺
慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)是在慢性肝病基础上,由各种诱因引起以急性黄疸加深、凝血功能障碍为主要表现的综合征,常合并多种并发症,短期病死率达40%~70%[1]。人工肝支持系统用于肝衰竭和终末期肝病的治疗中,可以明显提高肝衰竭患者90 d和5年的生存率[2]。一项多中心研究发现人工肝治疗组患者的短期生存率显著高于常规治疗组,7 d和28 d的胆红素下降幅度也显著高于常规治疗组[3]。临床上人工肝的疗效一般用短期疗效和远期疗效判定[4]。抗凝血酶Ⅲ是肝脏合成的抗凝血系统中的重要因子,研究发现抗凝血酶III活性可以预测急性肝衰竭的发生和肝切除术后患者90 d的病死率,能早期全面地反映ACLF患者肝功能损伤的程度,可一定程度上预测患者短期死亡的风险[5-7]。本研究通过回顾性分析抗凝血酶Ⅲ活性与人工肝短期疗效、ACLF患者短期预后的相关性,探讨抗凝血酶Ⅲ活性在人工肝治疗中的应用价值。
资料与方法
一、研究对象
收集2012年1月1日至2019年6月30日无锡市第五人民医院感染科ICU收治的236例行人工肝治疗的ACLF患者。其中男性130例,女性106例,年龄为(49.3±13.9)岁。根据人工肝治疗30 d的疗效将患者分为人工肝治疗有效组和无效组,根据ACLF患者90 d生存结局分为生存组和死亡组。ACLF诊断标准参照《肝衰竭诊治指南(2018年版)》[8]。入选标准: ①ACLF早、中期,凝血酶原活动度(PTA)为20%~40%的患者;②接受人工肝治疗的患者。排除标准:①活动性出血或弥漫性血管内凝血者;②对治疗过程中所用血制品或药品如血浆、肝素和鱼精蛋白等严重过敏者;③血流动力学不稳定者;④心脑血管意外所致梗死非稳定期者;⑤血管外溶血者;⑥严重脓毒症者。本研究通过无锡市第五人民医院伦理委员会审核批准(无锡五院论文伦字第2020-003-1)。
二、治疗方案
ACLF患者予保肝退黄、促肝细胞再生等治疗,乙型肝炎相关的肝衰竭予恩替卡韦0.5 mg/d或口服富马酸替诺福韦二吡呋酯300 mg/d抗病毒,均未使用糖皮质激素。肝衰竭早期及中期,在患者家属签署血液净化知情同意后行人工肝治疗。①血浆置换治疗方案:股静脉留置双腔导管建立静脉通道,用日本来富恩JUN 55X血液净化设备,德国费森尤斯Plasma Flux P2 dry型血浆分离器,血泵流速100~120 mL/min,血浆分离流速24 mL/min,置换血浆3000 mL。②血浆置换联合CRRT治疗方案:血浆置换结束后,更换管路,继续CRRT治疗8 h,使用费森尤斯AV600S净化器。血液流速200 mL/min,置换液流速3 000 mL/h。③双重血浆分子吸附(DPMAS)治疗方案:采用德国费森尤斯Plasma Flux P2 dry型血浆分离器,中国健帆HA330-Ⅱ一次性使用血液灌流器,健帆BS330一次性使用血浆胆红素吸附器,血泵流速100~120 mL/min,血浆分离流速24 mL/min,治疗时间4 h。④血浆透析滤过(PDF)治疗方案:采用日本旭化成EC30血浆分离器,血泵流速100~120 mL/min,置换液流速900 mL/h,透析液流速800 mL/h,血浆泵流速300 mL/h,5%碳酸氢钠流速80 mL/h,废液泵流速2080 mL/h,治疗时间7 h。治疗前后监测血生化、凝血、血常规指标。人工肝抗凝方案:普通肝素抗凝,负荷剂量20 mg,追加剂量10 mg/h,治疗结束前半小时停用抗凝剂,动态监测APTT指标。
三、抗凝血酶Ⅲ活性检测
试剂盒购自法国STAGO公司。将抗凝血酶Ⅲ活性检测试剂盒中的试剂混匀。采用通用定标血浆STA@- Unicalibrator 复溶定标血浆。采集患者血浆标本无需稀释,将其装载到凝血分析仪中以检测抗凝血酶Ⅲ活性,并进行质控试验以确保试验结果的准确性和重复性。
四、观察指标
记录入院时丙氨酸转氨酶(ALT)、总胆红素(TBil)、白蛋白(Alb)、总胆汁酸(TBA)、国际标准化比值(INR)、抗凝血酶Ⅲ活性、血红蛋白(Hb)、白细胞计数(WBC)、血小板计数(PLT)。评估入院时的肝性脑病分级、MELD评分。每周监测上述指标。记录人工肝治疗后30 d的疗效,患者病程90 d的生存结局。临床疗效判断标准[4]:①有效:临床症状和体征明显缓解;肝性脑病减轻;消化道症状显著改善;INR<1.5;血清胆红素降低;血氨降低;MELD评分下降。②无效:临床症状未见明显减轻,TBil和INR改善不明显。
五、检验仪器和试剂
INR和抗凝血酶Ⅲ活性检测使用法国STAGO公司的STA-R全自动凝血分析仪,试剂使用原装配套试剂盒。生化学指标测定使用德国西门子医疗生产的全自动生化分析仪ADVIA2400。血常规测定使用日本希森美康公司生产的XN-10型全血细胞分析仪。
六、统计学方法
结 果
一、ACLF患者的临床基线资料
236例行人工肝治疗的ACLF患者中,男性130例,女性106例,人工肝治疗后30 d评估疗效,有效139例,无效97例。两组患者性别、年龄、TBil、ALT、TBA、Alb、PLT、Hb、肝性脑病分级差异无统计学意义,WBC、INR、抗凝血酶III活性、MELD评分、人工肝治疗模式在两组差异有统计学意义。见表1。根据患者病程90 d的生存结局,将患者分成生存组和死亡组,生存组173例,死亡组63例,两组患者性别、年龄、ALT、TBA、Alb、Hb、PLT、肝性脑病分级差异无统计学意义,WBC、TBil、INR、抗凝血酶Ⅲ活性、MELD评分、人工肝治疗模式两组差异有统计学意义。见表2。
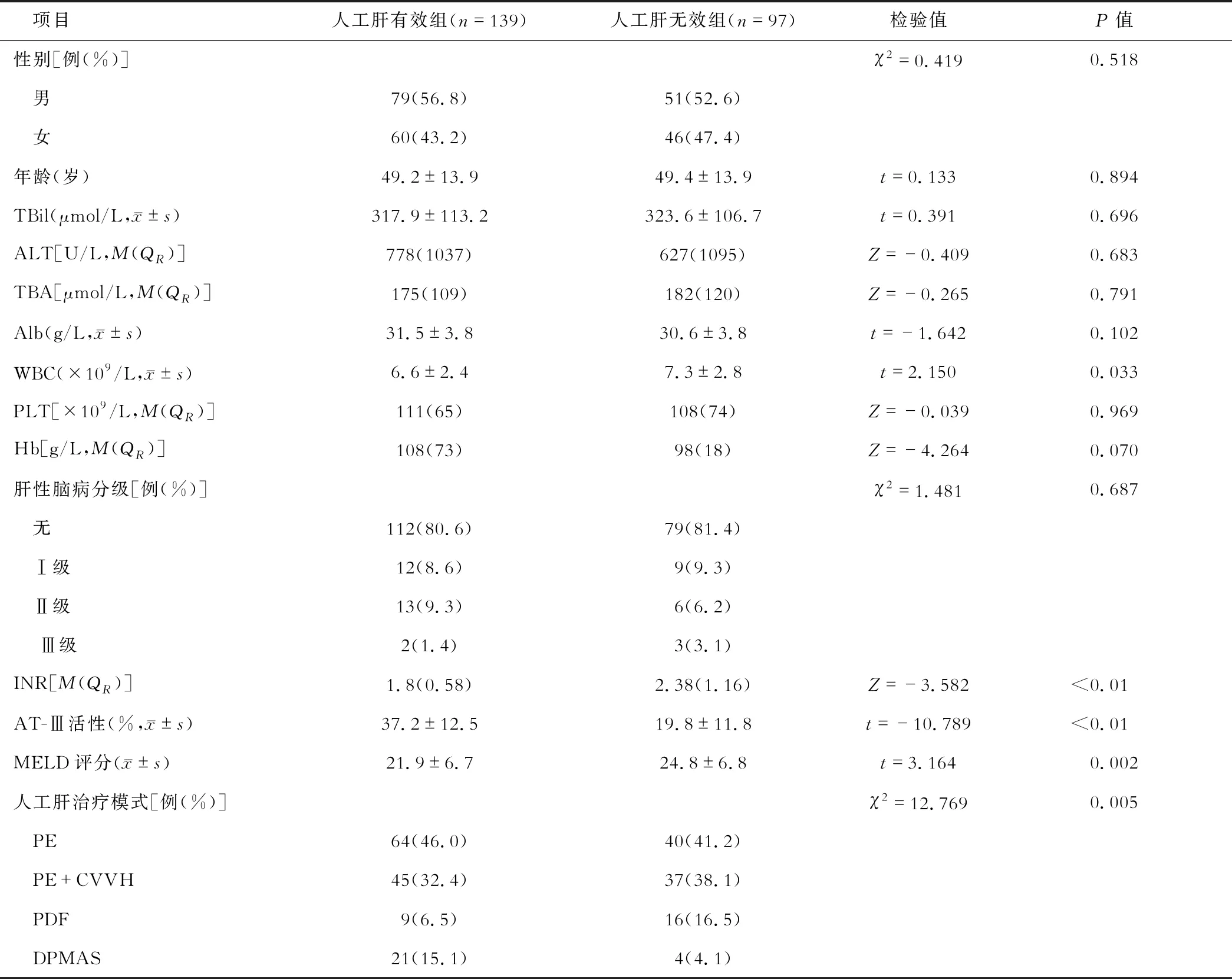
表1 人工肝治疗有效组和无效组患者的基线临床资料对比
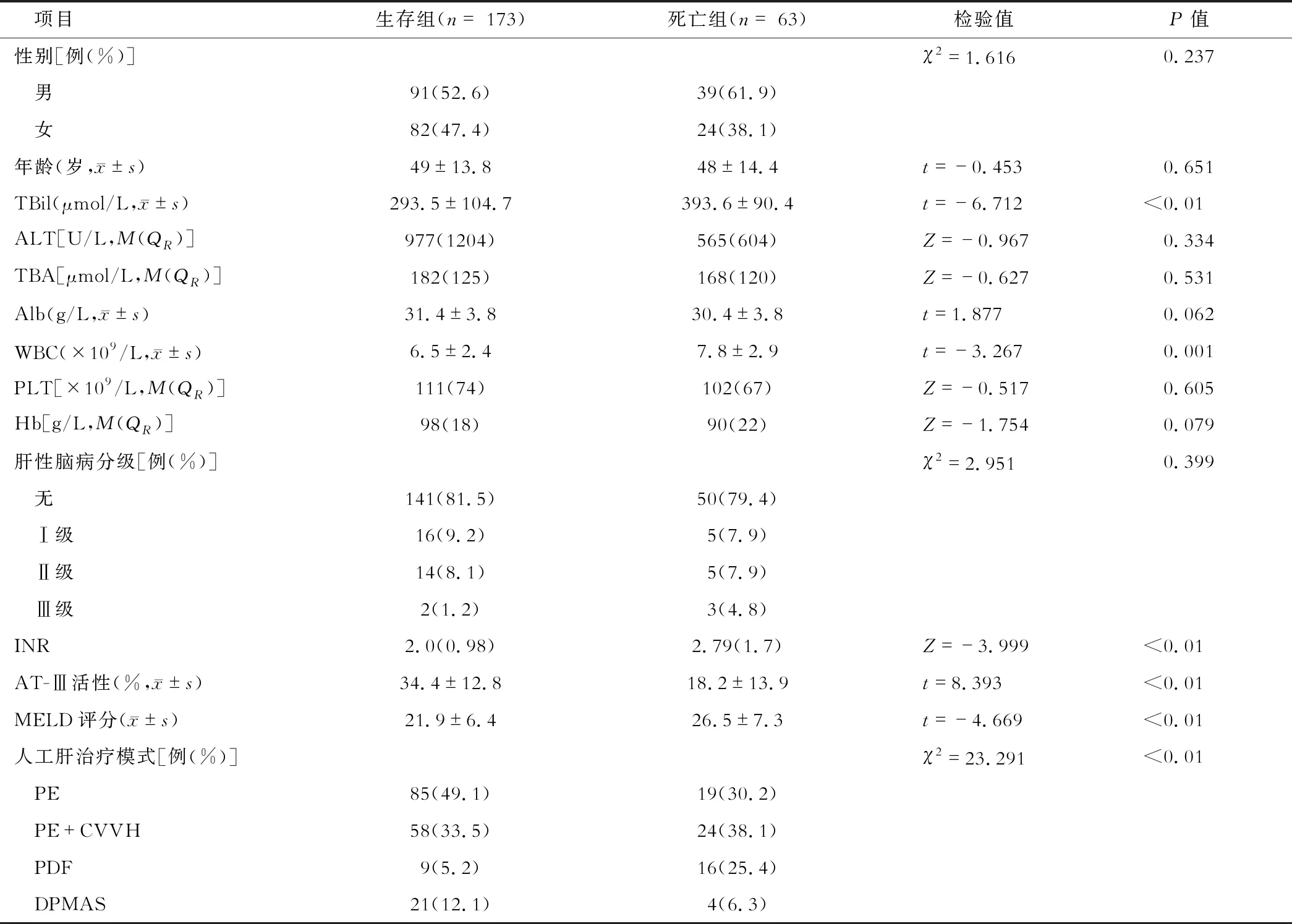
表2 生存组和死亡组患者的基线临床资料对比
二、Logistic回归分析人工肝短期疗效的影响因素
分析年龄、TBil、ALT、Alb、WBC、PLT、INR、AT-Ⅲ活性、MELD评分、人工肝模式对ACLF患者人工肝疗效的影响。多因素分析结果显示AT-Ⅲ活性是影响人工肝短期疗效的独立影响因素。见表3。

表3 Logistic回归分析人工肝短期疗效的影响因素
三、Logistic回归分析ACLF患者90 d生存结局的影响因素
分析年龄、TBil、ALT、Alb、WBC、PLT、INR、AT-Ⅲ活性、MELD评分、人工肝模式对ACLF患者90 d生存结局的影响。多因素分析结果显示TBil、INR、AT-Ⅲ活性、MELD评分是影响患者90 d生存结局的独立影响因素。见表3。
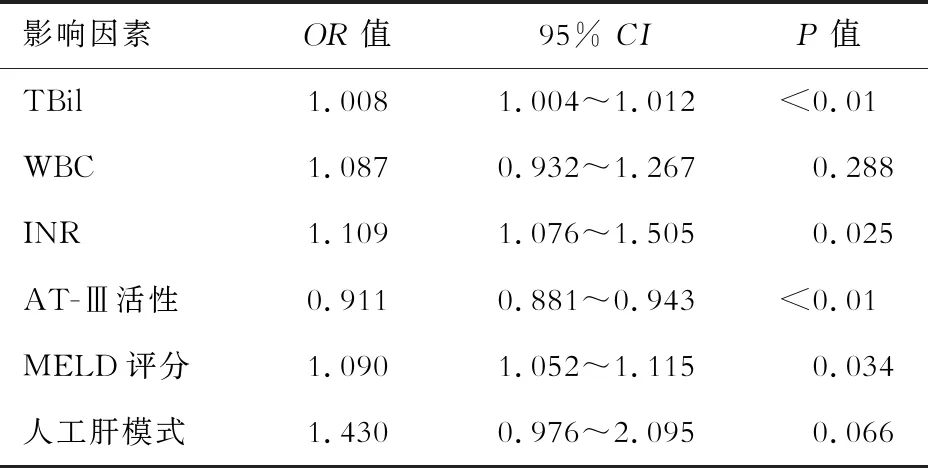
表4 Logistic回归分析ACLF患者90 d生存结局的影响因素
讨 论
研究发现,肝衰竭患者肝移植术前术后行人工肝治疗可以提高患者的生存率[9,10]。随着李氏人工肝技术在国内的推广,人工肝在终末期肝病患者的救治中发挥着重要作用。ACLF患者预后的影响因素也是国内外学者研究的热点。如中性粒细胞/淋巴细胞比率可预测短期病死率[11],甲胎蛋白预测人工肝后肝衰竭患者30 d病死率的ROC曲线下面积为0.739,提示甲胎蛋白可以作为肝衰竭患者人工肝后病死率的预测因素[12]。大样本研究发现CLIF评分系统、MELD评分系统能较好地预测患者短期病死率,比单一的预测指标更全面、更精确[13]。上述的研究结果提示肝衰竭患者的短期生存结局也能间接评价人工肝疗效。抗凝血酶Ⅲ是肝脏合成的含丝氨酸蛋白酶抑制剂的抗凝因子,与凝血酶通过肽键结合,形成抗凝血酶Ⅲ-凝血酶复合物,使凝血酶失活[14]。抗凝血酶Ⅲ是抗凝血系统中最重要的因子,参与调控血液凝固和纤维蛋白溶解。抗凝血酶Ⅲ的活性在DIC、严重肝病患者中降低,会导致血液净化肝素抗凝效果无法达到预期[15]。本研究发现抗凝血酶Ⅲ活性和ACLF患者的结局相关,可以较好的预测ACLF患者的生存率[7]。
本研究中,人工肝治疗ACLF患者30 d的有效率为58.9%。基线资料中,治疗有效组和治疗无效组患者性别、年龄、TBil、ALT、TBA、Alb、PLT、Hb、肝性脑病分级没有显著差异,提示人工肝治疗的效果往往和患者基线指标没有相关性,而监测上述指标的动态变化更有临床意义。在肝衰竭发病早期,肝脏炎症反应剧烈,肝细胞坏死严重,转氨酶明显升高;在肝衰竭中晚期,患者的主要表现是胆红素、胆汁酸淤积、低蛋白血症、代谢紊乱等,而人工肝治疗的最佳时机应该在肝衰竭早中期。单因素分析WBC、INR、抗凝血酶Ⅲ活性、MELD评分、人工肝治疗模式与人工肝疗效有关。回归分析发现,抗凝血酶Ⅲ活性是影响人工肝疗效的独立影响因素。有研究发现,MELD评分系统预测ACLF患者90 d病死率较CLIF评分系统准确[16],INR也是肝衰竭预后的独立影响因素[17]。上述指标在发病早期能反映肝细胞坏死程度,进而能反映人工肝的疗效。而INR和MELD评分在患者进展至很严重的阶段才表现出较好的特异性,而抗凝血酶Ⅲ活性在肝病加重的早期即明显下降,所以抗凝血酶Ⅲ活性比INR和MELD评分能更好的预测人工肝疗效。
患者90 d病死率为26.7%。单因素分析发现生存组和死亡组患者入院时的WBC、TBil、INR、抗凝血酶Ⅲ活性、MELD评分、人工肝治疗模式有显著差异。多因素分析发现TBil、INR、抗凝血酶Ⅲ活性、MELD评分、人工肝治疗模式是影响患者90 d生存结局的独立影响因素。Yi[18]等也发现TBil、INR是影响患者90 d生存率的独立影响因素,与本研究结果一致,提示患者基线TBil水平、INR能反映肝脏功能损伤的程度。人工肝治疗模式的不同对肝衰竭患者体内炎性介质清除的效率有差异,所以临床常根据患者的病情而采取个体化治疗。本研究也发现抗凝血酶Ⅲ活性和MELD评分与患者90 d病死率有关。
综上所述,抗凝血酶Ⅲ活性可以预测人工肝治疗的短期疗效,并在一定程度上预测患者短期死亡的风险。但其在ACLF患者治疗中的应用价值还需要随机、对照、多中心的大样本做进一步研究。

