1例骶前延伸至腹膜后巨大畸胎瘤病例报告及文献回顾
高勇,张迪,周茜,阿衣古丽·阿依提哈孜,彭慧,任东林△
1宁乡市人民医院肛肠外科 湖南长沙410600
2中山大学附属第六医院肛肠外科 广东广州510655
3乌鲁木齐市中医医院南门分院 新疆乌鲁木齐830000
骶前畸胎瘤(sacrococcygeal teratoma,SCT)是骶前间隙最常见的先天性实体生殖细胞肿瘤,起源于全能细胞或原始生殖细胞[1]。婴幼儿患病率为1/(20000~40000),男女比例约为1:(3~4)[2]。根据Altman分类法,骶前畸胎瘤根据其不同生长部位、肿瘤大小可分为四型:Ⅰ型(显露型)最多见(46%),肿瘤由尾骨尖向臀部生长,出生时骶尾部就可见肿瘤,大小不一;Ⅱ型(内外混合型)较多见(35%),肿瘤位于骶骨前,同时向盆腔和臀部生长;Ⅲ型(哑铃状内外混合型)约占9%,肿瘤向盆腔生长,骶尾部和耻骨上均可触及肿瘤,常出现直肠及尿道压迫症状;Ⅳ型(隐匿型)约占10%,肿瘤只位于骶前,只向盆腔生长,体表观察不到肿物[3]。不同分型的骶前畸胎瘤适宜的治疗方式、手术入路及其预后不尽相同[4]。
SCT大多为良性,恶变率为1%~2%,随年龄增长而增加。本病起病隐匿,发病初期大多症状不明显,常常在体检时发现。当病程较长、肿瘤体积较大时,肿瘤会压迫盆腔和腹内器官从而产生一系列症状,如便秘、排尿困难以及腹部、会阴部、骶尾部疼痛或浮肿等[1]。疾病的诊断主要依靠CT和MRI。CT可以提供关于肿瘤的大小、密度及其总体空间关系以及是否有远处转移等信息。MRI对软组织的分辨率较高,对于肿瘤良恶性的鉴别有一定的参考价值,同时可以协助临床医师判断肿瘤的侵犯范围以及其与周围组织结构的关系。直肠腔内超声也运用于临床,可协助判断骶前肿物是否侵及肠壁以及侵犯的具体层次[4-5]。SCT无论是原发还是复发,手术切除都是首选的治疗方法,恶变时还需结合放疗或化疗。手术入路和手术切除方式的选择取决于肿瘤的大小、位置和性质,手术原则强调完整切除,不完全切除会增加恶变的风险[3]。总体而言,骶前畸胎瘤的预后欠理想,与该病发病隐匿、误诊率高、医师对疾病的认识不足等因素密切相关。
中山大学附属第六医院肛肠外科团队已治疗超过50例骶前畸胎瘤病例,并对这些患者的临床表现、诊治过程及预后进行了归纳总结,积累了丰富的临床经验。本文展示1例由骶前延伸至腹膜后的特殊畸胎瘤病例治疗过程和影像学资料,拟论述巨大骶前畸胎瘤的诊治要点,以供广大同道进一步了解、分析及探讨该类疾病。
1 临床资料
患者男性,35岁,因“骶前畸胎瘤术后30年,发现骶尾部肿物2月余”就诊。自诉30年前曾行骶尾部畸胎瘤手术(具体术式不详)。2个月前于当地医院就诊发现骶尾部肿物,骶尾部皮肤无疼痛、瘙痒,无流脓、破溃及红肿。偶有排粪困难,无肛门坠胀感及排粪不尽感,无发热、头晕、腹痛等症状,小便正常。当地医院检查提示“骶前肿物”。2021年1月12日于中山大学附属第七医院行CT检查示:骶尾椎前方巨大占位,考虑畸胎瘤复发。为进一步检查及治疗,遂至本院就诊,于2021年2月19日以“骶前肿物”收住院治疗。
既往史:患者自诉有幽闭恐惧症,无法完成MRI扫描。
冶游史:患者否认不洁性生活史及同性恋性行为史。
肿瘤家族史:家族成员无相关肿瘤病史。
入院查体:腹部平坦,腹式呼吸,未见曲张静脉及手术瘢痕,无腹部膨隆、压痛、反跳痛,肠鸣音正常。骶尾部见手术瘢痕及一肿物隆起,无红肿破溃。肿物质软,边界欠清,活动度一般,不可推动,无触痛。直肠指诊:直肠黏膜光滑完整,直肠后方可触及一肿物,质韧,指尖无法触及上缘,肿物位置固定,活动性差。退出指套未见明显染血。
实验室及影像辅助检查:血常规、肝肾功能及肿瘤标志物未见明显异常,心肺功能经麻醉科评估可耐受手术。钡灌肠造影检查结果示:1.腹腔巨大占位(结直肠肠管受推压移位);2.结肠灌肠造影未见明显异常。直肠彩超检查结果示:肛管、直肠未见明显异常声像;骶前肿物请结合CT/MRI检查。全腹部CT平扫+增强+3D检查结果示:骶前肿块,考虑畸胎瘤;腹盆腔管状高密度影,考虑良性病变,淋巴管囊肿?CTA:肠系膜下动脉受压上抬,余未见异常。术前CT影像见图1。
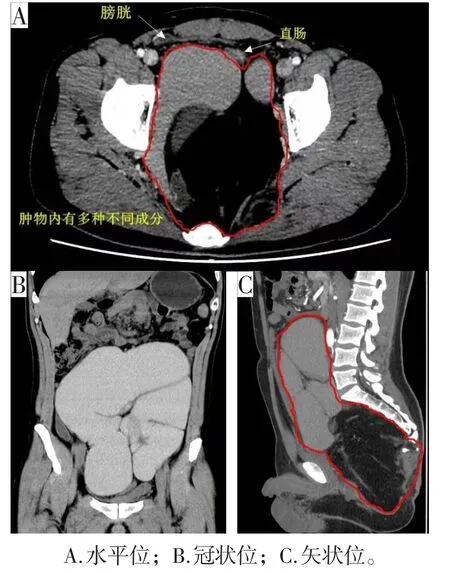
图1 术前腹部CT显示巨大骶前肿物
2 治疗
2.1 手术过程
患者全身麻醉成功后,先取截石位,常规消毒铺无菌巾,作腹部正中25 cm切口入腹并悬吊皮肤,置入切口保护套。探查见腹膜后一巨大肿物,压迫结肠至上腹部,肿物与周围界限清晰,在腹膜后蔓延至盆腔,将膀胱与直肠推压至前方。鉴于肿物体积巨大,同时有多个囊腔,遂决定分段切除。先经腹将延伸至盆腔入口处的肿物切除,同时将腹膜关闭,然后经骶完成直肠后肿物的切除。超声刀切开后腹膜,显露肿物,沿肿物边缘小心剥离,注意不要损伤肠管。在骨盆入口处将腹膜后的肿物完整切除(见图2),以大量温蒸馏水、甲硝唑冲洗腹盆腔,关闭腹膜,并留置一根引流管。再次检查腹腔无出血,清点器械无误后逐层关闭腹部切口。由于肿物将膀胱推压明显,为保护输尿管,术中请泌尿外科医师经输尿管镜下行双侧输尿管置管。

图2 完整切除的肿物腹腔部分
变换体位为折刀位,常规消毒铺无菌巾,按照术前检查结果提示,先用标记笔标记手术切口,长度为由肛门左侧至尾骨尖约8 cm。电刀切开皮肤、皮下组织,于肛门外括约肌外侧进入坐骨肛管间隙。超声刀游离周围组织,暴露骶前肿物。探查发现肿物与尾骨粘连紧密,并且穿过肛提肌向盆腔蔓延。超声刀紧贴肿物离断部分肛提肌,仔细游离肿物与周围组织,并切断尾骨,继续往深部剥离,最终完整切除剩余肿物(见图3),术中随时进行直肠指诊,防止直肠损伤,用碘伏溶液及生理盐水冲洗创面(见图4),于骶前放置2根引流管,彻底止血后重建肛提肌。用3-0可吸收线间断缝合肛周皮下组织,以缝线褥式缝合皮肤(见图5)。

图3 完整切除的肿物骶前部分

图4 完整切除肿物后骶前创面

图5 术毕骶尾部切口外观
2.2 术后处理
术后禁食1周,经中心静脉给予肠外营养支持,因病灶范围巨大,切除后存在空腔出血可能,遂要求患者卧床1周。术后第1、3、5天常规抽血复查水、电解质及炎性指标。常规床旁换药,引流液少于10 mL后拔除切口引流管。术后第15天拆除切口缝线,切口一期愈合。术后病理结合形态及免疫组化标记结果提示:(腹腔肿物)成熟型囊性畸胎瘤;(骶前肿物)成熟型囊性畸胎瘤。
2.3 术后随访
患者术后半年返院复查,创面愈合良好(见图6),患者诉排粪较前顺利,控便功能无异常,复查腹部CT示骶尾部腹膜后肿物已完整切除,未见残留和复发征象(见图7)。
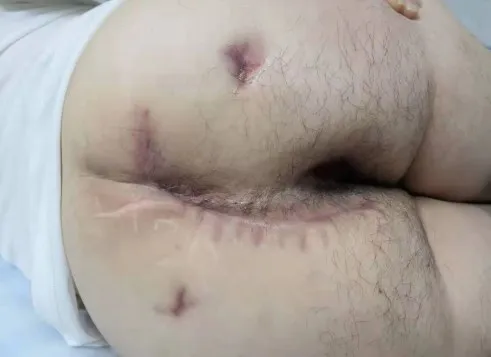
图6 术后半年骶尾部创面外观

图7 术后 6个月腹部CT
3 讨论
3.1 骶前畸胎瘤(SCT)概述
畸胎瘤起源于早期胚胎多能干细胞,是胎儿和新生儿最常见的肿瘤,通常由三个生殖细胞层组成,有多种组织类型。畸胎瘤可发生在全身各处组织,包括性腺、前纵隔、腹膜后和会阴区等,最常见于骶前。根据组织学特点和分化程度,畸胎瘤可分为成熟和不成熟两类,其中20%~25%的病例为未成熟型畸胎瘤[6-9]。SCT占所有儿童畸胎瘤病例的近40%,其中75%~80%见于女童[8]。胎儿SCT可于孕早期进行早期诊断。80%新生儿SCT可于出生后的第一个月进行诊断[9]。
SCT具有遗传特性(常见于父子或父女相传),可同时伴有尾骨缺损、膀胱输尿管反流、直肠后脓肿和肛门直肠狭窄等尾椎、泌尿道或肛管直肠畸形[10]。主要影像学特征为椎骨和尾骨单侧或中央发育畸形,并无影像学可见的软组织钙化[11-13]。未成熟型SCT局部复发和恶变发生率较成熟型概率增加[14]。除外科手术外,虽然目前尚无治疗SCT的标准化疗或放疗方案,但术后放化疗可以提高SCT恶变患者的生存率。如恶性骶尾癌切除后,顺铂和布莱霉素化疗后患者生存率可达60%。故放化疗依旧是恶性骶前畸胎瘤的有效治疗策略之一。同时,对于难以完整切除的恶性SCT,放化疗也可显著延长患者的生存时间。然而,放化疗在恶性SCT治疗中的应用指征及长期疗效仍需要进一步的大样本研究分析[15]。SCT的预后取决于是否彻底切除肿瘤以及肿瘤的病理类型。在随访中,复发SCT为恶性时常表现为AFP升高,复发为良性时血清CA125升高[6,16]。
不同时期诊断的SCT,具有不同的特点。儿童SCT往往因新生儿SCT发病隐匿未发现,随着年龄增长,肿瘤增大出现相应症状而被诊断,或与新生儿SCT手术切除不完全而复发有关。与新生儿大部分SCT为良性相反,儿童SCT恶性比例高[17]。胎儿SCT可导致难产、早产甚至死亡,与肿瘤可使羊水过多而引起子宫过度扩张、胎儿贫血水肿而产生心力衰竭以及胎儿发育不良等因素有关。新生儿、儿童SCT生长过程中往往容易因肿瘤侵犯周围组织,如骶神经孔、椎间孔、脊柱等,从而导致脊椎发育障碍,并产生一系列相关症状。超声检查是胎儿SCT产前筛查和诊断的最佳方法,可疑病例应进一步完善CT和MRI明确诊断[18]。胎儿SCT一经诊断,需要新生儿科、产科及结直肠肛门外科等多学科联合会诊进行综合评估,以确保母体及胎儿的安全,并建议对胎儿SCT进行干预,包括手术切除、射频消融、血管激光消融和血管酒精硬化等,以改善胎儿预后[18]。在儿童发育过程中,侵入周围组织的畸胎瘤往往已经恶变,手术无法切除,需要同时进行放化疗和辅助化疗[19-22]。
成人SCT常与儿童SCT隐匿未被发现有关,随年龄增长,肿瘤逐渐增大而症状逐渐明显,或与儿童SCT切除不完全而复发有关。通常病史较长,缺乏典型的临床症状和体征而较难诊断。临床症状如排粪、排尿异常及骶尾部疼痛等的出现往往与肿瘤体积逐渐增大,对周围组织产生压迫或局部发生感染有关。临床上成人SCT因其位置的特殊性,容易误诊为肛瘘[6,14]。但成人SCT往往良性居多,成人恶性SCT可以选择完全切除术,即使出现复发,也可以选择再次切除[23]。
3.2 SCT常规手术方法选择及本例患者的手术方式选择
SCT手术方式的选择需要考虑诸多因素,包括肿瘤的位置(S3以上或以下)、肿瘤与周围结构(骶尾骨、骨盆侧壁和内脏器官)的关系、肿瘤发生恶变的可能性以及患者的整体情况等。当SCT位于S3以下,直径<8 cm,距离肛缘<8 cm者选择经骶尾入路(经骶Kraske入路,暴露骶前直肠后间隙,切除范围包括尾骨及部分骶骨),有利于充分暴露术野[10,24];SCT位于S3以上或侵入至周围组织器官者,可选择开放或腹腔镜手术的经腹入路或经骶尾联合入路,以完整切除肿瘤[25]。其他术式包括腹会阴结合、腹骶联合[5,26]。腹腔镜手术等微创手术可以缩短住院时间,减少术后并发症,减少损伤,减轻术后疼痛及降低感染发生率[27]。SCT术后并发症包括神经性膀胱(15%)、切口感染(11%)、盆底感觉障碍(7%)、大便失禁(7%)、大出血(4%)、输尿管损伤、广泛软组织感染、出血再手术和阳痿等[28-30]。Beak等[31]的一项关于1 708例骶前肿物(其中155例畸胎瘤)手术并发症的综述表明,经腹开放手术的术后并发症发生率为13.2%,经骶尾入路相关的术后并发症发生率为7.2%,经腹(开放和腹腔镜)为19.3%,联合治疗(腹骶联合)为24.7%。虽然不同入路并发症发生率不尽相同,但手术入路方式的选择需根据肿瘤大小和位置进行综合考量。
不同手术入路各有利弊,术者应熟知各种入路的解剖特征以完整切除肿瘤、避免相关并发症。经腹入路手术时需注意预防骶前出血,该处为骶中血管及骶前静脉丛分布区域。分离肿瘤时需谨慎,仔细结扎每处血管,同时保护重要神经分支。经骶尾入路时,手术时取俯卧位或折刀位,在骶骨部作一弧形切口,暴露骶骨、尾骨、肛尾韧带。当SCT体积较小可不用切断括约肌或耻骨直肠肌时,可从骶骨旁进入切除肿瘤。如切除困难可切除尾骨后再进入肛提肌上部间隙进行肿瘤的切除。但关于是否切除尾骨,存在争议。Rajapandian等[26]认为切除尾骨会增加手术时间,延长切口愈合时间,增加切口感染率,甚至有发生肠疝的风险。因此,与尾骨无明显粘连以及与骶尾骨前缘距离1 cm以上的SCT无需切除尾骨。巨大肿瘤的切除,可分离骶神经后切除S4、S5,以免损伤骶神经。经骶尾入路的最大并发症亦为出血。对于肿瘤囊肿样病变,如囊肿已突破到直肠则需经骶骨引流脓肿后行分期手术。经腹骶联合手术常用于切除巨大直肠后畸胎瘤,该术式最严重优点是可结扎骶中血管,便于止血。常先经腹游离直肠后上端肿瘤并缝合腹壁改俯卧位或折刀位,再经骶入路切除骶前肿瘤。
对于巨大SCT,根据肿瘤所处的位置[32],若不能通过单一切口切除,可采用经腹(腹腔镜或开放手术)及骶尾入路联合切除。Alyousef等[27]报道过1例巨大SCT(11.5 cm×8.8 cm×12.3 cm)病例,采用腹腔镜经腹及骶尾入路联合切除。此肿瘤穿过左侧肛提肌进入左侧坐骨直肠窝,并蔓延至尾骨,未见骨质破坏及脊椎内肿瘤入侵,属于Altman Ⅳ型(隐匿型)。肿瘤将直肠挤向右侧,将膀胱、子宫挤向前方,并将阴道拉长。MRI及PET-CT均未提示恶性及转移倾向。术中经腹腔镜分离肿瘤至盆腔后,体位改为俯卧位,于尾骨左侧作一切口至后正中线,经骶尾入路完整切除肿瘤。Alyousef等通过采用腹腔镜经腹及骶尾入路联合方式,在腹腔镜下将腹腔内巨大肿瘤分离至盆腔,减少了对腹部的损伤,缩短了住院时间及创面愈合时间。
对于特殊SCT,需要制定个体化手术治疗策略。Sheng等[7]认为,对于特殊巨大SCT,需要进行分期手术。第一阶段:完整切除骶前肿物并进行结肠造口,术后进行切口换药。第二阶段:术后1周后开始进行清创、负压引流并将大腿皮瓣转移至骶尾部创面。第三阶段:术后18个月后进行造口回纳手术。Wood等[33]认为对于向周围蔓延的巨大骶前良性肿瘤,如经骶神经孔向骶椎蔓延者,尤需注意保证彻底剥离肿瘤,使其完整切除的同时尽可能减少对周围组织(肌肉、神经、血管等)的损伤,以保障术后肛门功能的恢复。
本例患者5岁时有SCT病史,具体病史及手术方式不详,查体可见骶尾部瘢痕,考虑既往手术经骶尾入路可能性大。根据SCT发病特点[6,14,23,33]考虑此次发病为儿童SCT复发。术前已进行综合评估,尚无恶变证据,影像学检查结果显示肿瘤与周围界限清晰,从腹膜后蔓延至盆腔,将膀胱与直肠推压至前方。此肿物比Alyousef等所报道的畸胎瘤体积更大,并呈多囊样改变,腹腔镜下切除存在局限性,故选择经腹行开放手术。鉴于病程较长,从骶前延伸至腹膜后,体积巨大(14.9 cm×12.2 cm×18.6 cm),同时有多个囊腔,遂决定分段切除,并采用经腹联合骶尾入路的方式。
3.3 骶前畸胎瘤的转归
尽管诊断技术、外科手术和放化疗方案正逐步优化,SCT恶性复发仍然是导致生存率低的一个主要问题。研究显示,成熟型、未成熟型和恶性SCT复发率依次为10.8%、9.1%和28.6%[7]。成熟型SCT切除后复发为恶性的主要是卵黄囊瘤。复发大多发生在术后1~6年,有些发生在初诊20年内。研究显示,在单变量分析中,初次手术未能完全切除和组织恶性变是复发的主要危险因素,且复发率随肿瘤体积的增加而增加。至于其他因素,如Altman法的分型、组织学不成熟、诊断年龄都不被认为是SCT复发的危险因素。而尾骨完全切除是否为危险因素,目前尚存在争议[16,18,33]。复发患者便秘的发生率和严重程度都有所增加,可能与手术损伤盆腔神经丛有关,具体机制尚不清楚。
SCT的恶变比例随年龄增长而增加。在恶性畸胎瘤中,血清中甲胎蛋白(AFP)、人类绒毛膜促性腺激素(HCG)和糖基抗原19-9(CA19-9)的含量显著升高[34],但血清学生物标志物在骶前畸胎瘤术后随访中的价值需要进一步评估。无论组织病理学结果是成熟型、未成熟型还是恶性,均建议对这些患者进行至少5年的多学科随访,特别是复发患者,包括定期体检、血清学监测和影像学监测[35]。
3.4 骶前畸胎瘤诊断治疗的展望
详细的影像学检查、对解剖结构和SCT病变特征的熟练掌握对于手术方式的优化以保证肿瘤的完全切除至关重要[32]。此外,借助于持续更新的生物学技术手段,如下一代基因测序和非侵入性产前检测是临床诊断SCT等先天性疾病的基础。目前已有的产前基因检测方法包括羊水和绒毛膜绒毛取样(CVS)等。通过对遗传性疾病的早期识别,可对患病胚胎进行早期干预,如子宫内基因治疗、子宫内纳米颗粒交互的位点特异性基因组编辑、子宫内干细胞治疗、经胎盘的药物转移和产前外科手术等。CRISPR/Cas9等DNA修复技术在产前纠正胎儿遗传缺陷方面具有巨大的潜力。自1983年以来,已有20例骶尾部畸胎瘤通过宫内分流、开放胎儿手术、经皮引流、热凝、射频消融和激光消融等手术进行治疗。研究表明,胎儿畸胎瘤切除术可以逆转胎儿胎盘积水。然而,由于缺乏高证据等级的临床应用研究报道,产前基因检测及对遗传性疾病的早期干预还没有被广泛使用[36]。
总之,及时发现、尽早治疗对于改善SCT预后具有重要意义。同时,对该病发生、进展规律认识上的深层次研究及手术设计的优化对于SCT的治疗效果至关重要。