砷胁迫对狭叶香蒲生理生态及砷亚细胞分布的影响
张晋龙,黄颖,吴丽芳,龚云辉,刘云根, ,王妍, ,杨思林
1.西南林业大学生态与环境学院,云南 昆明 650224;2.云南省山地农村生态环境演变与污染治理重点实验室,云南 昆明 650224
砷(As)污染主要来源于人为活动和地球化学行为。随工业技术的发展,As污染环境问题日渐严重(Marques et al.,2011)。中国有超过1900万人面临As污染地下水的威胁(Rodriguez-Lado et al.,2013)。水生植物作为水生态系统中的初级生产者,对重金属有一定的吸收作用,为防止重金属的毒害,植物将吸收的大部分重金属滞留在根部,减少向地上部分的转移量,来降低重金属对茎叶生理生态的影响(Caldelas et al.,2012)。与此同时,植物会在亚细胞水平上对重金属进行选择性分布,Gerald(2015)研究发现烟草吸收的As大部分被固持在根的细胞壁上,陈同斌等(2005)则发现砷主要分布在蜈蚣草羽叶的胞液中,尚德荣等(2013)也得出藻体胞液是砷的主要储存部位。以上研究结果表明,As在不同植物中的亚细胞分布具有较大的差异。植物生理生态特征是评价胁迫环境下植物耐受限度的重要指标。重金属进入植物体内会导致细胞产生大量的活性氧(ROS),从而诱发氧化应激反应,而丙二醛(MDA)是膜脂过氧化的产物,其含量多少不仅可以反映膜脂损伤程度,也可间接反映植物组织抗氧化能力的强弱(罗洁文等,2016)。此外,植物体内具有有效的抗氧化机制,如:超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等组成的抗氧化酶系统,可清除因重金属产生的过多的ROS,其活性与植物逆境下的耐受性有重要关系(胡拥军等,2015)。另有研究表明当 As胁迫超出植物的耐受限度时,会损伤光合细胞器,影响叶绿素合成,造成植物光合作用、呼吸作用等各种生理代谢发生紊乱,进而导致植物生长发育受阻(Mishra et al.,2016;Ali et al.,2020;廖晓勇等,2007)。
虽然关于 As对植物生理生态的毒害作用已有大量的研究(Praveen et al.,2019;Kofronova et al.,2019),在亚细胞水平上的研究多见于 As亚细胞分布和细胞结构损伤(Feng et al.,2015;陈璐等,2015;廖晓勇等,2007),但对于As的富集转移、亚细胞分布和生理生态之间内在联系的研究目前偏少。狭叶香蒲(Typha angustifolia L.)为国内外广泛分布并用于水质净化的多年生草本挺水植物,具有生物量大、繁殖速度快、根系发达且适应能力强的特点,研究表明野外重金属污染区域采集的狭叶香蒲地上部分As含量可达156.19 mg·kg−1,且对Pb、Zn、Ni等的富集均高于普通植物(陈天等,2020),任伟等(2019)研究也表明,狭叶香蒲对土壤中的 As吸收作用大于固定作用,是一种较为理想的富集重金属的挺水植物。因此本实验以狭叶香蒲为研究对象,通过室内水培模拟实验,探究As胁迫下狭叶香蒲生理生态响应以及As在狭叶香蒲体内的富集、转移和亚细胞分布特征,从多角度阐明狭叶香蒲对 As的耐受性和解毒机制,为水体As污染修复提供相应的理论依据。
1 材料与方法
1.1 实验材料
供试植物狭叶香蒲(Typha angustifolia L.)购买于昆明市花卉市场,花盆(上口径19 cm,下口径13 cm,高23 cm)和定植篮(直径20 cm,内径15.5 cm,高6 cm,底径13.5 cm)均网上购买且为塑料制品,鹅卵石购买于石料厂。培养液采用改良Hoagland配方,As以 Na2HAsO4·7H2O(分析纯)的形式添加。
1.2 实验设计
实验地点位于云南省西南林业大学。筛选生物量和高度基本一致的植株植于盆内,花盆顶部置放定植篮和鹅卵石以固定植物。采用改良 Hoagland营养液预培养 15 d 后,设置(0、0.5、2、5、10 mg·L−1)5个不同的As处理(以As计),每个处理设置3个平行,每个平行种3株植物。所有处理营养液均为1 L,每天补充去离子水使水位保持一致,每周更换一次培养液,培养60 d后进行样品采集。
1.3 测定指标及方法
1.3.1 狭叶香蒲生长指标的测定
将采集的样品分离为地上和地下部分,用 20 μmol·L−1的 EDTA-2Na 溶液浸泡地下部分 20 min,然后用去离子水冲洗干净,地上部分直接用去离子水冲洗,吸水纸吸取植株上的水分,测量其长度和鲜质量。
1.3.2 狭叶香蒲亚细胞组分的分离及As含量的测定
狭叶香蒲的亚细胞组分分离参照 Wang et al.(2015)方法:按料液比1∶10的比例,称取1 g处理后的鲜样,加入10 mL提取液[250 mmol·L−1蔗糖,50 mmol·L−1Tris-HCL (pH 7.4),1 mmol·L−1二硫赤藓糖醇 (C4H10O2S2)]在4 ℃下研磨匀浆。①将匀浆液在300 g下离心2 min,沉淀为细胞壁及未破碎残渣(F1);②将①上清液在2000 g下离心15 min,沉淀为细胞核与叶绿体组分(F2);③将②上清液在10000 g下离心20 min,沉淀为线粒体组分(F3),最后上清液为可溶性组分(F4)(含细胞质、细胞液、核糖和蛋白等)。全部操作在4 ℃下进行。所有组分及植物鲜样用15 mL硝酸浸泡隔夜,采用湿法消解(VHNO3∶VHCLO4=3∶1,酸均为分析纯),将样品消解至澄清,用去离子水过滤定容至50 mL,用双道原子荧光光度计(AFS-810,北京吉天仪器有限公司)测定 As含量,根据测定结果计算富集系数和转运系数,计算公式如下:
富集系数 (Bioconcentration factor,BCF)=狭叶香蒲组织内ω(As)/营养液中ρ(As)
转运系数 (Translocation factor,TF)=狭叶香蒲地上部ω(As)/狭叶香蒲地下部ω(As)
1.3.3 光合色素及光合作用参数的测定
参照易心钰的方法测定并计算叶绿素 a、b和类胡萝卜素含量,以及计算叶绿素a/b的值(易心钰,2018)。
使用便携式光合测定系统(LI-6400XT,美国LI-COR)测定叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间 CO2浓度(ci)等光合作用参数。测定光照强度为 1000 μmol·m−2·s−1。
1.3.4 抗氧化酶活性及MDA含量的测定
参照陈天等(2019)的方法测定 SOD、POD活性及MDA含量,CAT活性采用分光光度法测定。
1.4 数据分析
采用Excel 2016对原始数据进行基础处理和整理,研究中单因素方差分析和相关性分析均用SPSS 21.0完成(P<0.05显著性差异水平,P<0.01极显著性差异水平),文中所有图均由Origin 2019绘制完成。
2 结果与分析
2.1 As胁迫下狭叶香蒲生长特征的变化
由表1可知,狭叶香蒲的生长指标均随As处理质量浓度的增加呈先上升后下降的趋势。在 2 mg·L−1As处理时株高显著高于对照组(P<0.05),为对照组的114.05%;根长和地上、地下鲜重均在5 mg·L−1As处理下达到最大值,分别为对照组的133.93%、129.09%、158.11%;当 As质量浓度为10 mg·L−1时,狭叶香蒲的生长指标与对照组无显著性差异,促进作用消失。
2.2 As胁迫对狭叶香蒲光合色素含量及光合作用的影响
如图1A—C所示,随着As质量浓度的增加,叶绿素a(ωa)、叶绿素b(ωb)、类胡罗卜素(ωh)含量均呈先上升后下降的趋势,在2 mg·L−1As处理时均出现最大值,分别为 2.19、0.75、1.23 mg·g−1,为对照组的1.84、2.15、1.77倍,光合色素含量在所有 As处理下均显著高于对照组(P<0.05)。结果表明,As≤10 mg·L−1处理促进了狭叶香蒲叶片中光合色素含量的增加。ωa与 ωb的比值则是先降低后升高,在 10 mg·L−1As处理时显著高于对照组(P<0.05)。
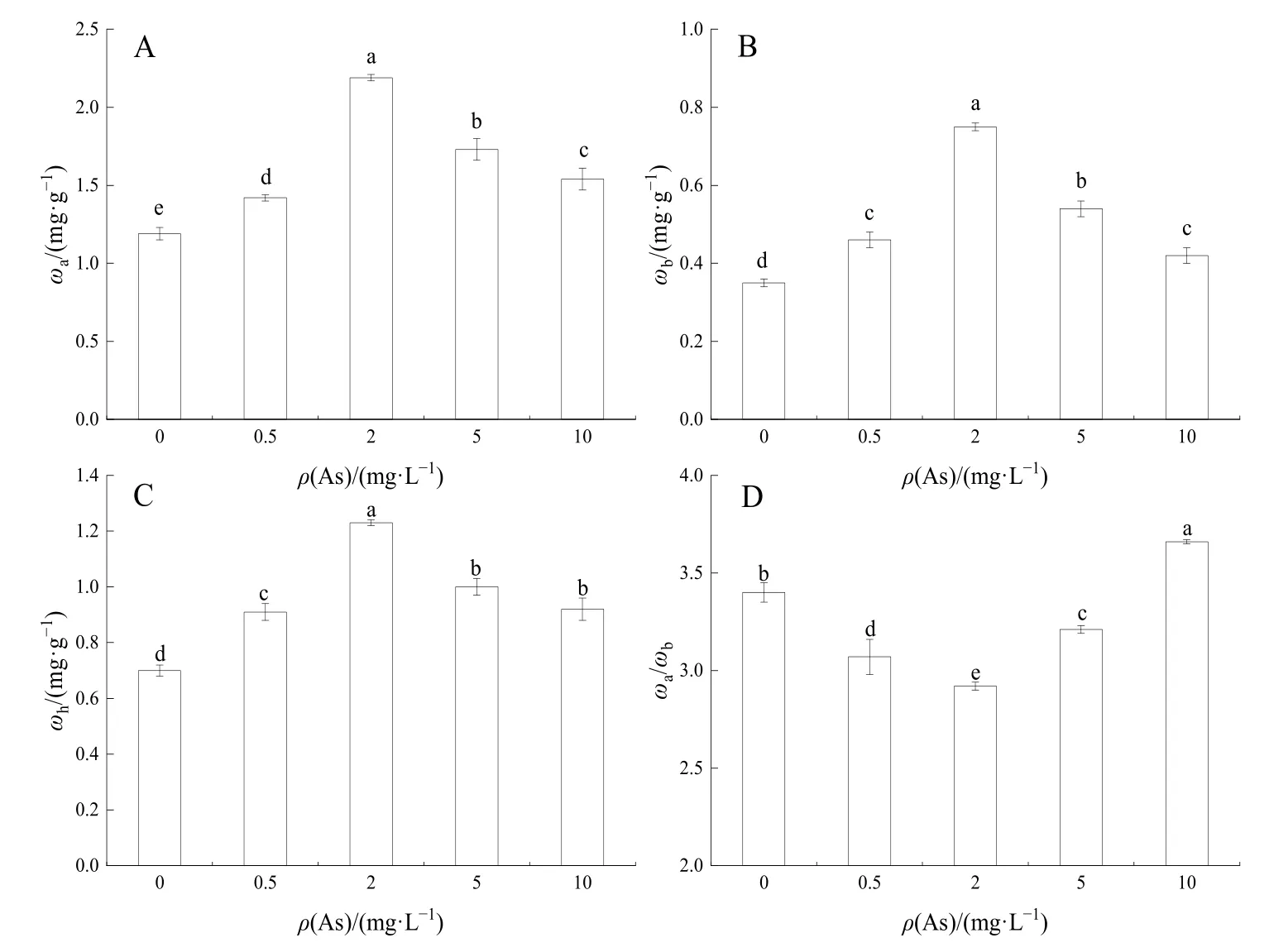
图1 不同As浓度下狭叶香蒲光合色素含量Fig.1 Photosynthetic pigment content of Typha at different As concentrations
在不同As质量浓度胁迫下,狭叶香蒲的Pn随As胁迫浓度的增加先上升后下降(图2A),但均显著高于对照组(P<0.05),在2 mg·L−1处理时有最大值,为 20.18 μmol·m−2·s−1,相比对照组增加了18.55%。Gs和Tr与Pn变化规律一致,所有处理均显著高于对照组(P<0.05),且都在 5 mg·L−1As处理时达到最大值,分别为 0.68 mol·m−2·s−1、13.33 mmol·m−2·s−1, 较 对 照 组 显 著 提 升 了 96.75%、36.04%。ci随着 As质量浓度(除 0.5 mg·L−1As处理外)的升高而显著升高(P<0.05),各处理间与对照均存在显著差异(P<0.05),在10 mg·L−1As处理时有最大值,为对照组的111.99%。

图2 不同As浓度下狭叶香蒲光合参数的变化特征Fig.2 Changes of photosynthetic parameters of Typha at different As concentrations
2.3 As胁迫对狭叶香蒲叶片抗氧化酶活性及MDA含量的影响
在不同As处理下狭叶香蒲的SOD活性、POD活性、CAT活性(图3A—C)均随As质量浓度的增加呈先上升后下降的趋势。SOD、POD在 0.5 mg·L−1As处理时有最大值,分别为 224.68 U·g−1、19.63 KU·g−1,较对照组提高了 37.58%、20.42%,CAT 活性在 2 mg·L−1As处理时显著增加(P<0.05),为对照组的1.22倍;随着As浓度的进一步升高,狭叶香蒲叶片抗氧化酶活性逐渐降低,在10 mg·L−1As处理时,SOD、POD、CAT活性分别比对照组低26.17%、32.67%、18.05%,差异显著(P<0.05)。MDA含量随As质量浓度的升高先升高后降低再升高,在 5 mg·L−1处理时有所降低,在 10 mg·L−1As处理时达到最大值(72.93 nmol·g−1),是对照组的3.56倍。

图3 不同As浓度下狭叶香蒲叶片抗氧化酶活性及MDA含量的变化Fig.3 Changes of antioxidant enzyme activity and MDA content in leaves of Typha under different As concentrations
2.4 As在狭叶香蒲中的富集转移特征
由图4A可知,As胁迫浓度与狭叶香蒲叶、根中的As质量分数呈正相关,在10 mg·L−1As处理时达到最大值,为3.11、77.92 mg·kg−1,在所有As处理下,狭叶香蒲根的 As质量分数均较大,是叶的10.04—25.08倍。由图4B可知,狭叶香蒲叶和根的As富集系数均随As质量浓度的升高而降低,最高 As处理(10 mg·L−1)比最低 As处理(0.5 mg·L−1)的叶、根富集系数分别低了 86.76%、66.94%。由图4C可知,As在狭叶香蒲体内的转移系数随着处理浓度的增加逐渐下降,为0.10—0.04。上述表明As主要累积在狭叶香蒲根部。
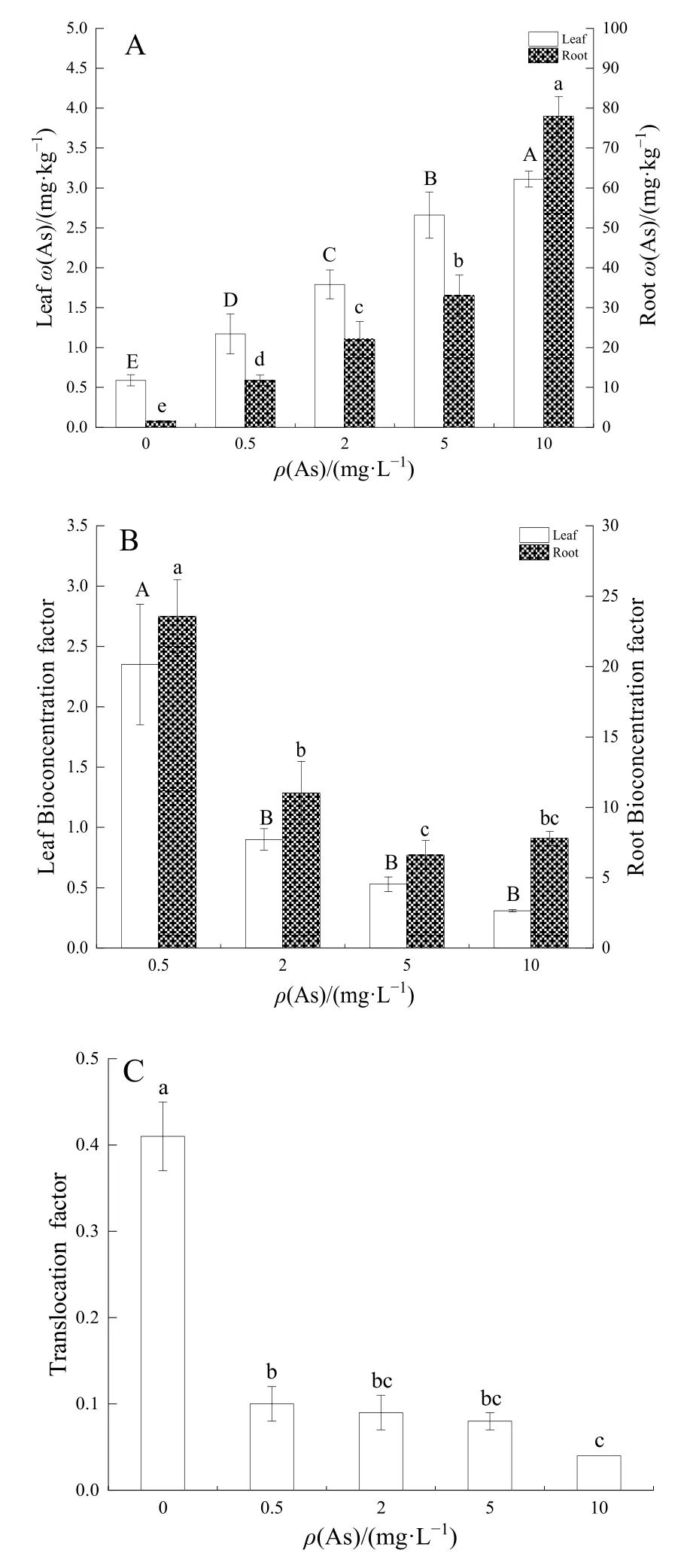
图4 As在狭叶香蒲体内的富集转移特征Fig.4 Enrichment and transfer characteristics of As in Typha
2.5 狭叶香蒲中As的亚细胞分布
由表2可见,无As添加时,狭叶香蒲叶亚细胞组分中As的分布较为平均,其质量分数为0.09—0.22 mg·kg−1;随着外源As的添加,叶各亚细胞组分中 As的质量分数均有所增加,当 As浓度为10 mg·L−1时,细胞壁和可溶性组分增幅最大,分别为对照组的7.15倍和6.28倍,而细胞核、叶绿体和线粒体中增加较少,平均增加了3.05倍,且As质量浓度为 2—10 mg·L−1时,F2、F3 中 As的质量分数并无显著增加。
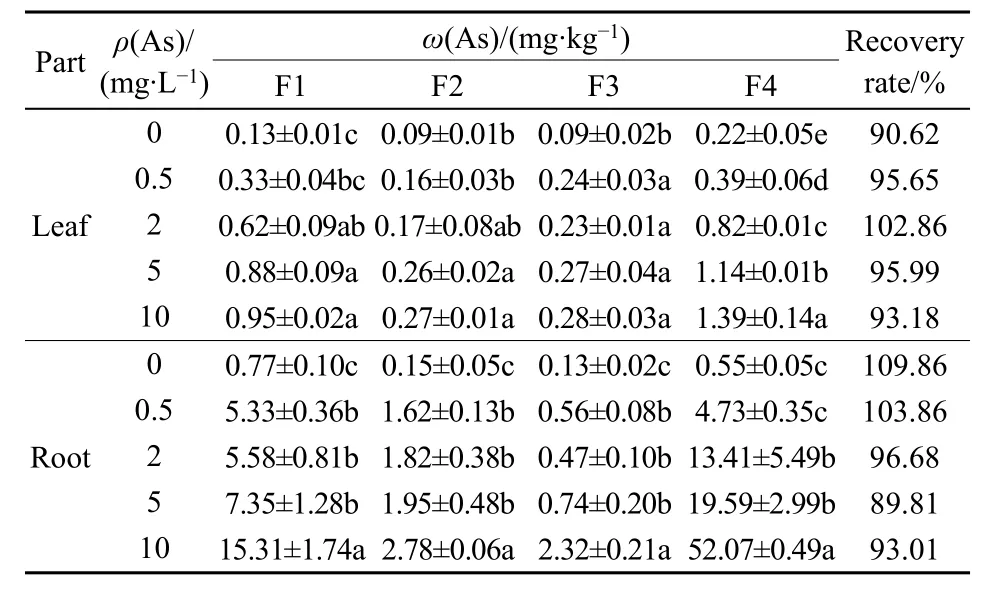
表2 狭叶香蒲根和叶中As的亚细胞分布Table 2 Subcellular distribution of As in roots and leaves of Typha
As在狭叶香蒲根中的亚细胞分布规律与叶中类似,各组分的As质量分数随As处理浓度的增加而增加。在10 mg·L−1As处理下,不同组分的As质量分数分别为 15.31 mg·kg−1(F1)、2.78 mg·kg−1(F2)、2.32 mg·kg−1(F3)和 52.07 mg·kg−1(F4),显著高于对照组(P<0.05),分别为对照组的19.08、18.51、18.33和52.07倍。在所有As处理下,狭叶香蒲根和叶中各亚细胞组分的 As质量分数均表现为 F4>F1>F2、F3,且根的可溶性组分和细胞壁贮存固持As的能力远高于叶。
2.6 各亚细胞组分中As分布的相对比例
As在狭叶香蒲根和叶亚细胞分布中的相对比例(某部位一组分的 As质量分数占该部位所有组分As质量分数之和的比例)如图5所示。在无As处理时,狭叶香蒲叶的可溶性组分中 As的相对比例最高,为41.40%,而在根中则是细胞壁占比最高,为48.43%。随着外源As处理浓度的增加,叶中F1的相对比例先增加后下降,在5 mg·L−1As处理下达到最大值,为34.58%,根中逐渐下降,为43.55%—21.12%;叶和根的 F2相对比例均下降,分别为14.29%—9.28%、13.21%—3.83%,F3相对比例分别为21.24%—9.73%、4.58%—2.20%,F4相对比例均上升,分别为 35.14%—48.05%、38.66%—71.84%。
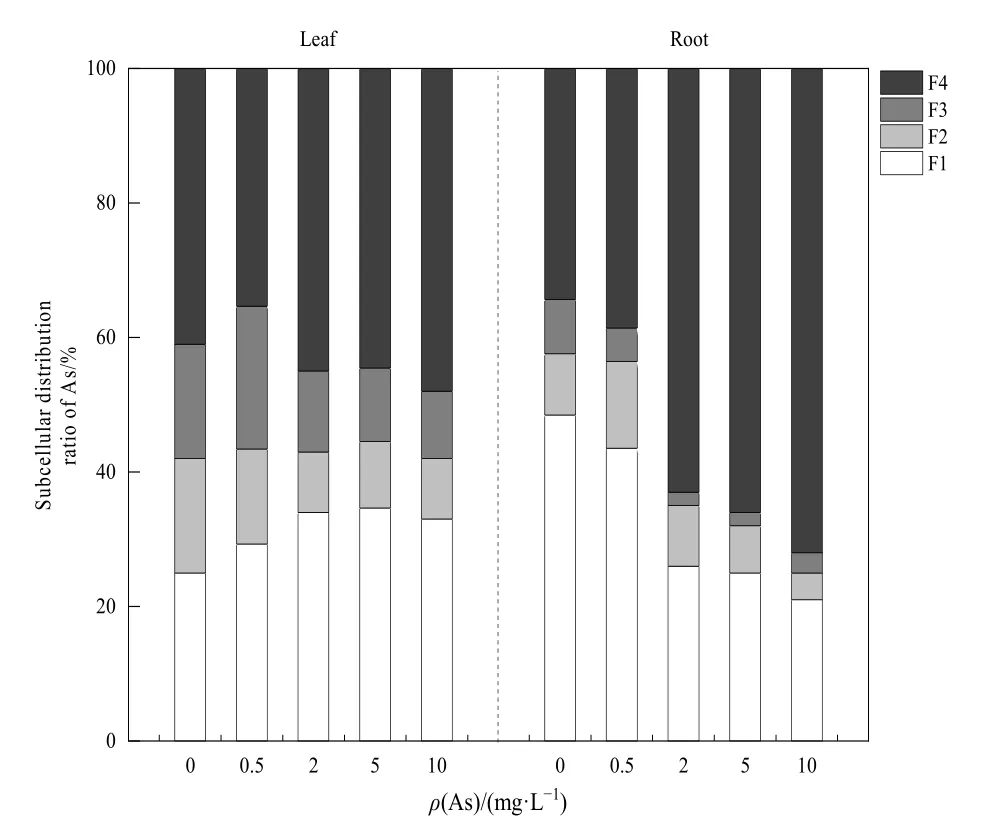
图5 As在狭叶香蒲根和叶亚细胞中的相对分布比例Fig.5 The relative distribution ratio of As in root and leaf subcell of Typha
图6表示在不同As处理下各亚细胞组分的相对含量(各亚细胞组分的As富集量占植株总As量的百分比)。随着 As质量浓度的增加,根可溶性组分中的相对含量为34.86%—67.14%,高于狭叶香蒲其他亚细胞组分中As累积量,是植物储存As的关键部位;其次是根细胞壁 As累积量,占植株总As累积量的39.26%—19.74%;叶的细胞壁和可溶性组分的相对含量与根部细胞核/前质体和线粒体的相对含量相当,其变化范围分别为 4.02%—2.15%、5.34%—3.14%、11.91%—3.58%、4.13—1.94%,叶细胞核/叶绿体和线粒体的相对含量最低,仅为1.41%—0.61%和2.09%—0.64%。
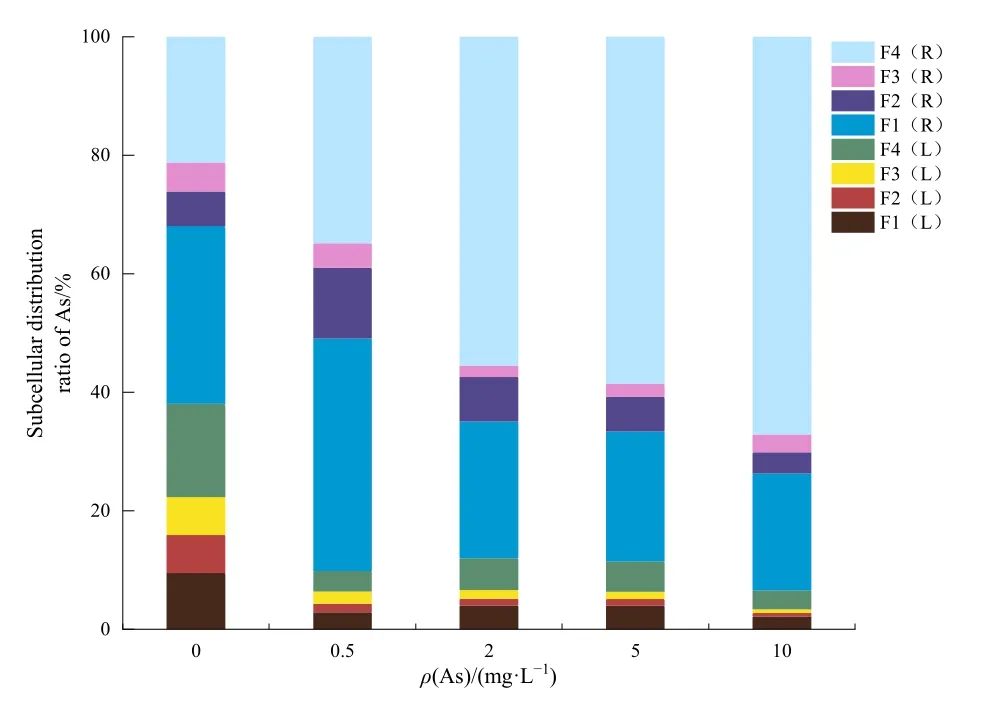
图6 不同As浓度下各亚细胞组分的As富集量占植株总As量的百分比Fig.6 Percentage of As enrichment of each subcellular component in total As content of plants under different As concentrations
3 讨论
3.1 As胁迫对狭叶香蒲生长、生理生态特征的影响
植物的生长状况被广泛用来评价植物对重金属的抗性(Zhang et al.,2015)。植物不同部位对重金属的敏感性依次为:根长>地下部生物量>株高>总生物量>地上部生物量(Galbraith et al.,2010)。本研究中,当 As质量浓度为 0.5 mg·L−1,根长及根鲜重显著增加(P<0.05),刘全吉等(2009)的研究表明As对小麦根系的影响远大于地上部分,说明根系生长对As相对敏感,更适合作为衡量As胁迫的指标。在5 mg·L−1As处理范围内,均会促进狭叶香蒲的生长发育,当As质量浓度为10 mg·L−1时,生长指标与对照组无显著性差异,而在 10 mg·L−1As处理下玉米株高和主根长均显著降低,根冠比降低(郝玉波等,2010),说明狭叶香蒲对As具有一定的耐受性。
光合色素含量的变化可反映重金属对植物的损害状况(张永志等,2009)。Mishra et al.(2016)对 As胁迫下金鱼藻叶绿素前体物质的合成和降解代谢物的分析表明,叶绿素浓度下降并不是被降解所致,而是与 As阻碍其前体物质合成有关。也有研究表明低浓度 As胁迫对叶绿素的合成有刺激作用(吴敏兰等,2015)。本实验中,0.5—10 mg·L−1As处理时光合色素含量均显著高于对照(P<0.05),这是由于狭叶香蒲吸收的 As主要富集在根部,少量进入叶片内的 As也被细胞壁和可溶性组分固持起来,叶绿体内低浓度的As刺激了叶绿素的合成。研究结果还发现As胁迫下狭叶香蒲中叶绿素b较叶绿素a敏感,当As≤2 mg·L−1时,叶绿素b增加幅度更大,导致ωa/ωb值降低,随着As浓度的增加,ωa/ωb值逐渐升高,这是由于植物为抵御逆境胁迫会降低光吸收叶绿素蛋白(LHCPs),而光合器中LHCPs的降低会改变光合色素的配比(Mobin et al.,2007)。As还会通过影响植物叶片的 Gs、ci和 Tr来影响植物的净光合速率(Ding et al.,2020)。本研究中As的添加使狭叶香蒲叶片Gs增大,造成ci在 0—2 mg·L−1As处理时显著增多(P<0.05),是净光合速率升高的原因之一;当As>2 mg·L−1时,ci升高而Pn下降,表明此时净光合速率的降低非气孔限制而是由于叶绿素含量下降所致。Ali et al.(2020)也表示叶面施用As能显著提高小麦各品种内部CO2浓度、气孔导度和净光合速率。综上分析可知,一定质量浓度的 As胁迫会促进气孔开放和光合色素的合成,进而提高叶片的光合作用,增加光合产物的积累,促进狭叶香蒲的生长发育。
重金属会通过Fenton或Haber-weiss反应或刺激 NAPDH 氧化酶诱导 ROS产生(Bai et al.,2016),当胁迫程度超出植物耐受限度时会对细胞造成代谢紊乱。而SOD、POD、CAT作为植物体活性氧清除系统中的关键酶,能及时清除过多的ROS,保护细胞膜系统免受氧化损伤,同时,其活性变化也是表征植物氧化胁迫的重要指标(Zhang et al.,2007)。在本实验中,2 mg·L−1As胁迫范围内,随着As质量浓度的增加,SOD和 CAT活性显著提高(P<0.05),POD活性也有所增加。陈天等(2019)通过土培实验也发现在150 mg·kg−1As胁迫下,狭叶香蒲的SOD活性显著提高,说明低浓度As胁迫有利于提高狭叶香蒲的抗氧化酶活性。当 As浓度为5 mg·L−1时,SOD、POD、CAT活性显著下降,但MDA含量却不增反减,有研究表明,细胞中过量重金属会直接作用于酶蛋白或影响基因表达影响抗氧化酶活性(赛闹汪青等,2019),而Kofronova et al.(2019)的研究表明在清除ROS方面是由抗氧化酶和非酶系统相互协作,在轻度胁迫下主要有SOD、POD、CAT和脯氨酸发挥作用,而在较高胁迫下主要由其他分子来清除ROS,如酚类化合物或碳水化合物。胡拥军等(2015)研究也显示:大叶井口边草叶片MDA含量在低浓度As处理时显著增加,但在中、高浓度 As处理时又显著回落。当As质量浓度为10 mg·L−1时,抗氧化酶活性持续降低(除 CAT与 5 mg·L−1处理时无显著性差异),MDA含量达到最大值,显著高于对照组(P<0.05)。综上所述,狭叶香蒲基于复杂的抗氧化系统对低于5 mg·L−1As处理表现出较好的抗氧化能力,当As质量浓度超过10 mg·L−1时,As胁迫可能对抗氧化酶和非酶分子合成部位造成一定的损伤。
3.2 不同As处理对狭叶香蒲As富集转运及亚细胞分布的影响
As的含量、富集系数和转移系数是评价植物富集重金属能力的3个重要参数(Li et al.,2016),本研究表明,当 As≤10 mg·L−1时,狭叶香蒲叶和根组织中的As质量分数最高可分别达到3.11、77.92 mg·kg−1,根富集系数为 7.79—23.57,表明狭叶香蒲根具有较高的As富集能力。Hal(l2002)和Tauqeer et al.(2016)指出,植物体通过限制有毒重金属离子向地上器官的转移,将吸收的重金属离子大部分积累在根部,从而保护叶组织特别是代谢活性光合细胞免受重金属的损伤。本研究在外源 As的添加下,转移系数仅为0.04—0.10,显著降低了As向地上部分的转移,保护地上部分免受 As的危害,这可能是狭叶香蒲能够耐受As的原因之一。
探究重金属的亚细胞分布特征对于阐明植物中重金属的积累迁移能力以及重金属胁迫下植物的适应性、耐受性和解毒的机制至关重要(Zhang et al.,2015;Geffard et al.,2010)。细胞壁是植物防护重金属的重要屏障,其表面的纤维素、半纤维素和蛋白质提供的羧基、羟基、氨基和醛基等功能基团,以及与重金属关联的阳离子交换位点,可以有效结合重金属离子,减少其跨膜运输,从而限制重金属离子向植物可溶性组分和细胞器的转运(Fu et al.,2011;Xin et al.,2014)。在本研究中,As在细胞壁的分布比例仅次于细胞液,在狭叶香蒲叶和根中占比分别为 24.94%—34.58%、21.12%—48.43%,且随着As质量浓度的增加,叶细胞壁所占比例呈上升趋势,但当As质量浓度为10 mg·L−1时,细胞壁相对分布比例无显著性增加(P<0.05),说明细胞壁对 As固持能力有一定的限度,陈同斌等(2005)在超富集植物中也得出同样的规律。植物可溶性组分由细胞液和液泡液两部分组成,细胞液是植物进行新陈代谢的主要场所,液泡的主要功能是参与细胞的水分代谢(郑国锠,2000),同时也是植物细胞代谢副产品及废物囤积的场所(汪良驹等,1998),Sharma et al.(2016)研究发现非超富集植物主要通过V-ATPase、V-PPase和小囊泡将重金属转运至根的液泡中,进入可溶性组分中的重金属离子会与有机酸结合以及植物螯合素(PCs)、非蛋白巯基(NPTs)等鳌合(Xin et al.,2017;Patrizia et al.,2015),从而进一步降低其对细胞器的毒性。尚德荣等(2013)对条斑紫菜研究结果显示,藻体胞液中As占80%,是As的主要储存部位;陈同斌等(2005)发现在超富集植物蜈蚣草中,羽片胞液的As累积量占植株总As累积量的61%;Mishra et al.(2016)通过微X射线荧光断层照片发现在高浓度As胁迫下,As主要富集在金鱼藻的液泡中。本研究中,As在狭叶香蒲各组织细胞液中的比例最大,在叶中占比为 35.14%—48.05%,根中占比为34.24%—71.84%,植株吸收的As主要累积在根的细胞液中,占植株总As富集量的21.21—67.14%(图6),随着 As质量浓度的增加,As在狭叶香蒲根的可溶性组分中分配比例逐渐增加、在细胞壁中分配比例则逐渐减少,表明在高胁迫浓度As处理下,狭叶香蒲根的内部解毒可能由细胞壁沉淀重金属为主转为可溶性组分区隔化占主导。同时,在不同As质量浓度下狭叶香蒲的转移系数均不超过 0.1(图 4C)。这些结果表明狭叶香蒲根对 As有较强的富集能力,根细胞壁和细胞液对 As进行暂时或永久封存,降低了其向地上部的转移,使叶绿体、细胞核和线粒体中As质量分数维持相对较低水平,这可能是狭叶香蒲对As的重要解毒机制之一。
4 结论
(1)在小于10 mg·L−1As胁迫范围内,狭叶香蒲抗氧化系统积极应对胁迫,叶片光合色素含量升高、气孔开放程度增大、从而提高叶片的净光合速率,促进狭叶香蒲的生长发育;当As质量浓度达到10 mg·L−1时,抗氧化酶活性显著降低、膜脂过氧化程度加剧、光合色素含量下降,生长指标降至对照组水平。表明狭叶香蒲对As具有一定的耐受性。
(2)不同As处理下,狭叶香蒲根中As含量显著高于地上部,转移系数均低于 0.1,表明狭叶香蒲会限制As向地上部分的转移,降低As对狭叶香蒲叶的毒害作用,是狭叶香蒲应对 As胁迫的耐受性机制之一。
(3)狭叶香蒲吸收的 As主要集中分布在根的可溶性组分中,其次是根的细胞壁中,少量转运至叶中的As也被其细胞壁和可溶性组分所结合固持,叶绿体、细胞核和线粒体中的 As始终维持相对较低水平,保证了狭叶香蒲的正常生理代谢活动,这可能是狭叶香蒲对As的重要耐性和解毒机制之一。

