耐盐植物根际促生菌筛选及促生效应研究
代金霞,田平雅,沈聪,刘爽
宁夏大学生命科学学院,宁夏 银川 750021
盐碱胁迫是典型的非生物胁迫之一,严重影响植物对营养元素的吸收,使植物正常的生长发育受到抑制,是导致农作物产量降低的重要环境因素(刘奕媺等,2018)。土壤盐渍化制约着农业生产以及资源环境的可持续发展。中国盐碱化土壤占地面积大,类型多样,开发和利用盐碱地资源,已成为保持中国农业持续发展的当务之急,也是进一步挖掘农业现有发展潜力的一条重要出路(王佺珍等,2017)。近年来,以耐盐植物改良为核心的盐碱地改良利用技术逐渐被重视起来。但盐生植物的培育难度较大且周期长,幼苗期也会因为盐碱地特殊的土壤性质导致其生理指标发生变化,出现成活率低、保存率低等现象(Zhou et al.,2017;Ma et al.,2019)。目前的研究表明,在盐碱化土壤中施加微生物肥料可以有效地阻止土壤中的盐分对树木幼苗的危害(Mahmood et al.,2016;丁绍武等,2019)。微生物肥料中起主要作用的植物根际促生菌(plant growth promoting rhizobacteria,PGPR)不仅为土壤提供了所需要的离子,使土壤中离子状态的不平衡得到调节,改善植物根际环境,提高植物的耐盐性,而且为植物提供丰富的营养元素,被植物所吸收利用,对利用植被恢复改良盐碱地起到积极的作用(Vessey,2003;Sheikh et al.,2016)。此外微生物肥料能减少化肥和农药的使用,安全高效、环境友好,因此研究利用微生物肥料改良利用盐碱地具有重要的意义。
宁夏银北盐碱区属中国5大盐碱土区的西北半干旱盐碱土区,水资源缺乏。土壤盐碱化已成为影响宁夏农业生产和经济发展的限制性因素之一(何欣燕等,2018)。开展PGPR作为微生物肥料的研制和菌种开发工作,这是一项开辟肥源而保护生态环境的有效措施,对促进宁夏盐碱地的修复和改良具有重要的推动作用。本研究以实验室前期从宁夏银北盐碱地6种耐盐植物根际土壤中分离筛选出的PGPR为对象,通过菌株间拮抗反应测试和促生特性测定结果,筛选高效PGPR构建复合菌群,并通过盆栽试验验证菌群对苜蓿和柳枝稷幼苗的促生效果,为有效利用植物根际促生菌改良盐碱土壤提供菌种资源并奠定理论基础。
1 材料与方法
1.1 土壤和菌株来源
于2017年5—7月,采用五点取样法在宁夏银北西大滩盐碱地(38°50′23.8″N,106°23′54.1″E)中采集苜蓿Medicago sativa、枸杞Lycium barbarum、柳枝稷 Panicum virgatum、芨芨草 Achnatherum splendens、苦豆子 Sophora alopecuroides和柽柳Tamarix chinensis等6种耐盐植物根际土壤。制备土壤悬液,梯度稀释后涂布于LB平板上,28 ℃恒温培养24—72 h,待菌落长出后划线纯化直至形成单菌落,共分离纯化菌株110株。盆栽试验供试土壤为银北地区盐碱土壤与营养基质1∶1混匀,土壤pH为8.6,有机质含量12.06 g·kg−1,全氮、全磷和全钾含量分别为 0.57、0.58 和 21.76 g·kg−1;所用植物种子为苜蓿(Medicago sativa)和柳枝稷(Panicum virgatum)种子。
1.2 菌株的促生活性测定
1.2.1 菌株的解磷能力测定
将菌株接种于含有Ca3(PO4)2的PKO平板上,28 ℃培养3—7 d后能够形成透明溶磷圈的为阳性菌株。采用钼锑抗比色法测定阳性菌株发酵液中的有效磷含量。以不接菌的无机磷液体培养基为空白对照,在720 nm波长下测定反应液OD值,每个菌株设置3个重复,根据标准曲线公式计算得到菌株发酵液中的有效磷含量,以反应液中有效磷的含量表示菌株的解磷能力(李海云等,2018)。
1.2.2 菌株产ACC脱氨酶活性测定
将菌株接种于以ACC为唯一氮源的ADF培养基上,连续转接5次后仍能正常生长的菌株初步认为能够产生ACC脱氨酶。提取菌株DNA,用引物对 acdSf3(5′-ATCGGCGGCATCCAGWSNAAYCA NAC-3′)和 acdSr4(5′-GGCACGCCGCCCARRTGN RTA-3′)扩增ACC脱氨酶结构基因acdS,将获得目的条带为760 bp左右的PCR产物进行测序,序列在Genbank中进行Blast比对,确定目的片段为acdS基因序列片段,将该菌株视为产ACC脱氨酶阳性菌株(冯维维等,2016)。参考Penrose et al.(2003)、韩坤等(2015)的方法对阳性菌株的ACC脱氨酶活性进行定量测定。以单位蛋白含量的细菌菌体在单位时间内产生α-酮丁酸的量计为ACC脱氨酶活性,以牛血清蛋白为标准蛋白,采用Bradford比色法测定总蛋白的含量。
1.2.3 菌株分泌IAA能力测定
采用Salkowski比色法对菌株分泌IAA能力进行定性筛选,颜色变红者为分泌IAA阳性菌株。制作IAA标准曲线,采用分光光度法定量测定阳性菌株IAA分泌量。将阳性菌株接种于含有L-色氨酸(100 mg·L−1)的 LB液体培养基中,28 ℃振荡培养48 h后离心,取上清液5 mL于试管中,加入等体积Salkowski比色液,避光静置30 min,测定其 OD530值,以 LB液体培养基与等体积Salkowski比色液的混合液调零,根据标准曲线计算单位体积发酵液中相应的IAA浓度(Glickmann et al.,1995)。
1.2.4 菌株分泌铁载体能力测定
将活化的菌株点接到 CAS检测平板上,28 ℃恒温培养3 d,菌落周围出现明显的橙黄色晕圈的为产铁载体阳性菌株。采用CAS比色法对菌株产铁载体能力进行定量测定(赵翔等,2006)。以波长680 nm处菌株与CAS检测液的吸光值A与对照参比值Ar的比值(A/Ar)作为定量指标,比值越小,反映铁载体的产量越大。每个菌株设置3个重复。
1.3 菌株的相容性检测和菌种鉴定
根据菌株促生活性测定结果,选择具有较高的单一活性或多种活性的 22个菌株,采用平板拮抗法检测供试菌株之间的拮抗反应。以其中一株菌作为指示菌均匀涂布至LB固体平板上,将干热灭菌的滤纸片间隔一定距离放置在涂有指示菌的平板上,将其它测试菌株的发酵液点接至滤纸片上,28 ℃培养箱恒温培养 48 h,观察指示菌与测试菌之间有无抑菌圈。依次以不同菌株作为指示菌进行上述操作,记录菌株间的拮抗结果。选择互不拮抗的菌株,进行革兰氏染色和生理生化特征测定,根据《常见细菌系统鉴定手册》(东秀珠等,2001)对菌株进行初步鉴定。提取菌株基因组DNA,采用细菌 16S rRNA 基因通用引物 27F(5′-AGAGTTT GATCCTGGCTCAG-3′)/1492R(5′-TACGGYTACC TTGTTACGACTT-3′)进行扩增,扩增产物经 1%琼脂糖凝胶电泳检测合格后委托上海生工生物工程有限公司测序。序列拼接后在 GenBank(http://www.ncbi.nlm.nib.gov/)中进行同源性比对,对菌株进行分子鉴定。
1.4 PGPR复合菌群的构建及促生特性测定
根据菌株拮抗反应测定结果,选择互不拮抗的11个菌株,用新鲜 LB培养液调整菌液 OD600=1.0±0.05。以每 4株菌为一个组合,按相同体积比混匀后,再按照4%的总接种量接种混合菌液至LB培养液中,28 ℃,150 r·min−1下恒温培养 48 h,即为复合菌群。按照1.2的方法测定各复合菌群解磷、分泌IAA、产ACC脱氨酶和产铁载体能力;在阿须贝无氮液体培养基中发酵培养后测定菌群的鲜质量。
1.5 PGPR复合菌群的促生效果验证
1.5.1 复合菌群的选择和菌剂制备
根据菌群促生特性的测定结果,选择具有较高促生活性的两组复合菌群C3和C8进行促生效果验证。按照4%的总接菌量接种菌群混合液至LB液体培养基中,恒温震荡培养一定时间后,发酵液在无菌条件下离心弃上清液,菌体洗涤2次后加无菌水,制成 OD600=1.50±0.05的复合液体菌剂,用于盆栽试验。
1.5.2 种子处理
选取大小一致、成熟饱满、未受昆虫侵害的紫花苜蓿种子,在50—60 ℃无菌温水中浸泡30 min,用75%的酒精进行表面消毒1 min,无菌水洗涤3次;柳枝稷种子于浓度为5.25%次氯酸钠中浸泡15 min,净水洗20 min。洗净的种子分别于OD600=1.50的复合菌剂中浸种2 h后,放置于28 ℃培养箱诱导种子萌发,以无菌水浸种相同时间处理为对照(CK),共设置6组。分别称取500 g混匀后的土壤置于10 cm×15 cm的花盆中,取发芽势一致的种子进行穴播,每盆15颗种子,每处理6盆。菌剂浸种处理组于幼苗长出的第7、14、30天各浇一次OD600=1.50的复合菌剂30 mL,对照组只浇等量无菌水,温室培养,定期适当补充水分。
1.5.3 植物幼苗的生物量测定
紫花苜蓿和柳枝稷分别种植90 d和60 d后,每组分别取3盆,将植株连根取出,用自来水将根系仔细地冲洗干净,然后用吸水纸将水吸干,用游标卡尺测量每株幼苗的株高和根长;将每盆幼苗地上和地下部分剪下分别称质量作为鲜质量,在105 ℃杀青30 min,65 ℃或85 ℃烘干至恒质量,测定鲜质量,计算各盆测定的平均值。通过对处理组和对照组幼苗各生物量的比较,验证复合菌群的促生效果。
1.6 数据处理
采用Excel和SPSS 19.0软件进行数据处理和方差分析。
2 结果与分析
2.1 菌株的促生活性分析
通过定性筛选,从6种耐盐植物根际土壤中共获得 23株解磷菌,这些菌株在解磷培养基上能够产生明显的溶磷圈(图 1)。定量测定结果显示,阳性菌株的解磷能力差别较大(图 2),解磷量在2.90—70.92 mg·L−1之间,其中菌株 GQ2、KDZ12和LZJ12的解磷能力相对较高,分别达到70.92、70.22 和 70.14 mg·L−1。
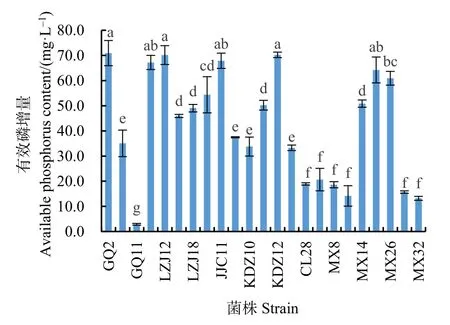
图2 解磷菌株的有效磷增量Fig.2 Available phosphorus content of phosphate dissolving strains
在以ACC为唯一氮源的ADF平板上转接5次能够正常生长的菌株有18株,通过ACC脱氨酶结构基因acdS的PCR扩增,其中6株能够获得大小约为 760 bp左右 acdS基因片段,经测序后在Genbank中进行同源性比对,确定目的片段为acdS基因序列。定量测定结果表明,6株阳性菌株产ACC脱氨酶的能力存在显著差异,菌株MX31和KDZ12的 ACC 脱氨酶活性最大,分别为 1.56 μmoL·mg−1·h−1和 1.50 μmoL·mg−1·h−1, 其 次 是GQ11,为 1.14 μmoL·mg−1·h−1(图 3)。
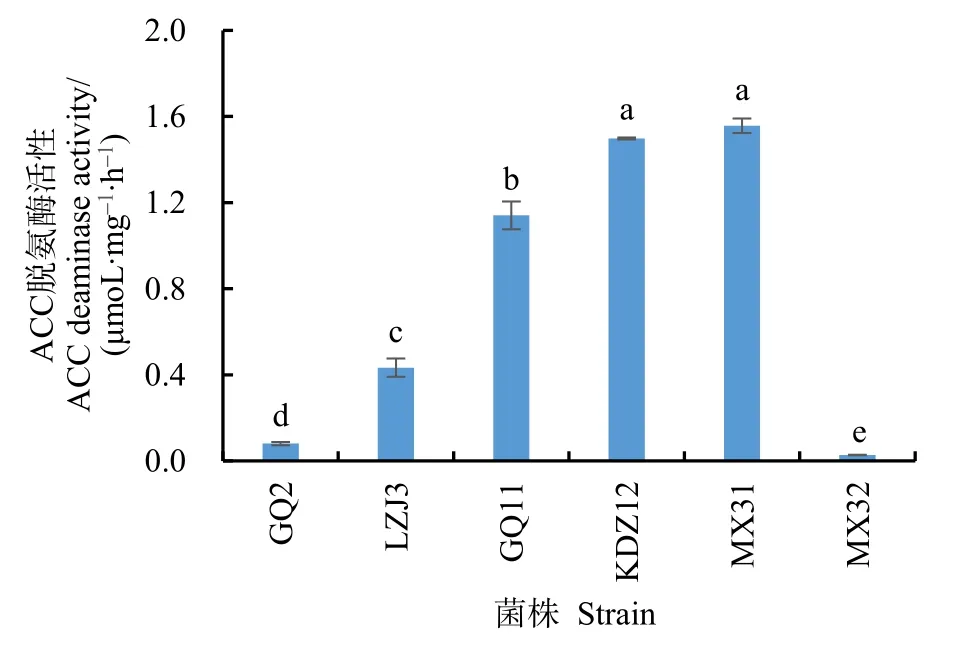
图3 菌株ACC脱氨酶的活性Fig.3 ACC deaminase activity of strains
经过定性筛选,有 46株菌的发酵上清液与Salkowski比色液产生红色反应,表明这些菌株具有分泌IAA的能力。定量测定结果表明,阳性菌株IAA分泌量在 1.33—34.74 mg·L−1之间,不同菌株间差异较大。其中,菌株JJC12分泌IAA能力最强,达到 34.74 mg·L−1;其次是 MX17,为 30.37 mg·L−1。部分菌株分泌IAA的能力如图4。
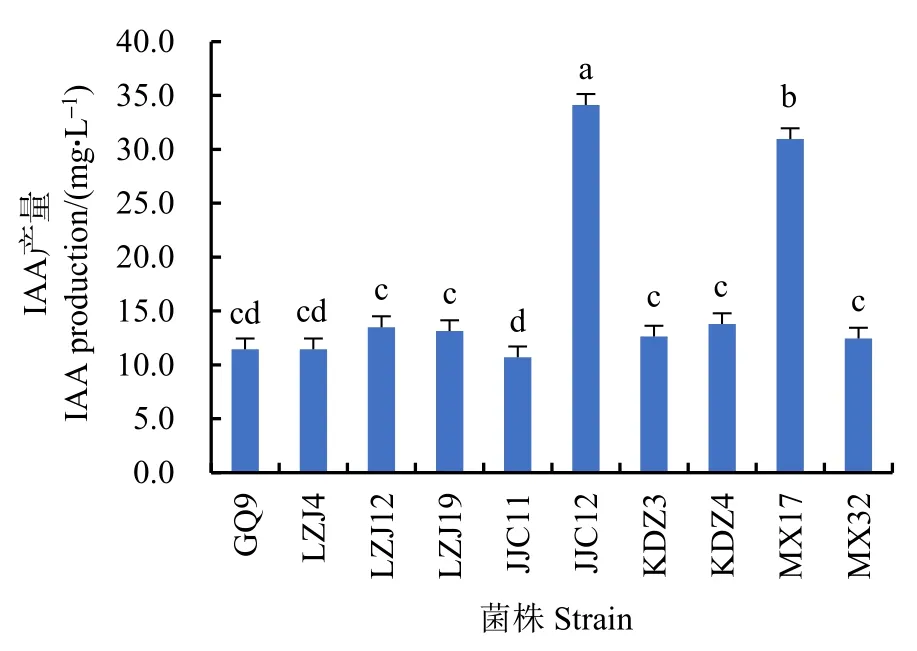
图4 菌株IAA分泌量Fig.4 IAA production of strains
在CAS检测平板上有24个菌株能够产生橙黄色晕圈,表明这些菌株具备分泌铁载体的能力。定量测定结果显示,绝大部分菌株A/Ar的值小于0.4,其中菌株MX18、MX22、LZJ13和KDZ12的A/Ar值小于0.2,具备很强的产铁载体能力(表1)。
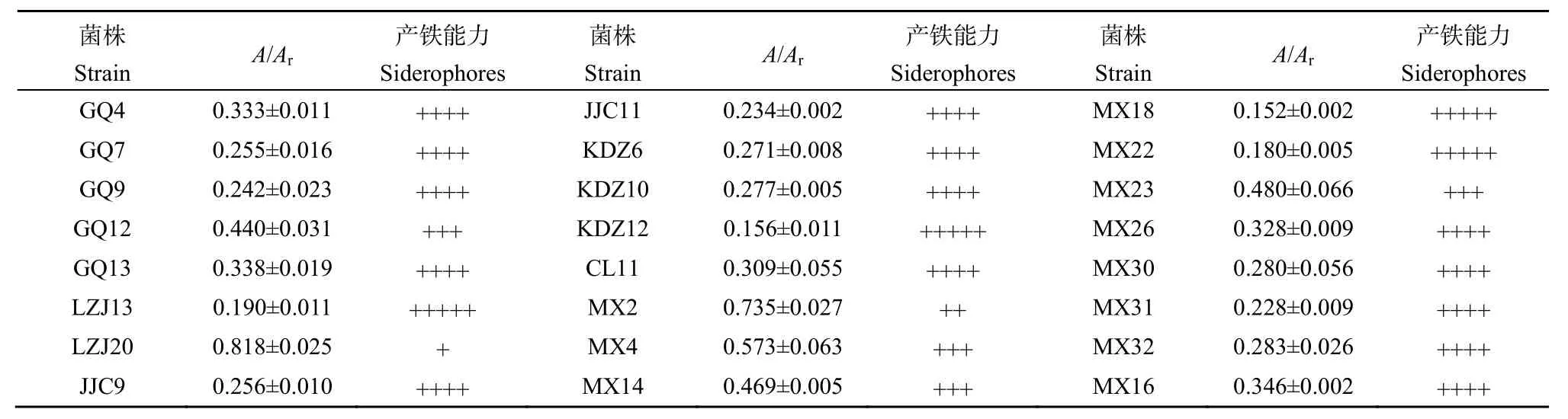
表1 菌株产铁载体能力Table 1 Ability of siderophores secretion of tested strains
2.2 菌株相容性和菌种鉴定
拮抗反应是菌体细胞不亲和性的具体体现,平板拮抗实验能够有效检测菌株间的相容性。通过对22个菌株进行相容性检测,共获得了11株可用于构建复合菌群的 PGPR。其中,革兰氏阴性细菌 5株,革兰氏阳性细菌6株。结合菌株生理生化特征和16S rDNA序列分析对菌株进行鉴定,结果表明有6株菌隶属于芽孢杆菌属(Bacillus),其中MX26、JJC11、LZJ12为枯草芽孢杆菌Bacillus subtilis,GQ4和 GQ13为萎缩芽胞杆菌 Bacillus atrophaeus,KDZ12为蜡样芽孢杆菌 Bacillus cereus;MX31、GQ2、GQ11和 LZJ3这 4株均为假单胞菌Pseudomonas brassicacearum;MX32为鞘氨醇杆菌Sphingobacterium kitahiroshimense,菌株16S rDNA的序列同源性和理化性质见表2。
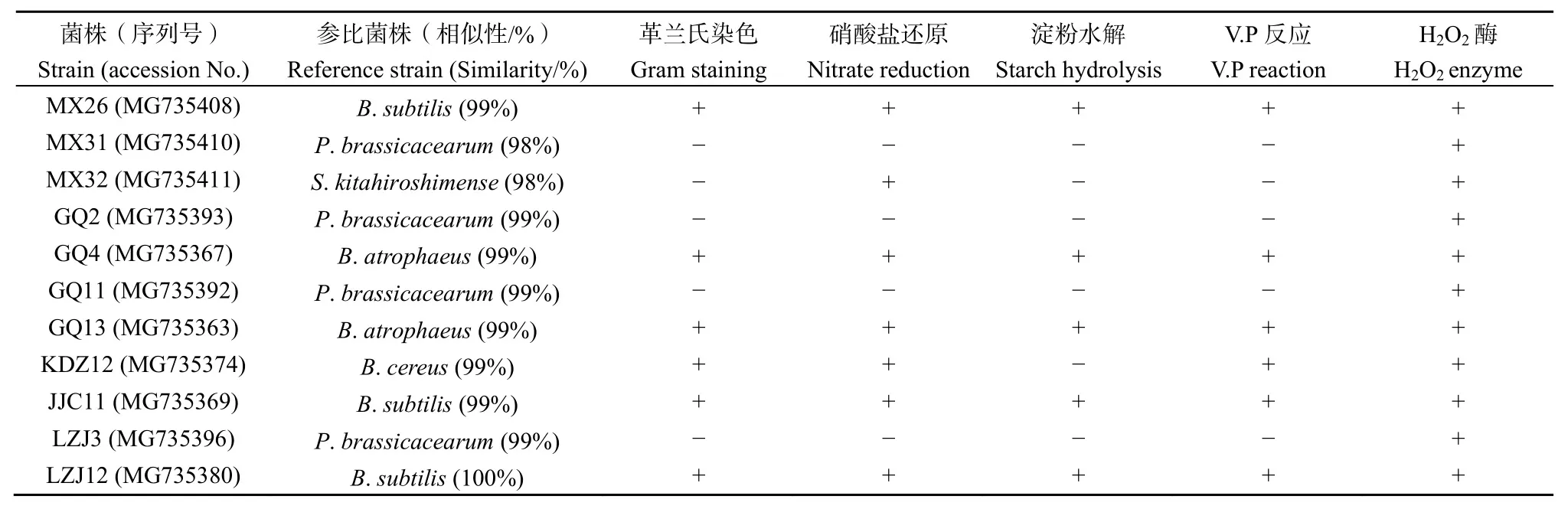
表2 菌株的16S rDNA序列相似性和部分生理生化特征Table 2 16S rDNA sequence similarity and partial physiological and biochemical characteristics of strains
2.3 PGPR复合菌群的促生活性分析
以每4个互不拮抗的菌株进行组合,共构建9组PGPR复合菌群,命名为C1—C9。对其促生特性进行测定,结果表明复合菌群具备多种促生活性。其中,ACC 脱氨酶活性在 0.12—3.67 μmol·mg−1·h−1之间,依次为C8>C3>C1>C2>C6>C4>C9>C5>C7;不同菌群分泌IAA和解磷能力差别较大,IAA浓度在 4.62—13.30 mg·L−1之间,依次为C3>C4>C1>C2>C9>C8>C6>C7>C5;解磷量在3.52—56.96 mg·L−1之间,解磷能力为 C3>C8>C2>C1>C5>C7>C9>C6>C4;产铁载体能力表现为 C1—C4组合相对较强(表3)。
2.4 PGPR复合菌群对植物幼苗生长的影响
根据菌群的促生能力和菌株的多样性,选择C3和C8这两组复合菌群进行盆栽实验。盆栽种植紫花苜蓿90 d、柳枝稷60 d后观察发现,两组复合菌群处理对两种植物幼苗均具有明显的促生效果(图5)。

图5 复合菌对苜蓿(A)和柳枝稷(B)的促生效果Fig.5 Growth Promoting effect of compound bacteria on Medicago sativa (A) and Panicum virgatum (B)
对植物幼苗各生物量的测定结果表明,与对照组相比,添加C3和C8复合菌群后,幼苗增长明显,且地上部分的增长显著高于地下部分。复合菌群C3对苜蓿幼苗的促生效果要明显强于C8,使苜蓿幼苗的株高、地上鲜质量/鲜质量、地下鲜质量/鲜质量分别增长了 54.93%、113.80%/119.60%和 66.09%/49.92%,而根长的增长在两个菌群间没有显著差异(表4);两组复合菌群对柳枝稷幼苗同样具有明显的促生效果,菌群C3对柳枝稷幼苗株高的促进作用显著强于C8菌群,增长率达到50.96%,而幼苗根长、地上鲜质量/鲜质量、地下鲜质量等指标在两组菌群间都无显著差异(表 5)。综合比较两组复合菌群对苜蓿和柳枝稷幼苗的影响,发现C3和C8对植物幼苗的促生效果均展现出地上生物量优于地下。且不同菌群对同一植物、同一菌群对不同植物的促生效果均存在一定差异。
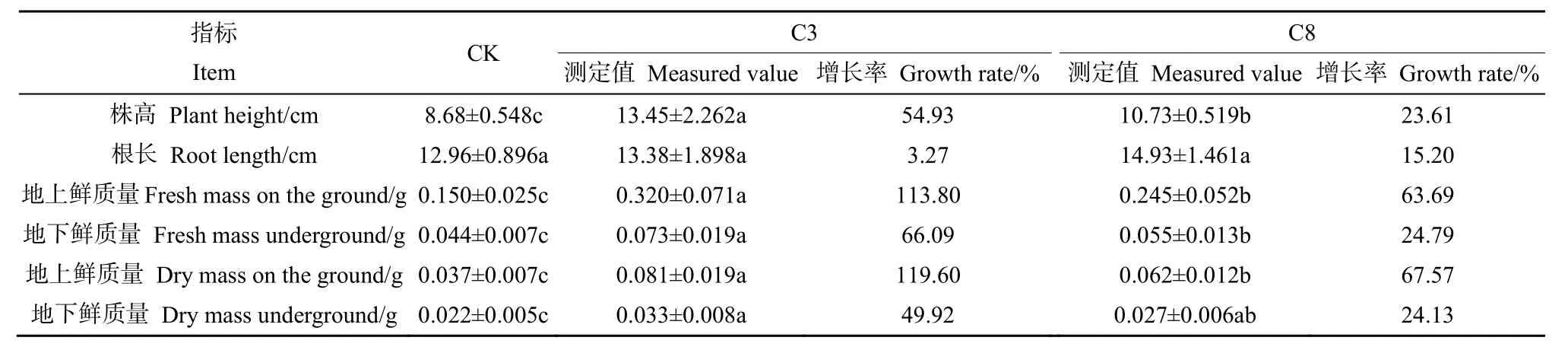
表4 复合菌群对苜蓿幼苗生物量的影响Table 4 The effect of compound bacteria on the biomass of Medicago sativa seedlings
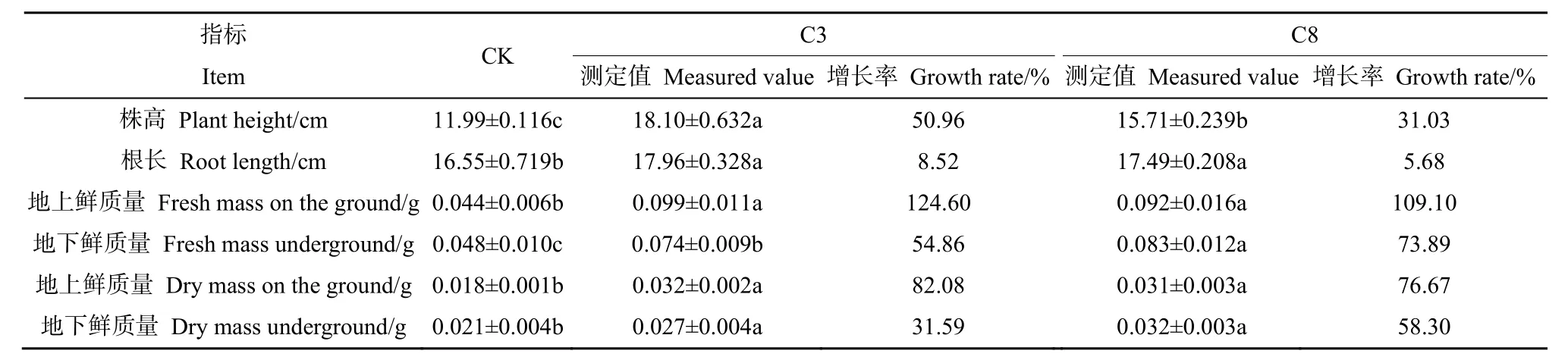
表5 复合菌群对柳枝稷幼苗生物量的影响Table 5 The effect of compound bacteria on the biomass of Panicum virgatum seedlings
3 讨论
土壤环境复杂多变,在过分依赖化肥和农药以期追求农作物增产的时代背景下,人们也逐渐意识到生态保护与农业可持续发展的重要性。为了改善农业可持续发展,新型微生物肥料的研制就被提上了日程,研究证明添加微生物肥料可以提高肥料的利用率,同时减少化肥和农药的使用。其中,植物根际促生菌因具有安全高效、环境友好的特点而成为目前的研究热点(Kim et al.,2018)。很多研究报道了PGPR对各种作物增产、增效的多重功能,一些PGPR被开发成生物菌剂或肥料,在农业生产上具有防病促生和活化土壤等作用,其研究和产业化前景十分广阔。孙广正(2015)利用从小麦、红三叶、苜蓿中筛选出的优良PGPR制成的复合菌肥可以显著促进油菜生长;何志刚等(2013)的研究表明,增施促生菌肥的马铃薯产量比常规施肥提高12.4%,证明在配施生物菌肥的条件下提高马铃薯产量是可行的。经过PGPR菌肥处理后的燕麦、小麦的株高和生物量等均高于对照(Mahone et al.,2017;Muhammad et al.,2019)。李玉奇等(2012)在温室中通过施用微生物肥料,黄瓜的总生物量、茎粗、叶面积指数、叶片数、根活力、叶片的光合特性以及品质均得到了提高。本研究结果表明,耐盐植物根际定植的许多细菌都具有一种或多种促生活性,其中假单胞菌和芽孢杆菌是土壤中常见的根际促生菌,也是银北盐碱地中的优势类群,不仅可以有效抵御外界的有害因子,也是一类重要的生防菌;鞘氨醇杆菌有着极强的生命力和抗逆性,对植物的生长也有直接或间接的促进作用。本研究选取了假单胞菌、芽孢杆菌和鞘氨醇杆菌等部分根际促生菌株构建了PGPR复合菌群,根据复合菌群促生特性的测定和盆栽效果验证,结果显示构建的 C3和 C8两组复合菌群对盐碱环境下植物幼苗都有明显的促进生长作用,尤其是 C3菌群,使苜蓿和柳枝稷地上鲜质量分别增长 113.33%和 125.00%,促生长作用显著。这与已有的一些研究结果相一致(Bulgarelli et al.,2015;Majeed et al.,2015;Agbodjato et al.,2016),表明在植物根际土壤中接种根际促生菌复合菌剂可明显促进其生物量的提高。
PGPR是一类植物生长促进剂,其制成的菌肥施用后能提高植物根部土壤微生物种群密度,根际促生菌在植物根部定植之后,随着生命活动的增强,菌株分泌各种促生素的能力也增加。有研究显示产植物激素IAA是PGPR植物促生的主要因素之一,在较低浓度下就可以促进细胞的伸长生长,并且调节逆境胁迫条件下根系的发育过程,从而使根系的生长发育适应盐胁迫(Vurukonda et al.,2016;郭军康等,2015)。本研究选用的PGPR菌株都能在没有色氨酸的情况下合成植物生长激素IAA,促进植株形成了一个细长或高度分枝的根系系统,尽管各处理的幼苗根长增长不明显,但地下部分生物量仍然显著增高,这表明PGPR菌群加强了植物对养分的吸收利用,增加了幼苗活力,促进了根系的发育。产铁载体PGPR能有效增加土壤中铁的有效性来满足自身需求,不仅能改善植物的铁营养状况,还可以与植物根际病原菌争夺有限的铁元素,从而抑制病原菌的生长繁殖,起到生物防治作用。产 ACC脱氨酶的菌株通过抑制乙烯的合成来有效缓解植物体内乙烯的积累,减少过量乙烯对植物生长造成的不利影响,增强植物对盐碱、干旱等逆境的适应性来间接促进植物生长和产量的提高(Glick,2014;代金霞等,2017)。研究中的两组PGPR复合菌群不仅兼具ACC脱氨酶活性及分泌铁载体的能力,还同时具有固氮和解磷能力,增加根际土壤中可利用的氮源和磷源,这些促生特性能够不同程度地刺激和调节植物生长,缓解盐碱胁迫,进而达到增产效果。此外,两组复合菌群对不同植物的同一性状及同种植物的不同性状的促进效果又有不同,这也说明菌群促生效果的高低受菌株的种类、活性和植被类型等多种综合因素的影响。
4 结论
银北盐渍化土壤中蕴藏着丰富的植物根际促生菌资源,芽孢杆菌和假单胞菌为优势菌群;PGPR复合菌群对盐碱环境下植物幼苗的生长具有明显的促进作用,具备开发为盐碱地改良的植物促生复合菌剂的潜能。
——现代牙刷的由来

