乳腺超声与钼靶X线检查对乳腺癌影像学表现的对比分析
杨磊清,王雅勤,蒋军英,孔祥东(通讯作者)
(1上海市金山区亭林医院超声科 上海 201505)
(2上海市金山区吕巷镇社区卫生服务中心超声科 上海 201517)
(3上海市金山区张堰卫生服务中心超声科 上海 201514)
乳腺癌是目前女性群体高发性恶性肿瘤,约占女性癌症群体25%,病死率占据15%,年均发病约18万人次。WHO提倡癌症“三级预防”原则,即病因学预防、早发现早诊断早治疗、临床预防,特别为二级预防,是起到疾病早期诊断,预防乳腺癌患者死亡的根本性措施。现代医疗模式下,乳腺超声、钼靶X线和核磁共振是乳腺癌患者常见检查方式,但由于核磁共振费用高、预约和检查时间长等缺陷,致使其余两种方式成为医疗界的首选,但却存在自身优劣势,应酌情商榷[1]。抽取本院乳腺癌患者共185例,探讨乳腺超声、钼靶X线检查结果。报道如下。
1 资料与方法
1.1 基本资料
抽取本院2019年1月—2020年12月时段内收治的乳腺癌患者共185例,包括2019年患者87例、2020年患者98例;年龄最高值82岁,最低值28岁,均值为(55.1±12.4)岁。
入选原则:经手术切除或穿刺活检均已确诊为乳腺癌;均施行乳腺超声检查、钼靶X线检查;未采取术前放疗、内分泌治疗及新辅助化疗等方案。
1.2 方法
(1)乳腺超声检查。取彩色超声诊断仪(TOSHIBA)对患者施行乳腺超声检查,线阵探头频率5.0 MHz~13.0 MHz、高频探头频率≥7.5 MHz。要求患者保持仰卧位,彻底暴露左右侧乳房和腋窝,联合二维超声评估肿块大小心态、边缘及内部回声状况,随后再联合血流成像监测肿块内部、周围组织血流状态;详细探查腋窝处是否存在淋巴结。该项工作均由2名专业医师完成检查、阅片等工作,再联合BI-RADS予以分级[2]。
(2)钼靶X线检查。由全数字化钼靶X线机施行检查,即对左右侧乳房予以轴位、斜位摄片成像,若存在异常应增加重点组织摄片、加压摄片等操作,用以评估肿块位置、大小形态、边缘及组织钙化情况,还应鉴别其是否存在腋窝淋巴结。该项检查也由2名医师操作检查、阅片工作,再施行乳腺密度分级处理。
1.3 BI-RADS分级标准
依据美国放射学会BI-RADS分级标准,共划分为7个等级。即0级:未存在异常,做出评估结果前需再次施行影像学检查;1级,表现为阴性;2级,表现为良性征象;3级,疑似良性征象、边缘完整,但恶性风险低于2%,应施行3~6个月随访调查;4级,存在异常,应施行活检;5级,疑似恶性且占比较高,需采取对症处理;6级,活检已确诊为恶性。
1.4 乳腺密度分级
依据BI-RADS将乳腺密度予以分级,即ACR-1级,为脂肪型,高密度腺体占比低于25%;ACR-2级,为少量腺体型,高密度腺体占比25%~50%;ACR-3级,为多量腺体型,高密度腺体占比51%~75%;ACR-4级,为致密型,高密度腺体占比超过75%[3]。
1.5 诊断标准
(1)乳腺超声。二维超声肿块内部肺肾不均、形态不完整、边缘粗糙,纵横比超过1、回声衰减;彩色多普勒检查RI超过0.70、Vmax超过20 cm/s。满足1项彩色多普勒超声、2项二维超声即可判定为乳腺癌。
(2)钼靶X线。直接征象,结节和肿块均存在密度影,如致密浸润、星芒影及微小钙化灶,但斑点状颗粒样及铸型钙化均是恶性钙化;间接征象,血管和皮肤改变、结构紊乱及导管征象。满足1项间接征象、2项直接征象即可判定为乳腺癌。
(3)密度分级。依据钼靶X线密度,评估各密度下乳腺BI-RADS 5级率;再依据乳腺癌TNM分期系统,若肿瘤直径≤2 cm纳入T1期,评估T1期及以上乳腺BIRADS 5级率[4]。
1.6 统计学方法
通过统计软件SPSS 22.0,对本研究数据进行汇总处理。计数资料用率(%)表示,组间数据采用χ2检验。P<0.05证明数据比较有统计学意义。
2 结果
2.1 病理诊断
185例乳腺癌患者中,包括浸润性导管癌125例、导管内癌24例、黏液癌10例、乳头状癌10例、浸润性小叶癌8例、乳腺肉瘤8例。
2.2 乳腺密度分级
185例乳腺癌患者中,低密度乳腺82例、高密度乳腺103例,见表1。
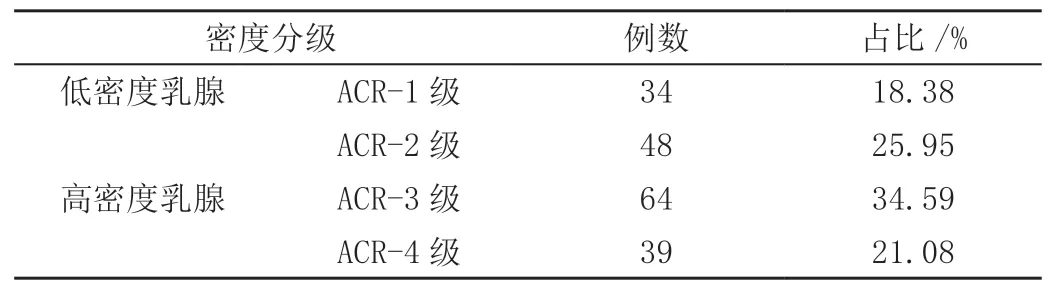
表1 乳腺密度分级
2.3 乳腺超声、钼靶X线影像学分级
低密度乳腺中,乳腺超声BI-RADS 5级率为56.10%(46/82)、钼靶X线BI-RADS 5级率为51.22%(42/82),两组无数据比较无统计学意义(P>0.05);高密度乳腺中,乳腺超声BI-RADS 5级率为66.02%(68/103)、钼靶X线BI-RADS 5级率为48.54%(50/103),两组数据比较有统计学意义(P<0.05)。同时,T1期及以上肿瘤中,乳腺超声BI-RADS 5级率均高于钼靶X线,两组数据比较有统计学意义(P<0.05)。
2.4 乳腺超声、钼靶X线诊断准确率
185例患者中,乳腺超声单独检查准确率为96.22%(178/185)、钼靶X线单独检查准确率为91.89%(170/185)、联合检查准确率为99.46%(184/185)。
2.5 微小钙化检出率
乳腺超声微小钙化检出率为148例(80.00%)、钼靶X线微小钙化检出率为165例(89.19%),两组数据比较有统计学意义(χ2=5.9935,P=0.0143<0.05)。
2.6 影像学表现
乳腺超声、钼靶X线均可见肿块内部微钙化灶,但前者检出率低于后者;乳腺超声可见肿块边缘为蟹足样,但钼靶X线边界模糊不均,但均存在边缘毛刺。
3 讨论
乳腺癌是女性群体恶性肿瘤的代表,发病率约占全身恶性肿瘤7%~10%,致死率位居女性恶性肿瘤前两位,年均增长率为2%~3%,是目前危害居民身心健康的病症。特别是在早期乳腺癌患者中,由于起病隐匿、症状表现不显著,多易被忽略,一旦确诊均已步入晚期,延误最佳治疗时机,导致患者预后效果较差,即做好疾病早期诊断及检查,是目前医疗机构首要思考的焦点[5]。
随着乳腺癌研究工作的持续性深入,早期患病时患者均存在以下症状表现:部分早期患者乳房虽未存在肿块,但却存在不适感,特别为绝经期女性自感单侧乳房轻微疼痛、背部发沉和酸胀感,还会累及至患侧上臂;可触及蚕豆样肿块,质地较硬,少数患者伴有阵发性隐痛、刺痛和钝痛;肿块处皮肤组织隆起,呈橘皮状,较为严重时还会出现水肿、变色和湿疹样等改变[6]。
乳腺超声作为乳腺癌疾病检查常见方式,可直观展现肿块处血液流动状态、形态大小及血管分布状况,有利于乳腺癌诊断。但由于乳腺癌、乳腺结节间血流程度存在相似性,如血流丰富的纤维腺瘤,极易引起阳性误诊,但若阳性患者血管发育较慢会呈现假阴性。钼靶X线为整体摄片,用以评估乳腺整体状况,应检出率和特异度较高,更适用于微小病灶,但该检查方式具有放射性,受检者极易受到辐射刺激,急性乳腺炎、妊娠期或哺乳期女性禁用[7]。
钙化是鉴别乳腺肿块良恶性的关键性指标。和正常细胞组织比较,乳腺癌细胞代谢程度明显增强,表现为血供失衡,还会加快铁血黄素沉着,使之在增加钙离子、碱性磷酸酶含量的同时,诱发组织钙化。以乳腺超声为例,极易将乳腺纤维囊和导管壁等结构横断面误诊成钙化,难以评估微钙化,这也是乳腺超声微钙化检出率低的原因。本研究可知,乳腺超声微小钙化检出率为80.00%、钼靶X线微小钙化检出率为89.19%,两组数据比较有统计学意义(P<0.05)。
综上所述,在乳腺癌患者临床检查中,乳腺超声、钼靶X线虽可起到疾病检出的效果,但却存在自身优劣势,可通过联合检查的方式弥补自身缺陷,以便可尽早发现肿块,挽救患者生命安全。

