基于RNAi技术研究六点始叶螨转录因子Nrf2调控抗氧化酶的功能
梁晓 陈青 伍春玲 方永军


摘 要:转录因子Nrf2对脊椎动物抗氧化酶的调控起关键作用,然而当前Nrf2对害虫(螨)抗氧化酶调控功能的相关研究报道较少,本研究拟克隆六点始叶螨转录因子EsNrf2,并分析采用RNAi沉默EsNrf2对六点始叶螨取食感螨橡胶树种质‘IAN2904和抗螨橡胶树种质‘IRCI12后抗氧化酶EsSOD、EsCAT基因表达水平和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的影响。结果表明,采用RACE-PCR从六点始叶螨体内克隆得到大小为1719 bp的序列,并经同源分析和功能域注释确证其为六点始叶螨转录因子EsNrf2。饲喂浓度为50 ng/?L的dsEsNrf2 48 h后对EsNrf2基因的沉默效率达到90.6%,进一步研究发现,与EsNrf2沉默前相比,EsNrf2沉默后六点始叶螨取食抗、感螨橡胶树种质后体内EsSOD和EsCAT的基因表达量、SOD和CAT酶的活性均显著降低(P<0.05)。上述结果从分子水平证明EsNrf2能够调控六点始叶螨抗氧化酶SOD和CAT的表达。
关键词:RNAi;六点始叶螨;转录因子Nrf2;抗氧化酶;调控功能
Abstract: The transcription factor Nrf2 (Nuclear factor erythroid 2-related factor) plays a key role in regulating antioxidant enzymes in vertebrates. However, there are few reports regarding the Nrf2 function of insects (mites). This study aimed to clone the Nrf2 gene of Eotetranychus sexmaculatus (EsNrf2), furthermore, after EsNrf2 was silenced via RNA interference (RNAi), the transcription of EsSOD and EsCAT and enzyme activity of SOD and CAT was analyzed while E. sexmaculatus feeding on mite-susceptible rubber tree germplasm ‘IAN2904 and mite-resistant rubber tree germplasm ‘IRCI12, respectively. The results showed a sequence 1719 bp long was cloned using RACE-PCR, and then it was identified as transcription factor EsNrf2 by homology analysis and conserved domain. In addition, it was found that EsNrf2 silencing efficiency could reach 90.6% after feeding 50 ng/?L of dsEsNrf2 for 48 hours. Further analysis showed that, compared with those before silencing, the transcription of EsSOD and EsCAT as well as the activity of SOD and CAT were significantly reduced after RNAi of EsNrf2 (P < 0.05). The above results showed that EsNrf2 could regulate the expression of SOD and CAT in E. sexmaculatus.
Keywords: RNAi; Eotetranychus sexmaculatus; transcription factor Nrf2; antioxidant enzymes; regulation function
天然橡膠是我国重要的战略物资,在国防和国民经济建设中具有不可替代的作用。我国是世界上第一大天然橡胶消费国和进口国,对外依存度已超过80%,天然橡胶安全问题的严峻性十分突出[1-2]。六点始叶螨(Eotetranychus sexmaculatus)是危害我国橡胶树最严重的一种世界危险性害螨,2008年以来六点始叶螨在海南、云南多地的橡胶树上暴发成灾,导致大量叶子变黄脱落、开割树停割,胶乳产量急剧下降[3]。当前,各橡胶产区对于该螨的防治仍依赖于化学药剂防治,但橡胶树高大,药剂难以靶标,防治难度很大,特别是药剂防治过程中因施药技术落后所致农药的有效利用率不足、使用频率与剂量不断加大和“3R”等问题严重[4]。因此,寻求有效的控制橡胶害螨且符合环保要求的新的防治策略和防治方法,成为当前我国天然橡胶产业发展中亟待解决的重要课题。
培育抗性品种是防治橡胶害螨最经济、最有效、最简便的方法,而研究害螨取食不同橡胶树种质后对其生理生化的影响能够为抗螨种质资源的鉴定、评价与创新,以及害螨的高效防治技术研究提供重要科学依据。前期研究中从国家天然橡胶树种质资源圃核心种质中筛选出‘IRCI12‘IAN29042份种质分别对六点始叶螨表现出稳定良好的抗、感特性[4]。相关研究表明,害虫(螨)体内抗氧化酶的活性变化与其取食寄主作物的适应性密切相关[5-9]。前期研究也发现,抗螨种质能显著抑制六点始叶螨抗氧化酶活性,例如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的活性,转录因子Nrf2(Nuclear factor erythroid 2-related factor, Nrf2)对脊椎动物抗氧化酶的调控起关键作用[10],但目前为止Nrf2调控害螨抗氧化酶的相关报道很少。本研究拟从六点始叶螨体内克隆EsNrf2,然后采用RNAi技术沉默EsNrf2对六点始叶螨取食抗、感橡胶树种质时抗氧化酶基因表达水平和酶活性的影响,从分子水平解析EsNrf2对六点始叶螨抗氧化酶的调控功能,为橡胶树害螨的高效综合防控提供新的解决方案。
1 材料与方法
1.1 材料
1.1.1 供试橡胶树种质 选用遗传稳定的抗螨参照橡胶树种质‘IRCI12和感螨参照橡胶树种质‘IAN2904为试验材料[4]。‘IRCI12和‘IAN2904均由中国热带农业科学院橡胶研究所国家橡胶种质资源圃提供。
1.1.2 供试六点始叶螨 供试六点始叶螨为实验室以感螨参照橡胶树种质‘IAN2904新鲜叶片继代饲养的室内种群。将六点始叶螨雌成螨分别接于橡胶树叶背面,并将叶子放置于长25 cm、宽19 cm的白瓷盘中湿润海绵上方,同时以湿润吸水纸围拢于叶片周围以防止试螨逃离,每隔3~5 d更换叶片以保证材料新鲜。饲养条件为:温度(25±1)℃,相对湿度(75±5)%,光照周期14(L)∶10(D)的人工气候箱中。
1.1.3 供试试剂 组织匀浆机、高速冷冻离心机、Bio-Rad qPCR系统(Bio-Rad, USA)等。RNA提取及酶活测定相关试剂均购自Sigma公司,SMART RACE试剂盒购自Clontech公司(美国),MEGAscript? RNAi试剂盒购自Ambion公司(美国),cDNA合成试剂盒、Master mix、MaximaTM SYBR Green qPCR Master Mix试剂盒均为Fer mentas公司产品(Fermentas, Glen Burnie, MD)。
1.2 方法
1.2.1 六点始叶螨EsNrf2基因的克隆 从实验室前期构建的六点始叶螨转录组数据库中筛选获得的疑似EsNrf2基因的部分序列信息设计5RACE和3RACE引物(表1),利用SMART RACE试剂盒分别扩增得到EsNrf2基因5和3端序列,序列经测序后进行拼接得到完整的cDNA序列,根据ORF Finder软件预测的编码区(coding sequence, CDS)设计引物(表1)进行PCR扩增、测序得到EsNrf2编码区全长序列。EsNrf2基因克隆的PCR程序如下:94 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s(每个循环降低1 ℃),72 ℃延伸2 min,10个循环;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,20个循环;最后72 ℃再延伸10 min。
1.2.2 六点始葉螨EsNrf2与不同昆虫(螨)Nrf2基因的序列比对 将六点始叶螨Nrf2氨基酸序列(基因登录号:MT134458)与NCBI数据库(https://www.ncbi.nlm.nih.gov/)中已经发布的12种不同昆虫(螨)[包括二斑叶螨(Tetranychus urticae)、中华蜜蜂(Apis cerana)、意大利蜜蜂(Apis mellifera)、松叶蜂(Neodiprion lecontei)、赤拟谷盗(Tribolium castaneum)、大红斑蝶(Danaus plexippus)、乳草蝽(Oncopeltus fasciatus)、小菜蛾(Plutella xylostella)、草地贪夜蛾(Spodoptera frugiperda)、埃及伊蚊(Aedes aegypti)、致倦库蚊(Culex quinquefasciatus)、冈比亚按蚊(Anopheles gambiae)]的Nrf2氨基酸序列进行序列比对。采用DNAman 9.0软件进行序列比对,并同时构建不同昆虫(螨)Nrf2基因的系统进化树。利用在线网站https://web.expasy.org/ protparam/预测各个Nrf2基因的保守功能结构域。利用在线软件Weblogo(http://weblogo.berkeley. edu/logo.cgi)绘制Nrf2基因保守功能结构域。
1.2.3 RNAi介导的六点始叶螨EsNrf2基因沉默 以六点始叶螨EsNrf2基因CDS全长序列为模板,利用在线引物设计软件E-RNAi(http://www. dkfz.de/signaling/e-rnai3/idseq.php)设计引物合成双链RNA(dsRNA)用于EsNrf2的基因沉默。设计好的引物5端添加T7启动子序列(表1),以绿色荧光蛋白(GFP)序列为模板合成双链RNA dsGFP,并以此作为RNAi介导的六点始叶螨EsNrf2基因沉默的对照,dsRNA的合成方法参照MEGAscript? RNAi试剂盒说明书。参照Shi等[11]建立的饲喂法对六点始叶螨饲喂dsRNA(dsEs Nrf2和dsGFP)进行基因沉默,dsEsNrf2饲喂的浓度设置为50、100和200 ng/?L,dsGFP饲喂的浓度为200 ng/?L,分别于饲喂24、48、96 h后采集六点始叶螨样品用于RNA提取,随后采用RT-qPCR分析EsNrf2表达量的变化(引物参见表1),以确定最佳的dsRNA饲喂浓度和时间。每个处理设置3个重复,每个重复约50头螨。
1.2.4 沉默EsNrf2对六点始叶螨死亡率的影响 根据1.2.3中确定的dsRNA最佳饲喂浓度和时间沉默六点始叶螨EsNrf2,并观察EsNrf2基因沉默对六点始叶螨取食抗螨橡胶树种质‘IRCI12和感螨橡胶树种质‘IAN2904对死亡率的影响,连续观察7 d,以明确EsNrf2基因沉默对死亡率影响不显著的临界时间点。
1.2.5 沉默EsNrf2对六点始叶螨SOD和CAT基因表达和酶活性的影响 根据1.2.4确定的对害螨死亡率影响不显著的时间范围,分析沉默EsNrf2对六点始叶螨取食抗、感橡胶树种质后EsSOD和EsCAT基因表达量、SOD和CAT酶活性的影响。采用RT-qPCR进行EsSOD和EsCAT基因表达量分析,以六点始叶螨actin基因作为内参(引物参见表1),重复3次,每个重复50头螨,PCR反应条件为:95 ℃预温育1 min后,以40个循环完成如下程序:95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸20 s。根据Pfaffl的2?ΔΔCt方法计算基因的相对表达量[12]。SOD和CAT酶的活性测定分别参照Lu等[13]的方法,重复3次,每个重复200头螨。
1.3 数据处理
采用SPSS软件中的Duncans新复极差法进行数据间的多重比较以及差异显著性分析,显著性水平α=0.05。RT-qPCR分析相对表达量的变化情况,以对照或处理前的表达量设置为1.0,處理后的表达量以相对对照或者处理前的倍数或者百分率表示。
2 结果与分析
2.1 六点始叶螨EsNrf2基因的克隆
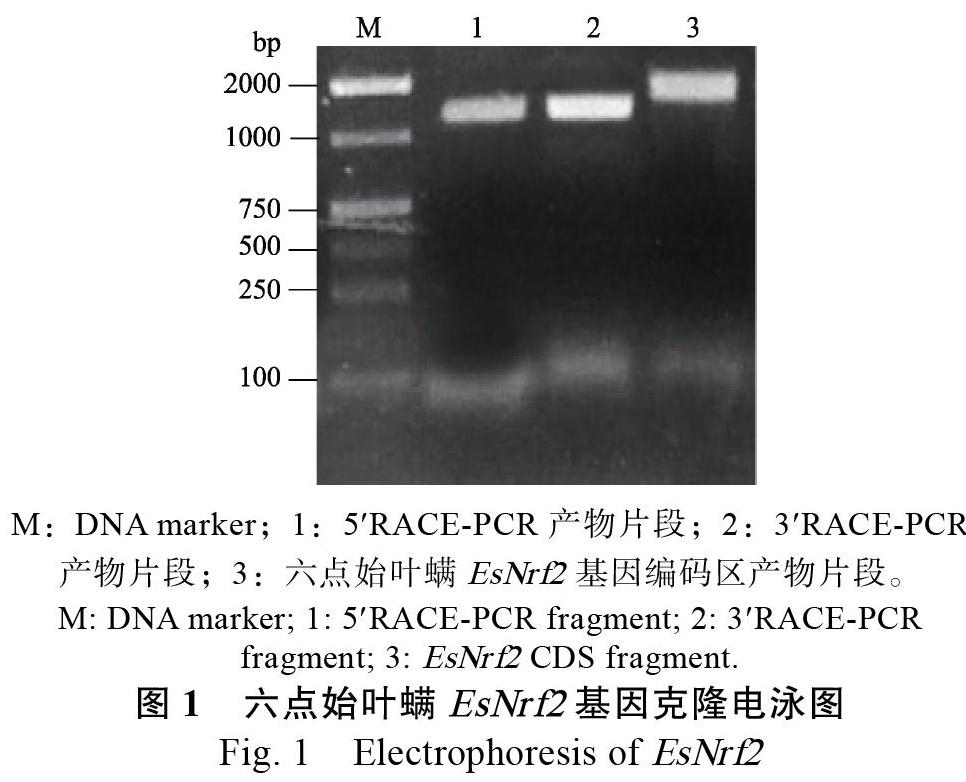
由5和3RACE-PCR分别获得2条大小约为1500 bp的基因片段(图1),测序结果表明这2个片段可能分别为六点始叶螨EsNrf2基因的5和3端序列,序列经测序拼接后得到六点始叶螨EsNrf2 cDNA全长。采用CDS引物进一步通过PCR扩增、测序得到全长为1719 bp的六点始叶螨EsNrf2基因(图2)。
2.2 六点始叶螨EsNrf2基因与不同昆虫(螨)Nrf2基因的序列比对
序列比对结果表明,尽管不同昆虫(螨)之间的Nrf2氨基酸序列总体相似度不高,但蛋白质结构预测分析结果表明,Nrf2转录因子特有的保守序列即DNA结合域(DNA binding domain)(图3,图4)与不同昆虫(螨)的相似度在90.2%~96.7%之间(图4B)。功能域注释结果表明克隆获得的六点始叶螨EsNrf2同样具有该保守功能区,并且与二斑叶螨TuNrf2(XP_015783848.1)的序列相似度最高,达到96.7%,在进化上聚类于同一分支(图4A)。上述序列比对结果表明克隆得到的基因序列确定为六点始叶螨EsNrf2基因。
2.3 不同dsRNA饲喂浓度和时间对六点始叶螨EsNrf2基因沉默效率的影响
图5结果表明,dsEsNrf2分别以浓度为50、100、200 ng/?L饲喂六点始叶螨24 h后,EsNrf2的基因表达量与饲喂dsGFP对照的相比显著降低,分别为对照的36.4%、34.6%和24.0%,而饲喂48 h和96 h后EsNrf2表达量进一步降低,仅分别为对照的9.4%、7.9%、7.8%和10.3%、8.5%、8.7%,对应的沉默效率达到90.6%、92.1%、92.2%和89.7%、91.5%、91.3%,并显著低于对照和饲喂不同浓度dsEsNrf2 24 h后的表达水平。由于饲喂不同浓度dsEsNrf2 48 h和96 h后各处理间的沉默效率无显著差异,因此饲喂50 ng/?L的dsEsNrf2黑框部分序列为不同物种Nrf2的DNA结合区域。
2.4 沉默EsNrf2对六点始叶螨死亡率的影响
图6结果表明,无论转录因子EsNrf2沉默与否,六点始叶螨取食感螨橡胶树种质‘IAN29041~3 d内,死亡率始终维持在低于10%的水平,而3 d后沉默了EsNrf2的害螨死亡率急剧升高,到7 d时达到78.9%。而尽管EsNrf2未被沉默,六点始叶螨取食抗螨橡胶树种质‘IRCI127 d后,死亡率依然到达48.8%,EsNrf2沉默后取食‘IRCI121~7 d内死亡率持续升高,7 d后达到100%。由于在取食抗、感螨橡胶树种质2 d(48 h)内,六点始叶螨死亡率均低于10%,因此,为保证足够的害螨来源用于分析EsNrf2沉默后六点始叶螨取食抗、感螨种质对体内SOD和CAT基因表达量和酶活性的影响,分析的时间点选择取食后48 h。
2.5 沉默六点始叶螨转录因子Nrf2对抗氧化酶基因表达的影响
沉默六点始叶螨转录因子EsNrf2前,六点始叶螨取食感螨橡胶树种质‘IAN290448 h后EsSOD和EsCAT的基因表达量和取食前相比均无显著差异,而取食抗螨感橡胶树种质‘IRCI12后这2个基因的表达量显著分别降至取食前的0.53倍和0.48倍。沉默EsNrf2后,六点始叶螨取食‘IAN2904后EsSOD和EsCAT的基因表达量分别显著降至取食前的0.45倍和0.46倍,取食‘IRCI12后这2个基因的表达量降低幅度与取食前相比差异更为显著,分别为取食前的0.24倍和0.26倍(图7)。上述结果表明沉默转录因子EsNrf2后会对EsSOD和EsCAT基因产生显著的抑制作用。
2.6 沉默六点始叶螨转录因子Nrf2对抗氧化酶活性的影响
沉默六点始叶螨转录因子EsNrf2前,六点始叶螨取食感螨橡胶树种质‘IAN290448 h后SOD和CAT酶活性和取食前相比均无显著差异,分别为85.2 U/mg和38.6 U/mg,而取食抗螨感橡胶树种质‘IRCI12后这2个抗氧化酶的活性分别显著降至38.1 U/mg和23.1 U/mg。沉默EsNrf2后,六点始叶螨取食‘IAN2904后SOD和CAT酶活性分别显著降至46.2 U/mg和19.6 U/mg,取食‘IRCI12后这2个酶活性降低幅度与取食前相比差异更为显著,仅分别为26.4 U/mg和12.3 U/mg(图8)。上述结果表明,沉默转录因子EsNrf2后会对SOD和CAT酶活性产生显著的抑制作用,这与其对应的基因表达量的变化趋势表现一致。
3 讨论
六点始叶螨转录因子EsNrf2的基因表达量与抗氧化酶基因的表达量、抗氧化酶酶活变化趋势相一致,从分子水平初步证实了EsNrf2对抗氧化酶具有调控功能。前期研究表明,六点始叶螨取食抗螨橡胶树种质‘IRCI12后SOD和CAT酶活受到显著抑制,而取食感螨橡胶树种质后这2个酶活性无显著变化[4, 13]。本研究在前期研究基础上进一步采用RNAi沉默EsNrf2,发现六点始叶螨取食‘IRCI12后SOD和CAT酶活性受抑制程度与未沉默对照相比还能进一步显著提高,而取食‘IAN2904后这2个酶活性也被显著抑制,这进一步证实了EsNrf2对SOD和CAT的调控功能。此外,前期针对朱砂叶螨转录因子TcNrf2的研究表明,抑制剂、激活剂处理能够显著降低或提高TcNrf2的基因表达水平,并进而抑制或诱导抗氧化酶SOD和CAT的基因表达和酶活性[14],本研究结果表明EsNrf2和TcNrf2在进化上属于同一分支,而研究结果进一步证实Nrf2基因调控抗氧化酶的功能在这2种害螨上具有一致性。事实上,Nrf2基因调控抗氧化酶基因表达的功能已经在多个模式生物中被验证,研究者采用特异性化合物处理、RNAi、基因敲除等手段干预Nrf2基因从而影响了下游抗氧化酶基因表达水平,这在小鼠[15-17]、果蝇[18-19]、斑马鱼[20-21]等研究中已有多个成功案例,本研究进一步拓展了Nrf2基因功能的适用物种范围。
研究转录因子Nrf2对抗氧化酶的调控功能,能够为害虫(螨)的绿色防控策略的制定提供新的思路。Nrf2作为应对外界应激和胁迫的中央转录因子,除了能够调控抗氧化酶,同时也能调控解毒酶,例如细胞色素P450酶、谷胱甘肽转移酶,以及其他一些保护蛋白的表达[18],是潜在的害虫防控的新靶点。通过对转录因子Nrf2进行干预,破坏其对保护性酶和蛋白的调控功能,能够最大限度削弱害虫对氧化损伤的修复能力以及对有毒物质的解毒能力。在果蝇的Nrf2研究中,已有学者提出该基因可能在害虫抗药性治理中具有较大应用前景[22-23],但目前该理论尚缺乏实践基础。本研究仅从转录水平证实抑制和激活转录因子EsNrf2的表达对下游抗氧化酶基因表达的影响,后续研究应进一步证实EsNrf2对解毒酶等其他相关酶系的调控功能,以期为将来把EsNrf2作为害虫(螨)防治靶标提供理论依据。
参考文献
孙晓艳. 橡胶产业海内外发展的优劣势分析——以广东农垦为例[J]. 中国农垦, 2019(3): 39-42.
佘时英. 2008年我国天然橡胶产业状况与形势分析[J]. 世界热带农业信息, 2008(8): 11-14.
张方平, 朱俊洪, 李 磊, 等. 不同生长期橡胶叶对六点始叶螨选择性及种群增长影响[J]. 热带作物学报, 2016, 37(1): 153-157.
张会英, 卢芙萍, 卢 辉, 等. 抗、感橡胶树种质对六点始叶螨发育与繁殖的影响[J]. 热带作物学报, 2014, 35(6): 1166-1171.
Aucoin R, Guillet G, Murray C, Philogène B J, et al. How do insect herbivores cope with the extreme oxidative stress of phototoxic host plants?[J]. Archives of Insect Biochemistry and Physiology, 1995, 29(2): 211-226.
Barbehenn R V. Gut-based antioxidant enzymes in a polyphagous and a graminivorous grasshopper[J]. Journal of Chemical Ecology, 2002(28): 1329-1347.
Krishnan N, Kodrík D. Antioxidant enzymes in Spodoptera littoralis (Boisduval): Are they enhanced to protect gut tissues during oxidative stress?[J]. Journal of Insect Physiology, 2006, 52(1): 11-20.
?ukasik I, Go?awska S, Wójcicka A. Antioxidant defense mechanisms of cereal aphids based on ascorbate and ascorbate peroxidase[J]. Biologia, 2009, 64(5): 994-998.
胡黎华. 寄主转换对橘小实蝇种群动态和抗氧化酶系的影响[D]. 重庆: 西南大学, 2011.
Huang X S, Chen H P, Yu H H, et al. Nrf2-dependent upregulation of antioxidative enzymes: A novel pathway for hypoxic preconditioning-mediated delayed cardioprotection[J]. Molecular and Cellular Biochemistry, 2014, 385(1/2): 33-41.
Shi L, Zhang J, Shen G M, et al. Silencing NADPH-cytochrome P450 reductase results in reduced acaricide resistance in Tetranychus cinnabarinus (Boisduval)[J]. Scientific Reports, 2015, 5: 15581.
Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): e45.
Lu F P, Chen Z S, Lu H, et al. Effects of resistant and susceptible rubber germplasms on development, reproduction and protective enzyme activities of Eotetranychus sexmaculatus (Acari: Tetranychidae)[J]. Experimental and Applied Acarology, 2016, 69(4): 427-443.
高錦涛, 梁 晓, 伍春玲, 等. 朱砂叶螨转录因子TcNrf2对抗氧化酶基因表达的调控功能初步研究[J]. 热带作物学报, 2019, 40(6): 1163-1170.
李雪丽, 唐 云, 许雪珠. 核转录因子Nrf2最新研究进展[J]. 中国组织工程研究, 2012, 16(24): 4530-4534.
Paul N, Michael M, Ken I, et al. Identification of a novel Nrf2-regulated antioxidant response element (ARE) in the mouse NAD(P)H: quinone oxidoreductase 1 gene: reassessment of the ARE consensus sequence[J]. Biochemical Journal, 2003, 374(2): 337-348.
Tetsuro I, Ken I, Masayuki Y. Roles of Nrf2 in activation of antioxidant enzyme genes via antioxidant responsive elements[J]. Methods in Enzymology, 2002, 348(1): 182-190.
Misra J R, Horner M A, Lam, G, et al. Transcriptional regulation of xenobiotic detoxification in Drosophila[J]. Genes & Development, 2011, 25(3): 1796-1806.
Hochmuth C E, Biteau B, Bohmann D, et al. Redox regulation by Keap1 and Nrf2 controls intestinal stem cell proliferation in Drosophila[J]. Cell Stem Cell, 2011, 8(2): 188-199.
Soon K, Kim C. Taurine chloramine administered in vivo increases NRF2-regulated antioxidant enzyme expression in murine peritoneal macrophages[J]. Advances in Experimental Medicine and Biology, 2013, 775(12): 259-267.
Timme-Laragy A R, Karchner S I, Franks D G, et al. Nrf2b, novel zebrafish paralog of oxidant-responsive transcription factor NF-E2-related factor 2 (NRF2)[J]. Journal of Biological Chemistry, 2012, 287(7): 4609-4627.
Pitoniak A, Bohmann D. Mechanisms and functions of Nrf2 signaling in Drosophila[J]. Free Radical Biology and Medicine, 2015, 88(11): 302-313.
石 力. 朱砂葉螨抗甲氰菊酯P450基因鉴定及其转录调控研究[D]. 重庆: 西南大学, 2017.
责任编辑:谢龙莲

