低浓度含锰井水曝气与锰砂处理技术初步探讨
谭龙辉,汪朝武,李梦婷,胡孝武
(湖南博一环保科技有限公司,湖南长沙 410000)
地下水作为一种非常重要的淡水资源,直接影响着人们的日常生活[1]。松桃县巴坳村老卜刺水井属于地下涌水井,出水量360 m3/h(枯水期),温度12~18℃,是该地区非常重要的生活用水来源。但是由于松桃县锰矿资源丰富,加之附近的电解金属锰渣场渗透的影响,导致该水源中Mn浓度达到5~12 mg/L。根据国家《污水综合治理排放标准》(GB 8978—1996),污水排放时Mn不得高于2 mg/L;根据《中华人民共和国地下水质量标准》(GB/T 14848—93),Mn>1 mg/L属于Ⅴ类,不得饮用。所以该井水的Mn已经严重超标。
锰作为人体必须的微量元素,过量则会对机体产生毒性,即锰中毒。高锰主要影响中枢神经系统,尤其是黑质——纹状体系统,引起神经递质多巴胺量的变化,从而表现一系列锥体外系症状,类似于帕金森综合症[2-4]。这将对从事锰矿开采和锰冶金以及长期接触Mn超标生活用水的人造成极为严重的身体损害,因此对该井水进行锰净化处理迫在眉睫。
目前常用的含锰废水的处理技术包括:沉淀法[5]、吸附法[6-8]、离子交换法[9-10]、膜技术[11-12]、电化学法[13-14]及氧化过滤法[15-17]等。其中氧化过滤法由于对用电没有需求,是一种适用农村地区的高效且经济的技术。此外,井水中的锰污染属于低浓度的含锰渗滤液,因此本试验采用氧化过滤法中空气氧化与锰砂组合进行井水除锰工艺研究,将Mn降至2 mg/L以下,使之满足国家《污水综合治理排放标准》(GB 8978—1996)。
1 材料与方法
1.1 实验材料
1.1.1 实验原料
水样取自松桃县巴坳村老卜刺水井的含锰井水,实验期间水质参数:锰浓度为5~12 mg/L,pH(pH计测量)为8.4左右,温度为12~18℃。根据中华人民共和国城镇建设行业标准《水处理用天然锰砂滤料》(CJ/T 3041—1995),用于地下水除锰的天然锰砂滤料,其锰的形态应以氧化锰为主。含锰量(以MnO2计)不应小于35%的天然锰砂滤料,可用于地下水除锰。故本实验采用了含锰量高于35%且密度约为2.47 g/cm3的锰砂。
1.1.2 实验仪器及试剂
实验中使用的仪器包括:DJ1C增力电动搅拌器,BZ1SA-10型全自动空气泵,TD10002电子天平,WFX-1E3型原子吸收分光光度计,PHB-5型便携式酸度计以及内径Φ1 cm的橡胶管以及玻璃仪器若干。调节井水pH使用分析纯级NaOH。
1.1.3 实验装置及工艺流程
实验中用到的主要装置有烧杯、漏斗和锰砂过滤模型装置,主要实验装置如图1所示,其工艺流程图如图2所示。

图1 实验装置Fig.1 Experimental device
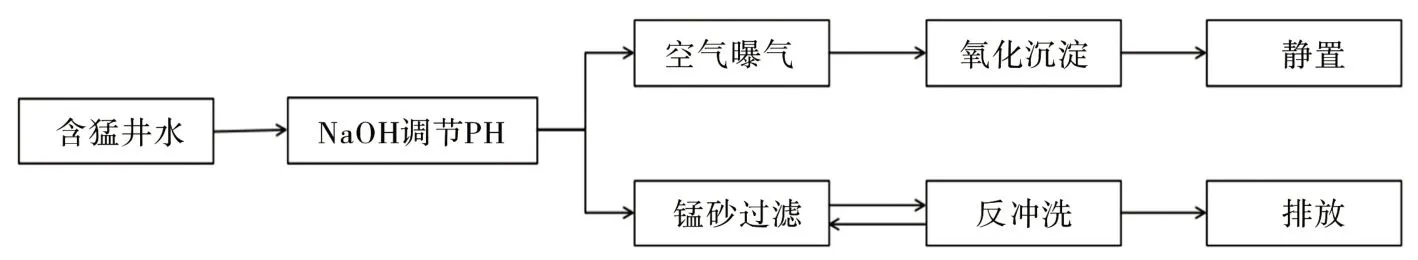
图2 工艺流程图Fig.2 Process flow diagram
1.2 实验方法
1.2.1 实验设计
(1)空气氧化除锰。先对井水进行取样分析,检测其中的Mn浓度。然后准确量取一定体积的井水样于烧杯中,加NaOH调节pH值,随后用真空泵向烧杯中通入空气,通过搅拌一定时间后再次取样分析其中Mn浓度。
(2)锰砂过滤除锰。准确称取一定质量的锰砂,装入橡胶管中,振实,橡胶管上端装上漏斗,加清水洗净锰砂中的泥土和杂物等。过滤前分析井水中的Mn浓度。将事先准备的井水倒入漏斗,沿锰砂柱流下。详细记录一定时间内流过的体积,并取样分析滤液中的Mn浓度,直至滤液中的Mn与进水中的Mn浓度相近时,停止过滤。
1.2.2 测试分析方法
水样的Mn浓度均采用火焰原子吸收分光光度法测定,pH采用便携式酸度计检测和精密pH试纸检测。
2 结果与分析
2.1 空气氧化除锰
实验研究了pH、反应时间、不同Mn浓度及不同溶解氧浓度的井水样对空气氧化除锰效果的影响。
2.1.1 pH对空气氧化除锰效果的影响
取13.5 L井水,经检测其Mn浓度为9.46 mg/L,将井水等分成三组,每组设置三个平行,分别加入9.0 mL、11.0 mL、13.2 mL浓度为0.45 mol/L的NaOH将pH调节至8.0、8.5和9.0。再使用空气泵向烧杯中通入10 L/min的空气流量,分别于30 min和60 min时取水样测量Mn浓度及pH,其结果如图3所示。
从图3可知,当pH为8.0时,即使反应时间达到60 min,水样中的Mn浓度仍然高达3.96 mg/L是污水排放标准2 mg/L的2倍。而当pH为8.5时,反应时间只需要30min,水样中的Mn浓度为1.79mg/L<2mg/L,达到国家《污水综合治理排放标准》(GB 8978—1996)。当pH为9.0时,反应时间达到60 min,水样中的Mn浓度为0.98 mg/L<1 mg/L,甚至达到《中华人民共和国地下水质量标准》(GB/T 14848—93)IV类水标准。以上结果表明,水样的pH越高,空气氧化除锰的效果越明显,但随着反应的进行,水样中的pH值逐渐下降,这是由于反应会消耗水样中OH-,从而导致溶液pH值和反应速率下降。
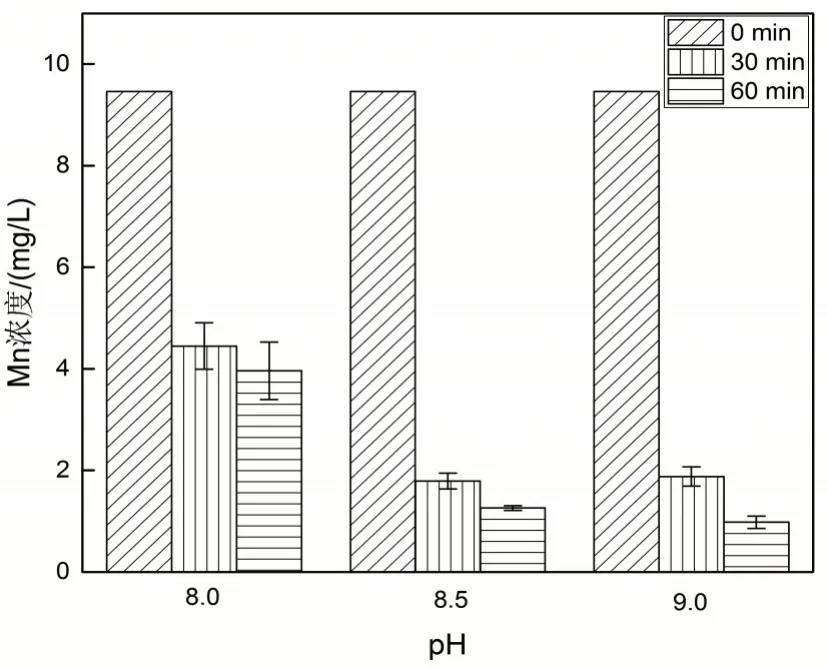
图3 pH对于空气氧化除锰效果的影响Fig.3 The influence of pH on the manganese abatement by air oxidation.
2.1.2 不同Mn浓度的井水样对空气氧化除锰效果的影响
由于井水的锰浓度受到当地锰矿开采企业的影响,因此需要进一步研究空气氧化法处理不同Mn浓度井水的效果。取Mn浓度为5 mg/L、10 mg/L、15 mg/L、20 mg/L和25 mg/L的井水各1.5 L分别置入编号为1-5的烧杯中,设置3组平行,根据pH对空气氧化除锰效果影响的实验结果,各烧杯中分别加入13 mL浓度为0.45 mol/L的NaOH将pH调节至最佳值9作为水样的初始pH值。后续实验步骤和2.2.1一致,实验结果如图4所示。
从图4可知,随着水样中Mn浓度的增加,空气氧化法除锰速率随之降低。且对于15 mg/L及以上浓度在120 min后其滤液Mn浓度基本稳定,其水样的pH值表现出不断下降,当pH下降到7.5以下时,水样中的Mn浓度几乎不再下降。这是由于Mn2+与氧气反应会不断消耗水中的OH-,即Mn浓度越高消耗水中的OH-就越多,因此15 mg/L及以上Mn浓度井水消耗水中的OH-使pH下降到7.5以下时,余下Mn浓度很难再下降,无法达到国家《污水综合治理排放标准》(GB 8978—1996)。对于10 mg/L及以下浓度在60 min时,其滤液Mn浓度已低于2 mg/L,说明空气氧化法除锰只适用于处理较低浓度的含锰井水。

图4 空气氧化法处理不同Mn浓度井水样的除锰效果Fig.4 The manganese removal performance by the air oxidation method in treating well water samples of different manganese concentration
2.1.3 溶解氧浓度对空气氧化除锰效果的影响
根据图4结果,在pH为9时,15 mg/L及以上浓度采用空气氧化除锰无法将Mn浓度减少至2 mg/L。考虑到溶解氧浓度可能对空气氧化除锰效果有一定影响,我们进行了溶解氧浓度影响实验,通过选用pH为9、Mn浓度为15 mg/L的井水作为水样,控制真空泵通入空气的流量来改变井水的溶解氧浓度,实验结果如图5所示。
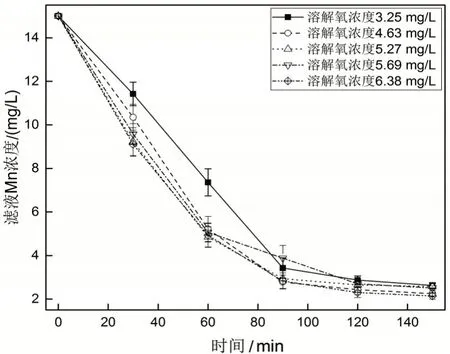
图5 溶解氧浓度对空气氧化除锰效果的影响Fig.5 The influence of dissolved oxygen concentration for air oxidation to remove manganese
从图5可以看出随着溶解氧浓度的增加,相同时间内滤液Mn浓度越低,说明溶解氧浓度可以加快空气氧化除锰的速率,但即使溶解氧浓度为6.38 mg/L时,第120分钟时滤液Mn浓度为2.3 mg/L,第150分钟时仍有2.14 mg/L>2 mg/L,而溶解氧浓度为3.25 mg/L时,第150分钟时滤液Mn浓度也只有2.63 mg/L,因此溶解氧浓度虽然可以加快除锰速率,但对除锰效果的提升有限。究其原因,可能是由于溶解氧和Mn浓度都比较高时,氧气与Mn2+反应的速率会加快,但同时消耗的OH-速率也会加快,因此pH浓度限制了除锰效果。
2.2 锰砂过滤除锰
实验研究了锰砂的吸附容量,不同锰砂柱长度对于锰砂吸附效果的影响及pH值对于锰砂吸附效果及吸附容量的影响。
2.2.1 锰砂吸附容量实验
称取266 g锰砂装入直径1 cm的橡胶管,振实,装载总长度1.35 m。直接将含锰井水经锰砂过滤,每4小时换一次滤布,详细记录每小时滤液的体积,并取样分析Mn浓度,实验结果如图6所示。
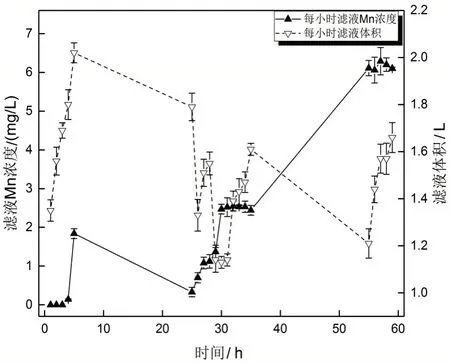
图6 锰砂吸附容量实验结果Fig.6 Experimental results of manganese sand adsorption capacity
从图6可知,随着时间的增加,滤液中Mn浓度逐渐增加,当过滤持续30 h时,滤液中的Mn浓度为2.47 mg/L>2 mg/L,且在随后的时间中滤液中的Mn浓度一直高于2 mg/L。当过滤时间持续到第59小时时,滤液中Mn浓度和进液中Mn浓度基本相近,这说明锰砂的总吸附Mn量已经趋于饱和,此时根据锰砂总吸附Mn量和锰砂质量得到每克锰砂平均吸附Mn量为1.95 mg。
从图7可以看出,随着时间的增加,锰砂每小时的吸附Mn量呈整体下降趋势,这是由于随着反应的进行,锰砂表面的MnO2逐渐减少,且被反应中生成的Mn2O3所覆盖,阻止了反应的进行,最终导致吸附量的不断下降,直至吸附量达到饱和,不再吸附。

图7 锰砂每小时吸附Mn量随时间的变化Fig.7 The evolution of manganese sand adsorption capacity
2.2.2 不同锰砂柱长度以及溶液pH对锰砂吸附效果的影响
(1)锰砂柱长度对吸附效果的影响。由于锰砂柱的过长会导致过滤速度过慢,为加快过滤速度,缩短锰砂柱长度,我们设计了不同长度(25 cm、30 cm、35 cm、40 cm)的锰砂柱进行锰砂过滤实验,来进一步讨论不同锰砂柱长度对锰砂吸附效果的影响。原井水样中Mn浓度为5.65 mg/L,过滤1 L水样所需的时间分别为330 s、480 s、570 s和720 s,并取滤液样测量Mn浓度,实验结果如图8所示。

图8 锰砂柱长度对吸附效果的影响Fig.8 The influence of manganese sand column length on the adsorption capacity
随着锰砂柱长度增加,过滤1 L水样所需的时间随之增加,从图8可以看出滤液中的Mn浓度随之不断减少。这是由于锰砂过滤除锰是一个接触氧化反应,锰砂柱越长,过滤所需时间越长,导致水样通过锰砂柱时的接触反应时间越长,因此在一定时间内,锰砂柱长度与吸附效果呈正相关关系。
(2)pH对锰砂吸附效果的影响。pH值是水质的重要指标之一,因此我们考虑了pH对锰砂吸附效果的影响,在上述实验的基础上,设计不同长度(25 cm、30 cm、35 cm、40 cm)锰砂柱,在原井水样中加入浓度为0.45 mol/L的NaOH调节pH至9.2,再经锰砂过滤,原井水样中Mn浓度为6.33 mg/L。记录每小时滤液的体积,其中25 cm锰砂柱每小时滤液体积为2.53 L、1.96 L,30 cm锰砂柱每小时滤液体积为2.17 L、1.15 L,35 cm锰砂柱每小时滤液体积为1.84 L、1.27 L,40 cm锰砂柱每小时滤液体积为0.93 L、0.61 L,然后取滤液样测量Mn浓度,结果如图9所示。

图9 pH对于锰砂吸附效果的影响Fig.9 The influence of pH on the adsorption of manganese sand
从图9可以看出,当井水样的pH值为9.2时,经设置的4种长度锰砂柱过滤,滤液中Mn浓度均以低于1 mg/L,因此pH对锰砂吸附效果影响很大,呈现出在一定范围内,pH越高,锰砂吸附效果越好的趋势。
通过对比图8和图9,我们发现可以通过调高进水的pH来达到以较短锰砂柱长度将滤液Mn浓度降低到国家《污水综合治理排放标准》(GB 8978—1996),极大的减少了反应时间,提高了反应效率。
2.2.3 过滤周期与反冲洗实验
从上面的实验中可以看出,在井水中加NaOH调节pH为9.2时,经长度为25 cm的锰砂柱过滤,滤液中Mn能降到2 mg/L以下,且流速较快,所以选取长度为25 cm的锰砂柱,加入锰砂53 g作为下一步的研究条件。从上一实验可以看出对于任一长度的锰砂柱,经过1 h后,其滤液体积均明显减少。这是由于调节pH后锰砂柱容易堵塞,因此每5 h对锰砂柱进行反冲洗。详细记录每小时滤液的体积,并取样分析滤液中的Mn浓度。当滤液中Mn浓度与进水中相近时,停止过滤,实验结果如图10所示。

图10 过滤周期与反冲洗实验Fig.10 Filtration cycle and backwash experiment
从图10可以看出,当加入NaOH调节pH值后,锰砂的吸附效果明显变好,达到饱和吸附的时间也明显变长,这说明pH的增加,提高了接触氧化反应的速率,以致只需较短的接触时间就能使滤液中Mn浓度降低至2 mg/L下。同时,平均每5 h需进行反冲洗,否则过滤速度下降很快。图10中第3小时、27小时、32小时、62小时及66小时时均进行了反冲洗,可以看到其流量迅速增加,说明了调节pH后,对锰砂进行反冲洗的必要性。此外,我们根据锰砂总吸附Mn量和锰砂质量得到每克锰砂吸附Mn量为26.7 mg相比不调节pH时的吸附量增加了24.75 mg。这是由于我们进行了反冲洗过程,该过程可以有效冲洗由接触氧化反应在锰砂表面生成的Mn2O3膜,使锰砂表面剩余的MnO2能再次与井水中的Mn2+发生接触氧化,极大的提高了锰砂的饱和吸附量。
2.2.4 锰砂再生实验
为进一步考虑锰砂的可循环利用性,我们将已经达到饱和吸附的锰砂用高锰酸钾溶液浸泡1 h,使其再次活化,用清水洗净锰砂,继续过滤实验。再生锰砂重63 g,装载长度30 cm,在井水中加NaOH调节pH至9.1~9.2,详细记录每2 h滤液的体积,并取样分析其中的Mn浓度,实验结果如图11所示。

图11 锰砂再生后的吸附效果Fig.11 Adsorption experiment of manganese sand after its regeneration
从图11可以看出,经高锰酸钾活化的锰砂还能继续吸附38 h才重新达到饱和,这是由于Mn2O3在强氧化剂KMnO4作用下被氧化为MnO2,从而恢复锰砂的除锰能力。反应方程如下[18]:

再生锰砂达到饱和后继续进行锰砂再生实验,测试锰砂的循环利用效果,结果如图12所示。

图12 锰砂的循环利用效果Fig.12 The effect of manganese sand recycling
通过图12,我们发现前26 h再生1次、再生2次及再生3次锰砂柱对Mn的吸附量为372.77 mg比原锰砂多出22.58 mg,一方面是由于再生锰砂过滤中原井水样的Mn浓度更高所导致;另一方面是再生锰砂柱的长度更长,增加接触氧化反应时间。但是,这均能说明活化后锰砂除锰能力得到了较大程度的有效恢复。经历过4次再生循环后,锰砂柱在第28小时达到饱和吸附,此时,其累计吸附Mn量相对于原始锰砂柱只减少了66.83 mg,可以说明锰砂柱的循环性能较好。
3 结论
(1)在一定时间及一定pH范围内,空气氧化除锰的效果与反应时间和pH呈正相关,且增加pH可以有效减少反应时间。将井水PH调节为9时,30 min即可将井水中Mn降到2 mg/L以下,60 min已经低于1 mg/L。但井水Mn浓度增加,其反应时间也会延长,pH会随之下降,因此调节pH值是空气氧化除锰的关键。
(2)锰砂能很好的将井水中Mn降至2 mg/L以下,达到废水综合治理排放标准。其吸附效果主要与接触氧化时间和pH值相关,通过提高井水样的pH值可以缩短接触氧化时间,极大的提高接触氧化反应效率。
(3)调节pH值会造成锰砂柱易堵塞,因此需按每5 h一次进行反冲洗,此过程可极大提高锰砂的饱和吸附量。此外,虽然锰砂的吸附量有限,但使用高锰酸钾可将饱和的锰砂再次活化,其除锰能力可得到有效恢复。

