共载HBx-siRNA与五味子油阳离子脂质体纳米粒的制备及其对乙型肝炎体外药效学研究
王 锐,李娅兰,李建月,杨 婧
1.黑龙江中医药大学,黑龙江 哈尔滨 150040
2.黑龙江中医药大学基础医学院,黑龙江 哈尔滨 150040
乙型病毒性肝炎是由乙肝病毒诱发的以肝脏病变为主的传染性疾病。由世界卫生组织统计报道全球慢性乙肝病毒患者约有2.57 亿,且88.7 万人因感染乙肝病毒而死亡,中国乙肝病毒患者约9300 万例,其中慢性乙型肝炎病患约2000 万例[1-2]。小干扰RNA(siRNA)技术广泛应用于乙肝病毒的治疗。但裸siRNA 生物半衰期短,容易被胞浆、血液和组织中的酶类降解,生物利用度低。细胞膜表面带有负电荷,且siRNA 是带有负电荷的亲水性物质,因此,siRNA 进入细胞需要载体介导。北五味子具备护肝的功能,目前对于木脂素的研究较为广泛,对于北五味子油的研究较少,牛莉萍[3]研究发现北五味子油可通过增加HepG2 细胞内活性氧簇(reactive oxygen species,ROS)含量而达到使HepG2 细胞凋亡的功能。脂质体作为一种非病毒载体具有无传染性、无载体容量制约、化学结构可操控,无致瘤危险和抗原性[4-7]。siRNA 为水溶性物质,利用阳离子脂质体可同时装载水溶性物质和脂溶性物质的特点,选取具有保肝作用的北五味子提取物五味子油[8-9],将两者同时装载于阳离子脂质体内,探究五味子油是否可协同乙型肝炎型小干扰RNA(HBx-siRNA),以达到更好的抑制乙肝病毒的功效。
1 仪器与材料
1.1 仪器与设备
OSB-2200旋转蒸发仪,日本EYELA 株式会社;超声细胞破碎仪,美国SONICS公司;SYNERGY H1酶联免疫检测仪,美国伯腾仪器有限公司;JEM-2100 透射电子显微镜(TEM),日本电子株式会社;U-CTR30-2 荧光倒置显微镜,德国徕卡公司;粒径电位仪,北京普析通用仪器有限责任公司;CFX ConnectTM荧光定量PCRA 仪,美国BIO-RAD 公司;DW-86L386 −80 ℃低温冰箱,美国Thermo 公司;生物分光光度计、离心机,Eppendorf 公司;涡旋振荡仪,海门市其林贝尔仪器制造有限公司。
1.2 药品与试剂
五味子油,江西森海植物油有限公司,批号20181022,检测报告:橙黄色透明油状液体,气清香,相对密度0.972 0~0.992 0,折光率1.492 0~1.568 0,酸值≤20 mg KOH/g,砷盐≤0.2 μg/kg,重金属≤0.001 mg/kg,亚油酸≥10%,五味子甲素≥2.0%。(2,3-二油氧基-丙基)三甲基氯乙铵(N-[1-(2,3- dioleyloxy)propyl]-N,N,N-trimethylammonium chloride,DOTAP),上海斯信生物有限公司,批号RD-01173;氯仿、异丙醇、无水乙醇,天津市永大化学试剂有限公司;胆固醇,国药集团化学试剂有限公司,批号20130618;透明质酸(批号H02N8J47121)、鱼精蛋白(批号Z31O8H47046)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇 2000(DSPE-PEG2000,批号P31M8S32960),上海源叶生物科技有限公司;siRNA(序列见表1)、荧光标记的siRNA(FAM- siRNA),苏州吉玛基因股份有限公司;经焦碳酸二乙酯处理过的高温消毒的水(DEPC),北京博奥拓达科技有限公司,批号PM11649;二甲基亚砜,上海索莱宝生物科技有限公司,批号D8418;MEM培养基,HyClone 公司,批号AE27142269;胰酶细胞消化液,碧云天生物技术有限公司,批号C0201;无菌PBS,北京博奥拓达科技有限公司,批号180523;胎牛血清,赛澳美细胞技术有限公司,批号20180522;双抗,美国Gibco 公司,批号J150038;MTT,赛国生物科技有限公司,批号EZ3455C328。

表1 siRNA 序列Table 1 siRNA sequence
1.3 细胞株与培养基
1.3.1 细胞株 HepG2.2.15 表达HBV 病毒的人肝细胞,购于上海中乔新舟生物科技有限公司。
1.3.2 培养基 α-MEM+10% FBS+1%双抗+1%丙酮酸钠,在37 ℃,5% CO2条件下进行培养。
2 方法与结果
2.1 共载HBx-siRNA 和五味子油阳离子脂质体纳米粒的制备
称量DOTAP 和胆固醇放置到圆底烧瓶内,量取适量的CHCl3溶解。置于旋转蒸发仪上除去CHCl3,待烧瓶内壁形成一层脂质体薄膜即可。加入适量的0.1% DEPC 水溶液洗下薄膜。超声处理30 min,加入五味子油,细胞破碎仪下超声60 s,再缓慢多次通过0.45 μm 滤膜,即得五味子油阳离子脂质体[10]。
量取处方量0.1% DEPC 水溶液,充分震摇使HBx-siRNA 溶解均匀。将siRAN 溶液与等体积的透明质酸混合,震荡均匀,加入适量的鱼精蛋白,充分混合配制好的载五味子油的阳离子脂质体,加入适量的DSPE-PEG2000,即制成共载HBx-siRNA与五味子油阳离子脂质体纳米粒。
2.2 单因素实验优化脂质体纳米粒制备工艺
2.2.1 膜材比对包封率的影响 膜材比为阳离子脂质体的成膜成分DOTAP 与胆固醇的质量比,选择药脂比1∶5、超声时间50 min、旋蒸温度30 ℃,使得膜材比为5∶1、4∶1、3∶1、2∶1、1∶1,按照“2.1”项下方法制备五味子油阳离子脂质体,考察包封率的变化,结果包封率分别为(64.45±0.28)%、(73.42±0.65)%、(79.54±0.44)%、(75.40±0.34)%、(70.38±0.46)%(n=3)。膜材比为4∶1、3∶1、2∶1 时脂质体的包封率较高,故选取4∶1、3∶1、2∶1 为膜材比的3 个水平,进行后续考察。
2.2.2 药脂比对包封率的影响 选择膜材比3∶1、超声时间50 min、旋蒸温度30 ℃,制备五味子油与脂质体的质量比为1∶3、1∶4、1∶5、1∶6、1∶7 时,按照“2.1”项下方法制备五味子油阳离子脂质体,考察脂质体包封率的变化,结果包封率分别为(69.54±0.32)%、(75.32±0.45)%、(89.56± 0.44)%、(91.12±0.43)%、(93.32±0.28)% (n=3)。脂质体与五味子油的质量比越大,五味子油阳离子脂质体的包封率越大;反之,质量比越小,包封率越小。综合考虑载药量以及包封率,选择1∶4、1∶5、1∶6 为药脂比的3 个水平。
2.2.3 超声时间对包封率的影响 选择膜材比3∶1、药脂比1∶5、旋蒸温度30 ℃,改变超声时间分别为40、50、60、70、80 min,按照“2.1”项下方法制备五味子油阳离子脂质体,结果包封率分别为(75.82±0.48)%、(80.93±0.25)%、(86.44±0.44)%、(83.72±0.56)%、(81.22±0.37)%(n=3)。超声时间为50、60、70 min 时脂质体的包封率较高,故选择50、60、70 min 为超声时间3 水平。
2.2.4 旋蒸温度对包封率的影响 固定膜材比3∶1、药脂比1∶5、超声时间50 min,改变旋蒸温度分别为20、30、40、50、60 ℃,按照“2.1”项下方法制备五味子油阳离子脂质体,结果包封率分别为(81.32±0.47)%、(83.66±0.48)%、(83.12±0.72)%、(82.52±0.32)%、(80.47±0.43)% (n=3)。旋蒸温度为20、30、40 ℃时包封率较高,在30 ℃时包封率最高,因此,选取30 ℃为最优温度(相比于其他单因素条件,旋蒸温度影响包封率的范围很小,故不必进一步优化)。
2.3 星点设计-效应面法优化五味子油阳离子脂质体处方工艺
2.3.1 实验设计与结果 根据单因素实验分析得出,改变旋蒸温度,得到的相邻包封率差值较小,故旋蒸温度对五味子油阳离子脂质体的包封率影响不大,因此,以单因素考察实验为依据,设定膜材比(X1)、药脂比(X2)、超声时间(X3)为考察因素,以五味子油包封率(Y)为评价指标,每个因素设置5 水平。分别用代码−α、−1、0、+1、+α 表示,对于3 因素的星点设计,α=1.682。实验因素与水平安排及结果见表2。
2.3.2 模型拟合 通过Design Expert 8.0 软件分别对各因素的各水平进行二次多项式方程拟合。并根据方程通过Design Expert 8.0 软件绘出三维效应面和二维等高线,选取较优组合。二次多项式方程拟合结果为Y=−597.656 36+51.565 46X1+59.731 83X2+12.217 04X3-3.058 24X1X2+0.440 88X1X3+0.787 36X2X3-11.404 24X12-10.239 24X22- 0.121 49X32,P<0.05,R2=0.876 5,回归方程关系显著,符合要求。方差结果分析见表3。
结果分析,Y模型项P<0.05,证明所得回归方程效果显著。在Y模型方程中,X3、X2X3、X12、X22、X32都是显著项,是Y的显著影响因素。使用Statistica 6.0 软件处理后得到二维等高线及三维效应面图,确定最优方案为膜材比为3∶1,药脂比为1∶5,超声时间为70 min。结果见图1。
2.3.3 最佳工艺 采用薄膜分散法,称取DOTAP和胆固醇的质量比为3∶1,圆底烧瓶中加入适量的三氯甲烷,30 ℃旋蒸成薄膜,真空干燥2 h 后超声处理30 min,称取五味子油与脂质体的比为1∶5,超声70 min,取冻存的HBx-siRAN,4000 r/min 离心1 min,加入0.1% DEPC 溶解。取含有25 μg H B x-s i R A N 的溶液加入等质量的透明质酸(hyaluronic acid,HA)溶液混合形成HA-siRNA。
以HA-siRNA 与PRTM 的质量比为1∶1 进行均匀混合,得到HA-siRNA-PRTM 复合物。在该复合物中加入50 μL 的载五味子油脂质体,10 min 后加入50 μL DSPE-PEG2000,在50 ℃水浴锅中静置10 min。共载HBx-siRAN 与五味子油阳离子脂质体纳米粒制备完成。
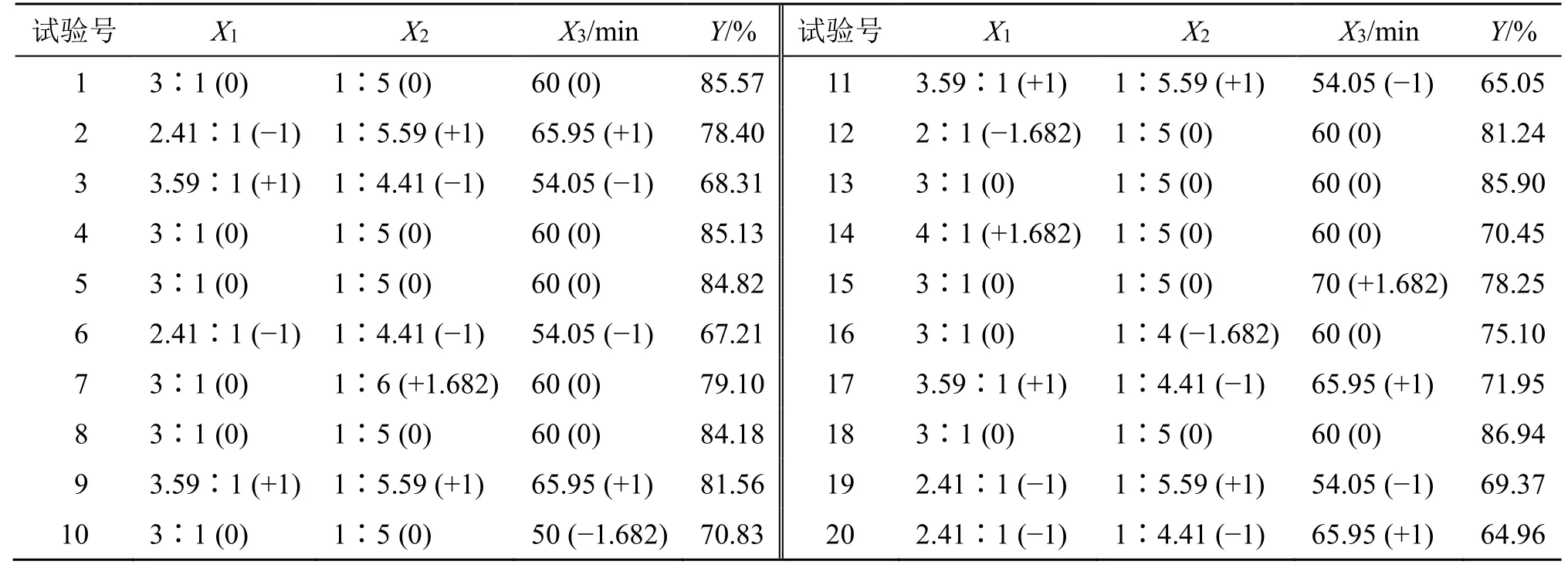
表2 星点设计-效应面法实验因素水平安排及结果Table 2 Horizontal arrangement and result of experimental factors in star point design-response surface method
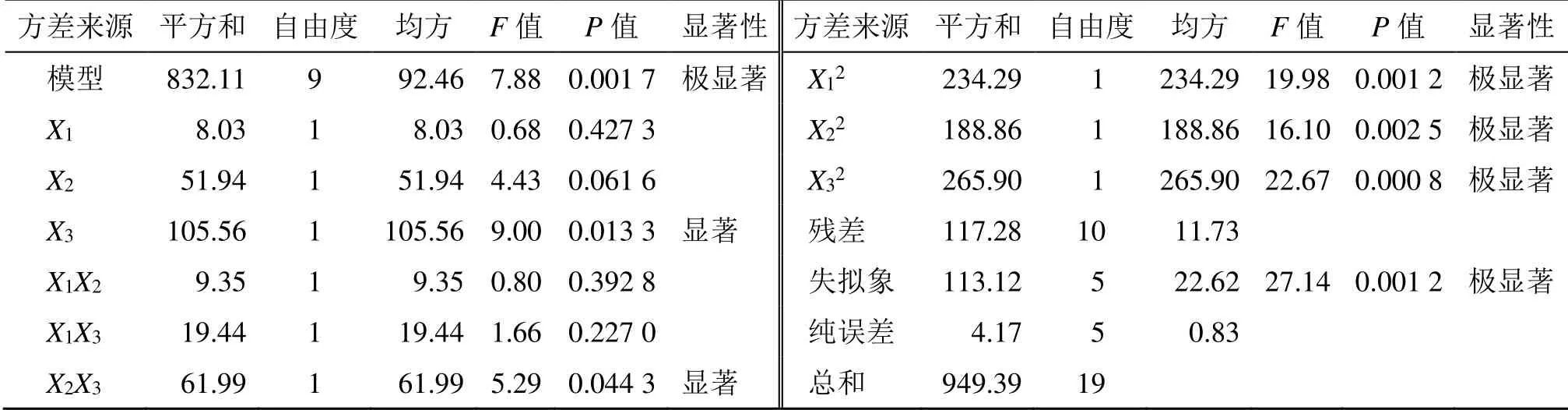
表3 方差分析结果Table 3 Results of variance analysis

图1 膜材比 (X1)、药脂比 (X2)、超声时间 (X3) 对包封率的三维效应面和二维等高线图Fig.1 Three-dimensional effect surface and two-dimensional contour map of membrane material ratio (X1), drug-lipid ratio (X2) and ultrasonic time (X3) on entrapment efficiency
2.3.4 最佳工艺验证 按照星点设计-效应面法筛选出最佳的载五味子油脂质体的制备工艺,按照最佳工艺制备测定包封率,并把实测值与预测值对比,计算两数值之间的误差,如表4,载五味子油阳离子脂质体包封率的预测值与实测值的相对偏差小于5%,证明该工艺准确可靠,重复性良好,星点设计实验所建立的数学模型预测性良好。课题组前期研究表明,HA-siRNA 与鱼精蛋白最佳质量比为1.0∶1.0 时,复合物为带有负电荷的较小微粒。复合物HBx-siRNA 的载药量为25 μg 时,加入包和五味子油阳离子脂质体为50 μL 时,制备工艺最佳。

表4 实测值与预测值比较Table 4 Comparison of measured and predicted values
2.4 脂质体纳米粒的表征
2.4.1 电位、粒径及形态的测定 按照“2.3.3”最佳工艺制备共载HBx-siRNA 与五味子油阳离子脂质体纳米粒样品,分别取适量样品加到比色皿和样品池内,用电位粒径仪检测粒径和Zeta 电位[11-12]。测得共载HBx-siRNA 与五味子油阳离子脂质体纳米粒的粒径为(134.000±0.035)nm,多分散指数(PDI)为0.320±0.022,Zeta 电位为(44.000± 0.027)mV。
2.4.2 透射电镜观察脂质体外观 按照“2.3.3”项下最佳工艺制备共载HBx-siRNA 与五味子油阳离子脂质体纳米粒样品,取5 μL 滴加在铜网上,室温静置至干燥,将铜网置于TEM 下观察脂质体的形态。并用TEM 观察观察脂质体形态,结果见图2,共载HBx-siRNA 与五味子油阳离子脂质体纳米粒呈不规则的类圆形。

图2 脂质体TEM 图Fig.2 TEM of liposome
2.5 脂质体纳米粒包封率的测定
2.5.1 标准曲线的建立 将荧光标记的HBx-siRNA (FAM-HBx-siRAN)溶解在适量的0.1% DEPC 水中制备成FAM-siRNA 储备溶液。取0.1% DEPC 水将储备液分别稀释成0.05、0.10、0.15、0.20、0.25、0.30 μg/μL 质量浓度梯度的标准溶液。492 nm 波长下,通过酶标仪测定每组吸光度(A)值。得到方程Y=1 005.4X+119.21,R2=0.997 4。由方程可知,A值与FAM-HBx-siRNA 质量浓度在0.05~0.30 μg/μL 具有良好的线性关系。
2.5.2 包封率和载药量的测定 按照最佳工艺制备共载FAM-HBx-siRNA 与五味子油阳离子脂质体纳米粒。取适量的溶液进行离心(4000 r/min),取上清液,在492 nm 条件下,采用多功能酶标仪测定A值,根据标准曲线计算出游离FAM-HBx-siRNA质量浓度(C),计算包封率和载药量。

检测结果见表5,共载FAM-HBx-siRNA 与五味子油脂质体纳米粒的包封率为(81.37±0.08)%,载药量为(16.25±0.06)%,证明HBx-siRNA 和五味子油在脂质体中具有较好的包封率和载药量。

表5 载HBx siRNA 与五味子油阳离子脂质体纳米粒包封率和载药量Table 5 Encapsulation rate and drug loading of cationic liposome nanoparticles loaded with HBx siRNA and SCF oil
2.6 共载脂质体纳米粒对乙型肝炎病毒体外药效学研究
2.6.1 MTT 检测细胞增殖抑制实验 将HepG 2.2.15 细胞接种于96 孔板内,并使每孔含有细胞悬液100 μL。将96 孔板放入细胞培养箱内放置24 h,至HepG2.2.15 细胞单层平铺孔底,弃去原培养基。加入制备好的浓度为20、40、60、80、100 nmol/L的共载HBx-siRNA 与五味子油的阳离子脂质体纳米粒,选取0 nmol/L 浓度作为对照组,每组设3 个复孔。放入条件为37 ℃、5% CO2培养箱内,放置24、48 h。
同上分别加入载五味子油、载HBx-siRNA、共载HBx-siRNA 与五味子油的阳离子脂质体纳米粒α-MEM 基本培养基100 μL。以100 μL 空白阳离子脂质体α-MEM 基本培养基作为对照组,每一组设置3 个复孔。放入条件为37 ℃、5% CO2培养箱内,放置24、48 h。使用酶标仪,检测各孔A值,并记下各组数据。
如表6 所示,在给药24 h 后,20、40、60、80、100 nmol/L 浓度的共载HBx-siRNA 与五味子油脂质体纳米粒对 HepG2.2.15 细胞抑制率分别是7.97%、20.10%、37.98%、45.73%、54.63%。在给药48 h 后,20、40、60、80、100 nmol/L 浓度的共载 HBx-siRNA 与五味子油脂质体纳米粒对HepG2.2.15 细胞抑制率分别是17.84%、33.33%、56.47%、68.87%、74.38%。说明共载HBx-siRNA与五味子油脂质体纳米粒对HepG2.2.15 细胞增殖的抑制具有剂量相关性。通过细胞增殖抑制率计算公式(抑制率=1-A加药/A对照),计算得共载HBx- siRNA 与五味子油脂质体纳米粒在24、48 h 抑制HepG2.2.15 细胞增殖50%时的药物浓度(IC50)分别为53.5、107.4 nmol/L。因此,在后续各实验时共载脂质体纳米粒的浓度选定为100 nmol/L。
表6 不同浓度阳离子脂质体纳米粒对HepG2.2.15 细胞增殖的抑制作用 ( ± s, n = 3)Table 6 Inhibition of HepG2.2.15 cell proliferation by cationic liposome nanoparticles with different concentrations ( ± s,n = 3)
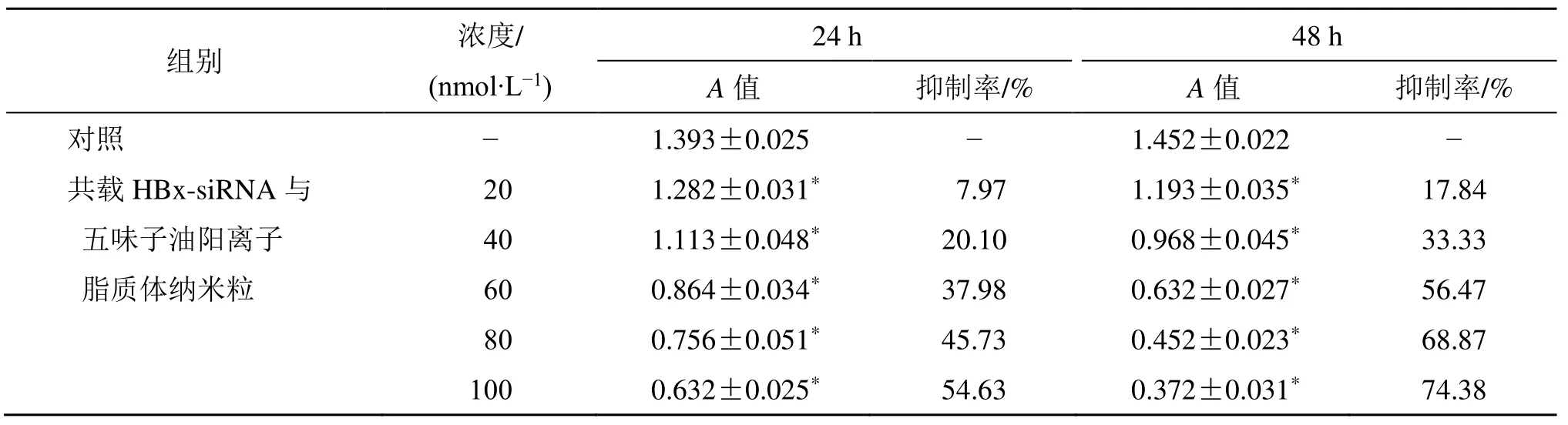
表6 不同浓度阳离子脂质体纳米粒对HepG2.2.15 细胞增殖的抑制作用 ( ± s, n = 3)Table 6 Inhibition of HepG2.2.15 cell proliferation by cationic liposome nanoparticles with different concentrations ( ± s,n = 3)
与对照组比较:*P<0.05,表7~9 同*P < 0.05 vs negative control group, same as table 7—9
浓度/ 24 h 48 h 组别 (nmol·L−1) A 值 抑制率/% A 值 抑制率/% 对照 − 1.393±0.025 − 1.452±0.022 − 共载HBx-siRNA 与 20 1.282±0.031* 7.97 1.193±0.035* 17.84 五味子油阳离子 40 1.113±0.048* 20.10 0.968±0.045* 33.33 脂质体纳米粒 60 0.864±0.034* 37.98 0.632±0.027* 56.47 80 0.756±0.051* 45.73 0.452±0.023* 68.87 100 0.632±0.025* 54.63 0.372±0.031* 74.38
如表7 所示,在给药后24 h 时,载五味子油阳离子脂质体组的抑制率为20.22%,载HBx-siRNA组的抑制率为42.82%,共载HBx-siRNA 与五味子油阳离子脂质体组的抑制率为52.78%。在给药后48 h 时,各组的抑制率明显增加,载五味子油阳离子脂质体组的抑制率为25.10%,载HBx-siRNA 组的抑制率为59.26%,共载HBx-siRNA 与五味子油阳离子脂质体组的抑制率为73.59%。与阴性对照组
表7 阳离子脂质体纳米粒对HepG2.2.15 细胞增殖的抑制作用 ( ± s, n = 3)Table 7 Inhibition of cationic liposome nanoparticles on the proliferation of HepG2.2.15 cells ( ± s, n = 3)

表7 阳离子脂质体纳米粒对HepG2.2.15 细胞增殖的抑制作用 ( ± s, n = 3)Table 7 Inhibition of cationic liposome nanoparticles on the proliferation of HepG2.2.15 cells ( ± s, n = 3)
组别 24 h 48 h A 值 抑制率/% A 值 抑制率/% 对照 1.385±0.022 − 1.458±0.032 − 载五味子油阳离子脂质体 1.105±0.037* 20.22 1.092±0.043* 25.10 载HBx-siRNA 0.794±0.026* 42.82 0.594±0.027* 59.26 共载HBx-siRNA 与五味子油阳离子脂质体 0.654±0.018* 52.78 0.385±0.028* 73.59
(空白阳离子脂质体组)进行对比,各组都具有统计学意义(P<0.05)。由实验数据可知,在相同的给药时间内,共载HBx-siRNA 与五味子油阳离子脂质体组的抑制率大于载HBx-siRNA 组大于载五味子油阳离子脂质体组大于阴性对照组。共载HBx- siRNA 与五味子油阳离子脂质体纳米粒对HepG 2.2.15 细胞的增殖具有较好的抑制作用。
2.6.2 划痕实验检测细胞迁移能力 给药组分别加入载五味子油阳离子脂质体、载HBx-siRNA、共载HBx-siRNA 与五味子油阳离子脂质体纳米粒含1% FBS 的α-MEM 培养基2 mL。用含有1% FBS 的α-MEM 培养基作为对照。放置到37 ℃、5% CO2培养箱内12、24 h 后观察细胞划痕,测量划痕宽度,计算划痕愈合率。

结果如图3 和表8 所示,在12 h 时,阴性对照组、载五味子油阳离子脂质体组、载HBx-siRNA 阳离子脂质体组、共载HBx-siRNA 与五味子油阳离子脂质体组的划痕愈合率分别为(48.5±1.5)%、(17.0±1.8)%、(9.2±2.1)%、(3.6±1.8)%,在24 h 后,阴性对照组的划痕基本愈合,而其他3 组虽有愈合,但是愈合速度明显减慢,由以上数据可知,共载HBx- siRNA 与五味子油阳离子脂质体组对HepG2.2.15 细胞迁移能力的抑制作用大于载HBx-siRNA 组大于载五味子油阳离子脂质体组大于阴性对照组。共载HBx-siRNA 与五味子油组阳离子脂质体纳米粒具有较好的抑制HepG2.2.15 细胞迁移的能力。

图3 细胞划痕实验Fig.3 Cell scratch experiment
表8 阳离子脂质体纳米粒对HepG2.2.15 细胞迁移能力抑制作用 ( ± s, n = 3)Table 8 Inhibition of cationic liposome nanoparticle on migration of HepG2.2.15 cells ( ± s, n = 3)

表8 阳离子脂质体纳米粒对HepG2.2.15 细胞迁移能力抑制作用 ( ± s, n = 3)Table 8 Inhibition of cationic liposome nanoparticle on migration of HepG2.2.15 cells ( ± s, n = 3)
组别 划痕愈合率/% 12 h 24 h 对照 48.5±1.5 73.2±2.2 载五味子油阳离子脂质体 17.0±1.8* 26.9±1.9* 载HBx-siRNA 阳离子脂质体 9.2±2.1* 19.5±2.1* 共载HBx-siRNA 与五味子 油阳离子脂质体 3.6±1.8* 15.2±1.8*
2.6.3 细胞摄取实验 将HepG2.2.15 细胞接种到6孔细胞培养板上,将加入α-MEM 完全培养液作为对照组,给药组加入载FAM-HBx-siRNA 的阳离子脂质体纳米粒的α-MEM 完全培养基。12、24 h 后弃去培养液,加入2 mL 无菌PBS 重复洗涤2 次。荧光倒置显微镜下观察细胞的摄取效果。
结果如图4 所示,将载FAM-HBx-siRNA 阳离子脂质体纳米粒处理过的HepG2.2.15 细胞,经给药12、24 h 后,将细胞贴壁面向上,放置在荧光倒置显微镜下观察摄取效果,发现绿色荧光即为摄取了FAM-HBx-siRNA 的细胞。将载FAM-HBx-siRNA组与阴性对照组经处理后,放置显微镜下观察,载FAM-HBx-siRNA 组在给药12 h 后,出现部分绿色荧光,而对照组无此现象。在给药24 h 后,载FAM-HBx-siRNA 组绿色荧光数量进一步增加,而阴性对照组仍无此现象。观察结果显示,HepG2.2.15细胞对载FAM-HBx-siRNA 阳离子脂质体纳米粒的摄取效果显著。

图4 HepG2.2.15 细胞摄取FAM-siRNA 阳离子脂质体纳米粒效果Fig.4 Uptake effect of FAM-siRNA cationic liposome nanoparticles by HepG2.2.15 cells
2.6.4 ELISA 法检测HepG2.2.15 细胞上清液中乙肝表面抗原(HBsAg)和乙肝核心抗原(HBeAg)的水平 将HepG2.2.15细胞接种到6孔细胞培养板 上,分别加入载五味子油、载HBx-siRNA、共载HBx-siRNA 与五味子油阳离子脂质体纳米粒α-MEM 培养基2 mL。以加入2 mL α-MEM 基本培养基作为对照组,每组设3 个复孔;放置到培养条件为37 ℃、5% CO2培养箱内,放置48 h;48 h 后收取各组细胞上清液至灭菌后的离心管中,2500 r/min 离心20 min,收集上清。实验过程参照酶联生物公司HBeAg 及HBsAg 试剂盒说明书。
结果如表9 所示,在给药48 h 后,载五味子油阳离子脂质体组、载HBx-siRNA 组、共载HBx-siRNA 与五味子油阳离子脂质体组分别与阴性对照组相比细胞上清液中的HBsAg 和HBeAg 的水平均有下降,并且对于抑制HepG2.2.15 细胞分泌HBsAg和HBeAg 的水平共载HBx-siRNA 与五味子油阳离子脂质体组大于载HBx-siRNA 组大于载五味子油阳离子脂质体组大于阴性对照组,与阴性对照组对比,各组都具有统计学意义(P<0.05)。由数据可知,共载HBx-siRNA 与五味子油阳离子脂质体纳米粒具有较好的抑制HepG2.2.15 细胞分泌HBsAg和HBeAg 的作用。
表9 阳离子脂质体对 HBsAg 和 HBeAg 水平的影响 ( ± s, n = 3)Table 9 Effects of cationic liposomes on HBsAg and HBeAg levels ( ± s, n = 3)
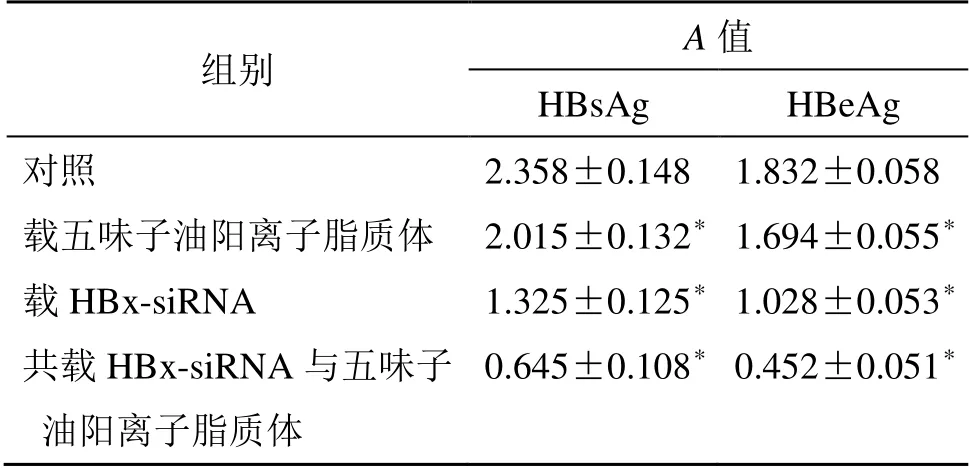
表9 阳离子脂质体对 HBsAg 和 HBeAg 水平的影响 ( ± s, n = 3)Table 9 Effects of cationic liposomes on HBsAg and HBeAg levels ( ± s, n = 3)
组别 A 值 HBsAg HBeAg 对照 2.358±0.148 1.832±0.058 载五味子油阳离子脂质体 2.015±0.132* 1.694±0.055* 载HBx-siRNA 1.325±0.125* 1.028±0.053* 共载HBx-siRNA 与五味子 油阳离子脂质体 0.645±0.108* 0.452±0.051*
3 讨论
慢性乙型肝炎是危害全球人民健康的严峻问题,每年有好几十万人都因为感染HBV 导致肝功能衰竭、肝硬化和肝癌而死亡[13-14]。阳离子脂质体目前在医药界基因疗法研发中较为常用,与细胞膜在电荷效应下具有较强的亲和力,利于其进到细胞内进行药物运输[15-16]。薄膜分散法是常用的制备脂质体的工艺,此方法不仅制备工艺简单,还可以得到较高的包封率[17]。但是薄膜分散法所得到的脂质体粒径较大且不稳定,本实验通过适当增加超声时间使脂质体粒径变小且均匀稳定,通过单因素考察和星点设计-效应面法,优化五味子油阳离子脂质体的制备工艺条件,由数据可知,经过工艺优化制出的共载HBx-siRNA 与五味子油阳离子脂质体纳米粒具有较好的包封率、粒径和Zeta 电位,并且形状良好。
MTT 作用机制是可使活细胞线粒体内的琥珀酸脱氢酶还原成不溶于水的蓝色结晶-甲臜,死细胞不能发生此反应,而DMSO 可以溶解甲臜,经酶标仪测定的A值可以体现出活细胞的多少[18-19]。本实验表明,共载HBx-siRNA 与五味子油组抑制HepG 2.2.15 细胞增殖的效果最强,具有较好的抑制 HepG2.2.15 细胞增殖的作用。
通过细胞划痕实验可以考察出药物对细胞迁移能力的影响[20]。本研究发现共载HBx-siRNA 与五味子油组具有较好的抑制 HepG2.2.15 细胞迁移能力。HepG2.2.15 细胞对共载HBx-siRNA 与五味子油阳离子脂质体的摄取是产生其抑制乙型肝炎效果的重要指标,实验表明,HepG2.2.15 细胞对载FAM-HBx-siRNA 的阳离子脂质体纳米粒的摄取效果显著。
HBeAg 与HBsAg 的含量是检测是否感染乙型肝炎的重要指标,目前惯用的测定HBeAg和HBsAg的方法是ELISA 实验。常用双抗原夹心法可简单、方便、敏感度较高的快速检测到HepG2.2.15 细胞上清液中分泌的HBeAg 和HBsAg[21-22]。本研究发现,共载HBx-siRNA 与五味子油阳离子脂质体纳米粒有较好的抑制HepG 2.2.15 细胞分泌HBeAg 和HBsAg 的作用。综上所述,五味子油协同HBx- siRNA 具有较好的抑制乙型肝炎的效果。
利益冲突所有作者均声明不存在利益冲突

