烟碱抑制单胺氧化酶B活性及其对抗帕金森病作用研究
徐家佳,李菁菁,李延岩,李文政,管明婧,金宇,李林,张承武*,王孝峰,张晓宇,周顺,曹芸*
1 安徽中烟工业责任有限公司,安徽省合肥市高新区天达路9号 230088;
2 南京工业大学,先进材料研究院,江苏省南京市浦口区浦珠南路30号 211816
帕金森病(Parkinson’s disease, PD)是一种多发于中老年人、以运动障碍为主要表现的神经退行性疾病,最主要病理特征是中脑黑质致密部多巴胺(Dopamine,DA)能神经元变性、死亡[1-4]。PD作为第二高发的神经系统退行性疾病,在世界范围内,65岁以上人群中有1%~2%的人受到PD的影响[5];随着人口老龄化的快速发展,我国PD患者的数量也将相应地大大增加,据估计到2050年我国的PD患者将达到1000万[6]。PD病程长、致残率高,但目前尚缺乏有效的治疗手段,PD不仅严重影响患者及其家庭的生活质量,且已经成为影响我国人口健康水平、阻碍经济持续发展的社会问题。
大规模的流行病学调查结果表明,吸烟与PD的发病率呈负相关,吸烟人群PD的发病率显著低于非吸烟人群[7-10],提示烟草具有对抗PD的作用,但其中的机制并不清楚。烟碱(又称尼古丁,Nicotine)是烟草的重要成分,在离体培养的细胞及实验动物的研究结果表明,烟碱是烟草中对多巴胺能神经元起保护作用的关键分子[11-13]。烟碱对抗PD的分子机制已有众多报道,目前主要的观点认为,烟碱是通过结合烟碱型乙酰胆碱受体发挥作用,主要的分子通路为烟碱结合到受体后,激活细胞内钙离子释放,后者又激活下游的众多信号分子,包括蛋白激酶A(PKA)、细胞分裂原活化蛋白激酶(ERK)、钙调蛋白(CaM)、磷脂酰肌醇-3-激酶(PI3K)等,从而减少神经元的凋亡,起到对多巴胺神经元的保护作用[14-17]。但这一观点也受到了一定质疑,例如,烟碱型乙酰胆碱受体主要表达于神经元,而烟碱对中枢神经系统胶质细胞同样具有调控作用[18];另外,如果按上述观点,钙离子是烟碱与烟碱型乙酰胆碱受体结合后发挥作用的重要信使分子,钙离子抑制剂理论上可完全阻断烟碱的保护作用,但这点并没有实验结果支持。因此,烟碱对于PD的对抗作用机制有待进一步阐明。
单胺氧化酶-B(Monoamine Oxidase B, MAO-B)是机体内降解多巴胺的关键酶,主要表达于线粒体外膜。大量研究结果表明,MAO-B在PD患者过表达,MAO-B不仅加剧多巴胺的缺乏,且在降解多巴胺的过程中发生自身氧化产生过氧化氢;也有研究表明其代谢会激活线粒体电子传递链的活性,是多巴胺能神经元死亡的诱导因素[19-20]。MAO-B抑制剂包括selegiline、rasagiline、safinamide等 是FDA批 准的治疗PD的临床一线药物[21-23],此外Pargyline作为MAO-B特异性不可逆抑制剂,可影响酪胺代谢引起血压降低,常作为降压药使用[24]。目前已有研究证实吸烟者脑内的MAO-B含量显著低于非吸烟者,这或许是烟碱产生的抑制作用[25]。进而通过分子结构比较分析,发现烟碱的分子结构和已有的数十种MAO-B的抑制剂具有相似性,均属于香豆素衍生物或(杂)芳酰胺类化合物[26],由此推测烟碱或可通过抑制MAO-B活性对抗PD。
本文利用小分子与蛋白互作结构模拟技术,分析烟碱和MAO-B的结合位点,并在MPTP诱导的细胞PD模型及parkin基因敲除的果蝇PD模型中[27]研究烟碱对抗PD的作用。本研究有助于明确吸烟对抗PD的分子机制,有利于PD治疗方案的拓展,同时为更好地综合利用我国丰富的烟草资源提供新思路。
1 材料与方法
1.1 试剂、材料与实验动物
烟碱(Nicotine),MPTP hydrochloride (1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine hydrochloride),重组单胺氧化酶B (MAO-B, Monoamine Oxidase B human ),DMSO 购于sigma公司;MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazol-3-ium bromide)购于源培生物;Amplex Red Monoamine Oxidative Assay Kit,Pargyline hydrochloride,PVDF膜购于Thermofisher;NAD+试剂盒,BCA蛋白浓度检测试剂盒,ATP检测试剂盒,PMSF,RIPA裂解液购于碧云天;多巴胺含量检测试剂盒购于金霖生物;电泳凝胶配制试剂盒购于雅酶;一抗包括 JNK,P-JNK,C-PARP,ERK,TOM20,MAO-B,二抗包括 HRP anti mouse,HRP anti Rabbit,均购自CST;DMEM,FBS胎牛血清购自BI;果蝇培养基,Parkin null果蝇由新加坡国立神经研究所赠予。
1.2 实验方法和条件
1.2.1 小分子-蛋白相互作用理论模型计算方法
利用Grid软件构建MAO-B蛋白具有FAD活性空腔的除水蛋白模型(使用来自于PDB官网(http://www1.rcsb.org/)的MAO-B蛋白结构,编码PDB code: 2BK3, 2VRL and 4A7A),利用AutoDock(1.5.6)软件将烟碱和Pargyline(Pargyline hydrochloride)结构导入作为配体。将蛋白模型和配体结构均处理为.pdbqt格式,在Grid软件中确定蛋白活性空腔的三维box,长宽高数值为42/52/46,中心位置为36.739/31.292/12.149,同时确保配体的所有单键均可旋转。在Pymol(2.3.2)软件中确定结合空间,进行cmd演算,计算出配体对蛋白的能量值,能量最低的为最稳定构象。在模型中使用的MAO-B蛋白模型活性空腔的氨基酸序列为 Tyr60, Gln65, Val82, Glu84,Leu88, Leu171, Cys172, Ile198, Ile199, Ser200, Thr201,Glu207, Thr314, Ile316, Tyr326, Leu328, Met341,Phe343, Tyr398 and Tyr435,烟碱与Pargyline的活性位点均为N。
1.2.2 体外纯蛋白抑制率检测
将烟碱均匀稀释于PBS溶液中分别配制成1µmol/L,10 µmol/L,100 µmol/L的 溶 液 待 用。配制Pargyline的10 µmol/L的PBS溶液待用。配 制MAO-B蛋 白50 µg/mL的PBS溶 液 待 用。根 据Amplex Red Monoamine Oxidase Assay Kit(Thermofisher Invitrogen)提供的检测试剂和检测方法,将MAO-B底物 benzylamine与马血清以及amplex red探针配制成工作液待用。在buffer溶液中分别加入烟碱/ Pargyline、MAO-B蛋白,使烟碱最终浓度为0.1 µmol/L、1 µmol/L、10 µmol/L,Pargyline的最终浓度为1 µmol/L,MAO-B的最终浓度为10µg/mL,将混合溶液置于37℃的摇床上振荡1 h后,等体积加入工作液,继续在37℃摇床振荡1 h。反应结束后将溶液转移至黑色384孔板中,每组设3个复孔。利用酶标仪(Synergy HTX)检测各组溶液的荧光强度。检测条件为激发光波长542 nm,接收发射波长570~700 nm。该试剂盒检测原理为MAO-B会与其底物benzylamine反应产生过氧化氢,amplex red探针可检测过氧化氢含量转化为荧光信号。当溶液中含有抑制MAO-B活性的物质存在时,产生的过氧化氢减少,荧光信号减弱,即可通过反应后溶液的荧光强度间接判断MAO-B蛋白活性的抑制率。
1.2.3 MTT法检测药物毒性和细胞活力
将3×104个细胞均匀接种于96孔板中,共6行11列,每列设为1组。置于37℃,5% CO2培养箱中培养。当细胞密度达到60%左右时,每组加入含有不同浓度神经毒性药物MPTP的培养基,最终浓度分 别 为0、0.1、1、10、25、50、100、250、500、1000 µmol/L,另设一列空白组。每组所含DMSO含量均为0.1%,孵育24 h后,每孔加入5 mg/mL MTT 20 µL,避光孵育4 h,出现蓝紫色结晶。轻轻吸去培养液,每孔加入200 µL DMSO溶液,用酶标仪振荡1 min使结晶完全溶解分散均匀后检测波长452 nm处的吸光度,按以下公式计算每组的细胞存活率:
细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)
细胞活力检测实验中将毒性物质替换为不同浓度的烟碱,检测方法同上。实验重复3次。
1.2.4 细胞中 NAD+/NADH 0水平检测
将1.2×106个细胞均匀接种在6孔板中,当细胞密度达到60%左右时,每孔加入含有相同浓度MPTP(100 µmol/L),不同浓度烟碱的培养基,最终浓度分别为0、0.1、1、10、100 µmol/L,Pargyline作为阳性对照药物浓度为10 µmol/L。24 h后,收集各组细胞,用NAD+/NADH检测试剂盒(碧云天)提供的试剂和方法处理细胞。具体为,每孔用200µL酸性提取液在冰上裂解细胞,10000 g 4℃离心10 min,取上清,加入等体积碱性提取液,充分混合后10000 g 4℃离心10 min,取上清10 µL用于蛋白浓度测定(BCA蛋白浓度试剂盒),另取50 µL上清分别按序加入试剂盒提供的检测试剂,混匀后,用酶标仪检测570 nm处的吸光度,按以下公式计算每组细胞中NAD+含量:
NAD+含量(nmol/mg)=(A测定-A对照-0.099)×V50/(V10×Cprotein)
实验重复3次。
1.2.5 细胞中ATP水平检测
细胞接种及给药方式同1.2.4,每孔用200 µL ATP裂解液冰上充分裂解细胞后12000 g 4℃离心15 min,取上清10 µL检测蛋白浓度,收集剩余得到样品液。将ATP标准品分别稀释成5 µmol/L,1 µmol/L,0.5 µmol/L,0.1 µmol/L,0.05 µmol/L,0.01 µmol/L。将ATP标准液和样品液加入白色96孔板中,每孔20 µL,每组设3个复孔。每孔加入100 µL检测工作液,迅速用酶标仪通过化学发光通道检测RLU值。绘制标准曲线,计算出各样品组的ATP含量以及蛋白浓度,通过比例可以算出每mg蛋白中所含有ATP的量。
1.2.6 Western-Blot检测细胞中蛋白水平
细胞接种及给药方式同1.2.4,每孔用200 µL含有1%蛋白酶抑制剂(PMSF)的细胞裂解液(RIPA)冰上充分裂解细胞后12000 g 4℃离心5 min,取上清10 µL检测蛋白浓度,另取160 µL上清加入40 µL 5×上样缓冲液(loading buffer),充分混匀后100℃加热10 min,得到样品液。根据各组样品的蛋白浓度换算出各组上样量(电泳蛋白上样量为30 µg),公式为:v=1.25×30/c(对应蛋白浓度)。
配制合适浓度的SDS-PAGE凝胶,根据计算出的上样量将样品加入各凝胶泳道中,用1×上样缓冲液补齐每一泳道的样品总体积。加满电泳液,80 V恒压电泳15 min,120 V恒压电泳约60 min使目标条带分子量完全分开。取出胶块,用甲醇活化过的PVDF膜进行转膜。转膜条件为恒流300 mA 45 min,冰浴。将PVDF膜置于5% BSA封闭液中室温摇床封闭1 h,用目标蛋白的一抗稀释液在4℃下摇床孵育过夜。TBST洗膜3次,每次10 min。用一抗相同种属的二抗稀释液室温下孵育1 h,TBST洗膜3次,每次10 min。将配制好的ECL显色工作液均匀铺满PVDF膜,用凝胶成像仪进行曝光成像,并用Image J软件分析条带灰度值。
1.2.7 流式细胞术检测细胞凋亡
细胞处理步骤同1.2.4,胰酶消化,离心收集细胞后,以缓冲液:Annexin V:PI=100:1:1的比例配制工作液,重悬细胞,避光37℃孵育30 min后PBS洗涤3次,以PBS重悬细胞,用流式细胞仪(贝德曼C6)检测细胞凋亡情况。
1.2.8 HPLC检测不同细胞组分中烟碱含量
利用细胞线粒体分离试剂盒(碧云天)对细胞(前处理同1.2.4)进行线粒体提取和分离。对分离后的组分进行蛋白印迹实验检测组分纯度。各组分的细胞裂解液取200 µL,加入1 mL乙酸乙酯,振荡混匀10 min,离心后取800 µL上清,挥干,用8:2甲醇水200 µL复溶,离心取180 µL上清,得到待测样品溶液。配制浓度分别为2、5、10、20、50、100 ng/mL的烟碱标准溶液,选用对乙酰氨基酚为内标物质,建立标准曲线。用相同条件和方法检测样品溶液,得到样品中烟碱的含量。高效液相色谱分析参照文献[28]中的实验条件,具体如下:
色谱柱型号:Thermo C18 100×2.1 mm;
流动相:10 mmoL醋酸铵:甲醇=15:85。
1.2.9 PD果蝇给药
选取150只一日龄的野生型雄性果蝇为对照组,选取150只一日龄的帕金森疾病模型(Parkin null)雄性果蝇为疾病组,选取150只一日龄的帕金森疾病模型雄性果蝇为治疗组。对照组与疾病组均给予正常食物,治疗组给予含有10 µmol/L烟碱的食物。每一组果蝇分为3管平行组,每小组50只。每天更换食物并记录生存率。
果蝇行为学检测:各组果蝇培养到50天时,进行爬行实验。将每组果蝇随机取出30只存活果蝇,转移至带有刻度的透明长管中,两头用棉花塞紧,饥饿处理2 h后,将管子竖直放置,果蝇从底端开始往上爬行,记录1 min内能爬过20 cm高度的果蝇数量并记录。每组果蝇重复爬行3次,每次爬行后间隔5 min。最后计算出各组果蝇的爬行率。
1.2.10 果蝇大脑中的多巴胺含量检测
每组取10只果蝇用CO2麻醉,在显微镜下用手术级镊子剥离出完整的果蝇大脑,置于120 µL PBS中,用超声细胞粉碎仪破碎组织(冰浴,超声2 s,暂停2 s,共15次),10000 g 4℃离心15 min,取100 µL上清即为待测样品溶液。使用多巴胺检测试剂盒(金霖生物)提供的检测试剂和方法,配制一系列浓度梯度(1000 pg/mL,333.33 pg/mL,111.11 pg/mL,37.04 pg/mL,12.35 pg/mL)的多巴胺标准品,把标准品和待测样品溶液加入试剂盒提供的96孔板中,每孔50µL,先后用试剂盒提供的检测工作液A、B于37℃各孵育1 h后,吸去孔中溶液,每孔加入90 µL底物溶液,37℃避光显色后加入50 µL终止液。随即用酶标仪检测450 nm波长处的吸光度,建立标准曲线,计算出各组果蝇大脑中多巴胺含量。
1.2.11 果蝇大脑中的ATP含量检测
每组取10只果蝇用CO2麻醉,在显微镜下用手术级镊子剥离出完整的果蝇大脑,置于120 µL PBS中,用超声细胞粉碎仪破碎组织(冰浴,超声2 s,暂停2 s,共15次),10000 g 4℃离心15 min,取100 µL上清即为待测样品溶液。使用同1.2.5所述相同试剂盒的相同检测方法对每组果蝇大脑裂解液进行检测,分析方法同上。
1.3 统计学分析
使用Prism 8.0软件对数据进行分析,采用单因素方差分析检验组间差异,利用t-test函数进行分析,检验水准为双侧α=0.05。
2 结果
2.1 烟碱与MAO-B蛋白相互作用的Docking理论结果
Docking是通过研究配体与受体(生物大分子)之间的相互作用,预测两者结合模式和亲和力进而从分子层面解释配体起作用的机制[29]。通过对烟碱、Pargyline与MAO-B蛋白Docking分析,分别计算出烟碱和Pargyline的活性位点与MAO-B功能域FAD反应位点的距离。如图1所示,在两者最稳定构象中,烟碱与FAD的反应位点间距为3.8 Å,而Pargyline与FAD的反应位点间距为5.1 Å。结果表明烟碱具有与MAO-B蛋白结合的理论基础,且反应位点间距短于MAO-B抑制剂Pargyline。

图1 小分子与蛋白互作用Docking模拟结果Fig.1 Docking analysis of Nicotine / MAO-B (1), Pargyline /MAO-B (2)
2.2 烟碱对MAO-B纯蛋白的抑制率
Docking结果为证明烟碱可以抑制MAO-B提供了理论基础,在此基础之上,利用人工重组的人源MAO-B蛋白(Sigma),通过Amplex Red试剂盒检测分析,验证烟碱对MAO-B的抑制作用。如图2(1)所示,烟碱在体外可抑制MAO-B蛋白的活性,且随烟碱浓度增加抑制效果越来越强。由图2(2)结果可知,当烟碱在0~0.1 µmol/L浓度区间内,蛋白抑制率高于Pargyline,当浓度大于1 µmol/L时,抑制率略低于Pargyline,但可达80%及以上。以上结果证明在体外环境下,低浓度烟碱即可有效抑制MAO-B蛋白活性。
2.3 烟碱抑制细胞PD模型MAO-B的作用及对凋亡的影响

图2 烟碱对MAO-B活性抑制作用Fig.2 The inhibitory effect of nicotine on MAO-B
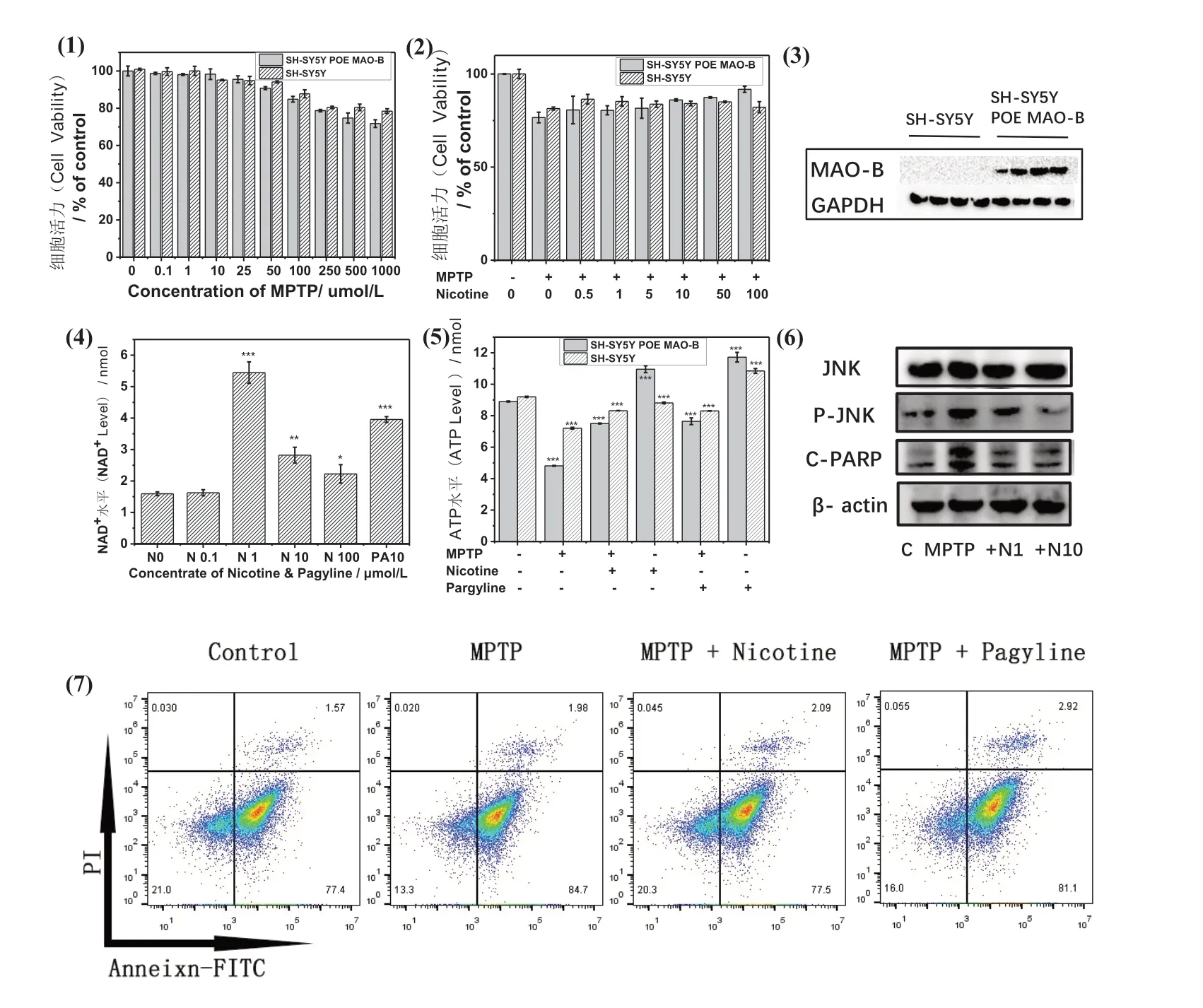
图3 烟碱在细胞PD模型中的保护作用Fig.3 The protective effect of nicotine in cellular PD model
SH-SY5Y是人神经母细胞瘤细胞,具有多巴胺能,它表达酪氨酸羟化酶,也可产生多巴胺,是研究PD常用的细胞系[18]。但SH-SY5Y自身MAO-B表达量很低,本研究利用基因编辑方法成功构建过表达MAO-B的神经细胞系SH-SY5Y POE MAO-B。如图3(3)所示,SH-SY5Y POE MAO-B细胞系中可以稳定表达MAO-B蛋白。在此基础上,利用诱导PD模型常用的神经毒素MPTP,构建神经细胞的PD模型。用MTT筛选出100 µmol/L MPTP孵育24 h,作为后续细胞的PD模型条件。在此基础上,研究烟碱的保护作用。如图3(1)(2)所示,当细胞只给予MPTP刺激时,过表达MAO-B的神经细胞比正常的神经细胞活力低5%左右,而当加入不同浓度烟碱时,过表达MAO-B的细胞系活力逐渐恢复且优于普通神经细胞。基于MPTP的作用机制是通过破坏线粒体呼吸链而影响线粒体的功能,进一步分析细胞给药前后的NAD+以及ATP水平,观察烟碱对神经细胞代谢水平的影响。如图3(4)所示,在过表达MAO-B的细胞中,当给予1 µmol/L浓度烟碱时,细胞中NAD+含量显著升高至5.5 nmol/L与对照组相比具有统计学意义。而给予10 µmol/L,100 µmol/L浓度烟碱时,该细胞中NAD+水平也略有上升。从图3(5)ATP检测结果可见,烟碱以及Pargyline对于过表达MAO-B的细胞系中ATP水平的升高促进作用优于普通神经细胞,检测结果具有统计学意义。为阐明烟碱保护多巴胺能细胞系的分子机制,通过Western-Blot法检测过表达MAO-B细胞中凋亡蛋白水平的变化,结果如图3(6)所示,给予MPTP刺激的细胞中P-JNK,C-PARP蛋白表达均显著升高,而同时加入MPTP和烟碱的细胞中对应的蛋白水平均有所下降。最后通过流式细胞术实验检测细胞凋亡情况,结果如图3(7)所示,在过表达MAO-B的神经细胞中,烟碱和Pargyline都可在一定程度上抑制由MPTP引起的凋亡。MPTP刺激细胞后,凋亡早期细胞比例由对照组的77.4%增加到84.7%,而同时加入MPTP和烟碱的细胞中,晚凋细胞比例降低至77.5%,Pargyline组也有类似的趋势。
2.4 烟碱进入细胞后的分布
MAO-B表达于线粒体外膜,为明确烟碱是否可直接与MAO-B相互作用,通过HPLC对细胞不同组分中的烟碱含量进行检测。首先分离细胞线粒体和胞质组分,用蛋白印迹实验进行验证组分纯度如图4(1)。在此基础上对各组分进行HPLC检测,烟碱含量分布如图4所示。当烟碱浓度为1 µmol/L时如图4(2),给药后0.5 h,胞质中浓度达到80 ng/µg,2 h后降至1.5 ng/mL,检测结果与第一个时间点0.5 h组别相比,具有显著性差异。而线粒体中,从给药后0.5 h至6 h,浓度均在25 ng/µg左右,无明显改变。当烟碱浓度为10 µmol/L时如图4(3),给药后0.5 h,胞质中浓度达到85 ng/µg,2 h后降至30 ng/µg,检测结果与第一个时间点0.5 h组别相比,具有显著性差异。6 h时,胞质浓度又上升至65 ng/µg,而在线粒体组分中,浓度仍维持在25 ng/µg左右,略有下降但无明显变化。这些结果提示,烟碱的确可以到达线粒体,这也为其抑制线粒体外膜上的MAO-B提供了空间基础。
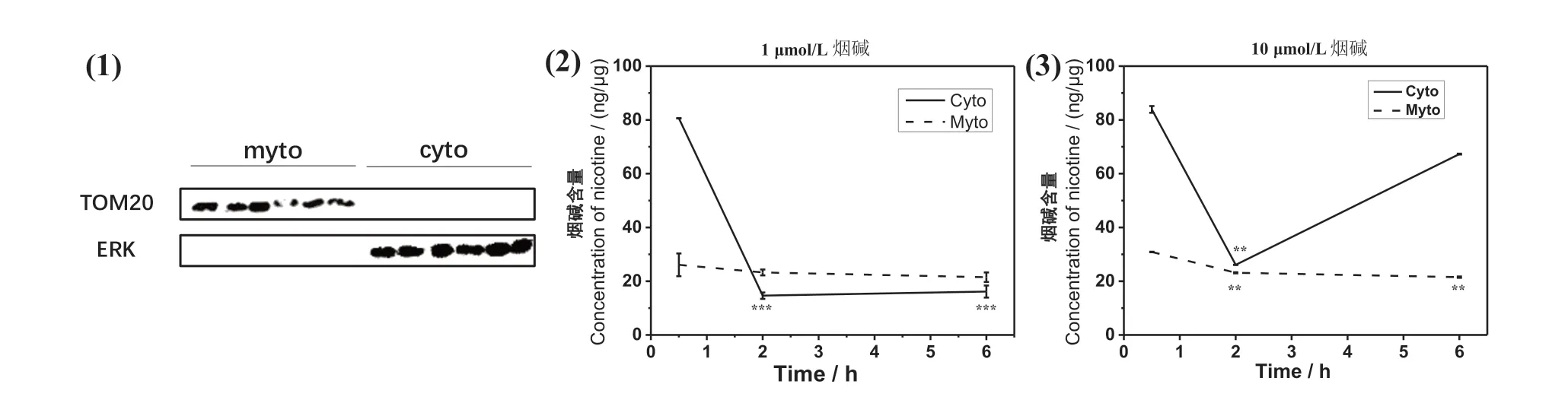
图4 烟碱进入细胞后在不同组分中的含量分布(Myto:线粒体;Cyto:胞质)Fig.4 Content distribution of nicotine in different cell components (Myto: Mitochondria; Cyto: Cytoplasm)
2.5 烟碱对果蝇PD模型保护作用
果蝇生命周期较短,易于养育,它的基因和人有将近70%的一致性,因此经常被用作疾病模型[19]。Parkin基因缺失可导致家族型PD,果蝇敲除Parkin基因也可以产生PD相关症状,包括多巴胺神经元细胞死亡、多巴胺水平下降、运动功能受损等[20]。本实验前期研究结果也表明,MAO-B的活性在Parkin基因敲除果蝇高于正常对照[27]。为明确烟碱在动物水平对PD的对抗作用,在果蝇食物中加入烟碱,研究烟碱对Parkin基因缺陷的PD果蝇的保护作用。基于前期在细胞中筛选出烟碱给药浓度为1 µmol/L,在果蝇实验中,将烟碱配成在食物中终浓度为细胞给药浓度十倍的10 µmol/L进行实验。如图5(1)所示,Parkin null果蝇老龄时翅膀呈现无法收拢的状态,而Wild type果蝇翅膀可以正常收拢,喂食烟碱的Parkin null果蝇翅膀形态有所改善。如图5(2)(3)(4)所示,Wild type果蝇的爬行率,大脑多巴胺含量,肌肉组织ATP含量均显著高于Parkin null果蝇,而喂食烟碱的Parkin null果蝇相应指标也有所改善。
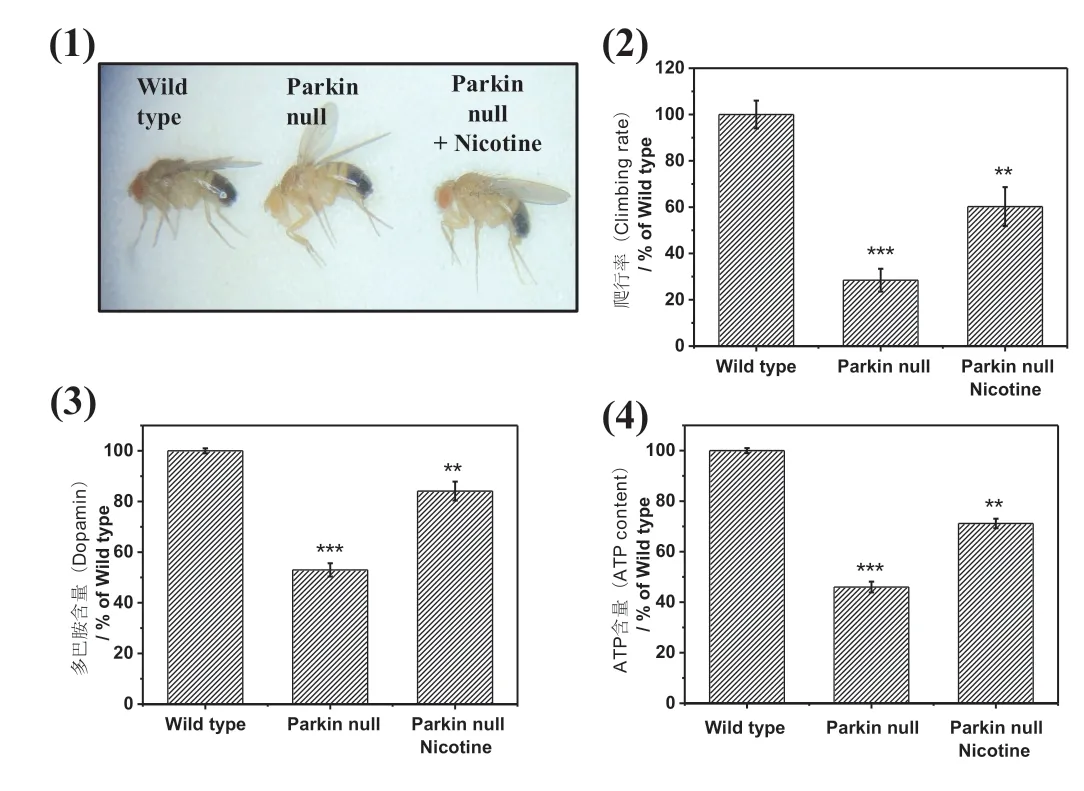
图5 烟碱对PD果蝇的保护作用Fig.5 Protective effect of nicotine on drosophila PD model
3 讨论
MAO-B是帕金森发病过程中重要的致病因子[30-33],MAO-B蛋白含有与半胱氨酸残基共价结合的黄素腺嘌呤二核苷酸(FAD)辅因子,并与两个酪氨酸残基一起形成一个活性空腔,通过两个电子催化胺类底物的α-碳氧化。通过分析发现,烟碱和几种商业化的MAO-B抑制剂(Pargyline,Selegyline,Rasagyline等)结构类似,都属于香豆素衍生物或(杂)芳酰胺类[26]。因此通过小分子与蛋白Docking模拟分析,发现烟碱可以顺利进入MAO-B蛋白活性空腔;且其吡啶环上的N活性较高,可以与MAO-B蛋白FAD辅酶上的活性位点进行反应;反应之后的构象能量较低,较为稳定,这为烟碱可以抑制MAO-B蛋白活性提供了有力的理论基础。
在此基础上进一步利用商业试剂盒对烟碱在体外对MAO-B抑制效果进行验证,发现烟碱小浓度时即可达到较明显的抑制率,但当浓度逐渐增大时,抑制效果趋于饱和,即使再增加浓度也无法完全抑制MAO-B的活性。推测可能是由于烟碱与MAO-B蛋白的结合方式为可逆的,最高抑制率接近90%。
在体外验证烟碱确实具有抑制MAO-B活性的作用后,进行亚细胞器分离实验,明确了烟碱可以分布于线粒体,为其与线粒体外膜上的MAO-B提供了空间结合的理论基础。接着构建过表达MAO-B的神经细胞系,利用MPTP可以被MAO-B催化氧化为神经毒性物质MPP+的特性[31-32],构建了细胞PD模型。实验结果显示烟碱对过表达MAO-B的细胞系的保护作用要优于普通的神经细胞系。这间接证明了烟碱极有可能通过抑制MAO-B活性,减少对MPTP的氧化,进一步减少了MPP+和过氧化氢的产生,减轻了神经毒性作用和氧化应激作用。这在WB结果中也得到了验证,MPTP组别中氧化应激相关的蛋白P-JNK表达升高,而给予烟碱后,该蛋白表达量下降。本研究对细胞代谢标志物NAD+和ATP含量进行了检测,结果一致证实了烟碱对过表达MAO-B细胞系的保护作用。而流式凋亡检测结果和凋亡相关蛋白Cleaved-PARP的变化,也验证了在低浓度烟碱(1 µmol/L,10 µmol/L)给药条件下,可以缓解MPTP所引起的过表达MAO-B神经细胞凋亡。最后,通过HPLC检测了烟碱进入细胞后不同时间在线粒体和细胞质中的分布情况,发现胞质中的烟碱含量随给药浓度的增大有所增加,但在线粒体中,加大给药浓度或是给药时间,烟碱的含量基本保持稳定。这可能是由于烟碱给药半小时之内即可到达线粒体,并于线粒体外膜上的MAO-B结合,只有结合的烟碱分子留在线粒体内,多余的烟碱则回到胞质中,而线粒体上MAO-B蛋白含量有限,因此线粒体中烟碱很容易达到饱和,且结合后不易被细胞代谢排出胞外。目前主流的观点认为烟碱对抗帕金森症的机制为结合神经细胞外膜上的乙酰胆碱受体,激活一系列GABA能信号通路。本研究验证了烟碱可进入细胞并到达线粒体,而MAO-B是存在于线粒体外膜上的蛋白,这为认识烟碱抑制MAO-B提供了结构基础。该研究首次构建可稳定过表达MAO-B的多巴胺能神经细胞系,以PD模型进行了研究,为认识烟碱对抗帕金森病的机制提供了新的思路。
最后在果蝇PD模型中进行了活体实验[34-35],验证烟碱在体内是否能发挥神经保护作用。结果发现在烟碱低浓度(10 µmol/L)给药条件下,可有效缓解疾病组的肌肉状态(从肌肉组织ATP含量和翅膀形态可见),提高大脑多巴胺含量,原因可能是烟碱抑制MAO-B活性之后可以减少对多巴胺的降解,从而提高脑内多巴胺含量[36]。因此从多巴胺含量的变化来看,烟碱具有通过抑制MAO-B活性来发挥对抗帕金森疾病的可能性。
4 结论
综上所述,本研究从理论模拟、体外蛋白水平证实了烟碱对MAO-B的抑制作用,在细胞、实验动物水平验证了烟碱可能通过抑制MAO-B对抗帕金森症表型的作用。这一保护机制不同于已报道研究结果,为充分认识烟碱对抗帕金森病的机制奠定了实验基础,为有效开发利用烟草提供了新思路。

