北部湾养殖牡蛎体内异养细菌数量及其耐药性研究
李炳, 王瑞旋, 张立, 罗帮, 牟红莉, 王江勇
1. 上海海洋大学, 水产科学国家级实验教学示范中心, 上海 201306;
2. 韩山师范学院, 广东 潮州 521041;
3. 中国水产科学研究院南海水产研究所, 广东省渔业生态环境重点实验室, 广东 广州 510300;
4. 广西壮族自治区水产科学研究院, 广西 南宁 530021;
5. 惠州学院, 广东 惠州 516007
香港牡蛎隶属双壳纲、牡蛎科, 其产量高、生长快、营养丰富、经济价值高, 是我国华南沿海重要经济贝类之一。近年来, 海域污染、养殖密度增加、纯系种质退化、病害侵袭、缺乏科学管理等问题日渐凸显(张锐, 2014)。在华南沿海牡蛎养殖区,大规模死亡事件时有发生, 一般在每年的3—5月份和10—12月份, 死亡率达80%~90%, 目前认为牡蛎的大规模死亡是由病害和环境等因素共同导致的(张占会, 2006)。在广西的牡蛎养殖区(包括大风江、钦州港、青菜头一带), 每年4—5月期间牡蛎死亡率高达60%。据报道, 该区域春季降雨少, 盐度居高不下, 香港牡蛎精卵的排放受到抑制, 进而性腺发育过熟和退化, 这可能是造成牡蛎大规模死亡的主要原因(於锋 等, 2016)。夏季持续高温导致牡蛎死亡的情况也有发生, 牡蛎在异常环境如病原体、温度、盐度和氨氮浓度等因素突变下, 会出现新陈代谢紊乱、免疫机能异常, 甚至发病死亡(廉伟 等, 2010)。牡蛎是滤食性的双壳贝类, 主要通过过滤海水来获取水体中的有机物、微生物作为食物。牡蛎在滤食过程中体内会大量聚集养殖水体中的细菌, 其中包括气单胞菌(Aeromonas)、弧菌(Vibrio)等条件致病菌(Balbi et al, 2019; Grilo et al, 2020)。弧菌广泛存在于海洋环境中, 弧菌中的某些致病菌, 如哈维弧菌(V.harvei)是一种毒力强、流行广的细菌性病原体。据报道, 随海水温度、盐度升高, 弧菌等条件致病菌繁殖达到一定阈值后, 致病菌将会侵袭贝类的外套膜、鳃、肝胰腺等组织, 造成贝类大量死亡(明红霞等, 2015; 刘晓靖 等, 2019; Wickramanayake et al,2020)。
从上世纪40年代以来, 多种抗生素被应用在水生动物的细菌性疾病防治上, 例如土霉素、青霉素、卡那霉素、氯霉素等(Tendencia et al, 2001)。目前, 水产细菌性疾病的防治手段主要以抗生素为主, 因而抗生素的滥用情况时有发生, 导致细菌耐药性问题日益严重(Wu et al, 2019; 魏文娟 等, 2020)。对皱纹盘鲍(Haliotis discus hannai)消化道中异养细菌耐药率的研究发现, 大部分菌株为多重耐药菌株, 对青霉素、卡那霉素、庆大霉素、利福平的耐药率最高达83.9%(孙永婵 等, 2017)。根据笔者此前对广东沿海的香港牡蛎体内异养菌的研究, 异养细菌对青霉素、呋喃唑酮、克林霉素、卡拉霉素、阿莫西林及万古霉素有较强的耐药性, 且高温时期分离的异养细菌大部分为多重耐药细菌, 其在6月和9月所占比例分别为84.18%和91.72%(李炳 等, 2020)。众所周知, 异养细菌在海洋生态系统中(如能量流动、物质循环等方面)起着重要作用。异养细菌作为水体有机质高低的指示生物, 在《水环境监测规范》(SL219-98)中, 异养细菌丰度是地表水和地下水水体监测的必测项目(肖慧, 2005; 谢煜 等, 2017;Begum et al, 2019)。本研究针对同一海域出现不同程度死亡的牡蛎, 从微生物角度出发探究牡蛎死亡率与微生物之间的相关性, 旨在了解牡蛎体内异养细菌数量与牡蛎死亡率之间的联系以及牡蛎体内异养细菌种属之间的差异。同时, 对牡蛎体内异养细菌的耐药性进行比较分析, 掌握牡蛎体内异养菌的多重耐药情况。本文研究结果能够为牡蛎的细菌性疾病预警以及牡蛎的健康养殖提供参考依据。
1 材料与方法
1.1 实验样品
2019年5月在广西北部湾茅尾海养殖区(盐度:21‰~25‰; pH: 7.5~8.0; 温度: 27.5℃)采集吊养的香港牡蛎样本。采样时, 在同一海域A、B、C三个采样点随机抽取数十吊, 并统计每吊死亡牡蛎的数量。其中, A采样点的平均死亡率为70%(记为高死亡率养殖区), B采样点的平均死亡率为50%(记为中死亡率养殖区), C采样点的平均死亡率为20%(记为低死亡率养殖区)。随机挑取有活性的牡蛎5~10个,清洗牡蛎外壳后称取0.5g的内脏团并置于灭菌后的1.5mL玻璃匀浆器中, 加入无菌生理盐水稀释至10-3、10-4、10-5的稀释度。将各个梯度的稀释液涂布于脑心浸液琼脂培养基(BHA培养基)、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS培养基)、水解酪蛋白琼脂培养基(MHA培养基), 这3种培养基均购于环凯生物科技有限公司。每个稀释梯度设置3组平行, 培养基放于恒温培养箱中28℃培养96h,培养后对各个培养基的异养细菌数量和弧菌数量进行统计。BHA培养基计数结果为异养细菌总数,TCBS培养基计数结果为弧菌数量, MHA培养基计数结果为对单种药物具有抗性的菌株数量。
1.2 耐药菌株(单种药物)的分离
取牡蛎内脏匀浆液均匀涂布在添加了抗生素药物的MHA培养基上, 分别为恩诺沙星(8μg·mL-1)、庆大霉素(16μg·mL-1)、环丙沙星(4μg·mL-1)、呋喃唑酮(4μg·mL-1)、氯霉素(8μg·mL-1)、利福平(4μg·mL-1)、复方新诺明(胺甲恶唑16μg·mL-1, 甲氧苄啶4μg·mL-1),抗生素药粉购于上海阿拉丁生化有限公司。然后挑取培养基上的单菌落, 经过划线分离和纯化后保存, 将用于后续的菌株鉴定和细菌耐药性研究中。
1.3 细菌16S rDNA的扩增及菌株鉴定
使用试剂盒提取细菌DNA(购于广州吉瑞生物有限公司), 以细菌DNA为模板、上下游引物、PCR-mix、ddH2O进行PCR扩增。
反应体系(25μL体系): PCR-mix 12.5μL、上游引物1μL、下游引物1μL、DNA模板1μL、ddH2O 9.5μL。采用引物8F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492F(5'-CGGTTACCTTGTTACGACTT-3')进行扩增。
扩增反应条件为: 95℃预变性5min, 95℃变性40s, 55℃复性40s, 72℃延伸45s, 其中第2步至第4步进行35个循环, 之后72℃延伸10min, 4℃终止反应。
PCR产物在1%的琼脂糖凝胶中进行电泳, 得到单一目的条带之后(约1500bp), 样品送至广州天一辉远有限公司进行序列测定, 将测序结果输入GenBank(http://www.ncbi.nlm.nih.gov)中进行数据比对, 确定菌株的种属。
1.4 药物敏感实验及耐药率计算
本研究中药敏纸片购于杭州生物试剂有限公司,分别为: 青霉素(10μg·mL-1)、阿莫西林(10μg·mL-1)、万古霉素(30μg·mL-1)、恩诺沙星(10μg·mL-1)、诺氟沙星(10μg·mL-1)、氧氟沙星(5μg·mL-1)、环丙沙星(5μg·mL-1)、庆 大 霉 素(10μg·mL-1)、新 霉 素(30μg·mL-1)、链 霉 素(10μg·mL-1)、妥 布 霉 素(10μg·mL-1)、红 霉 素(15μg·mL-1)、多 西 环 素(30μg·mL-1)、四 环 素(30μg·mL-1)、氟 苯 尼 考(30μg·mL-1)、氯霉素(30μg·mL-1)。
药敏测试实验采用纸片扩散法, 实验操作过程参考相关药敏实验及研究文献(李璐璐 等, 2014;Wang et al, 2014)。以大肠杆菌(Escherichia coli)ATCC25922和金黄色葡萄球菌(Staphyloccocus aureus)ATCC25923为参考菌株进行质控, 通过游标卡尺测量药敏纸片的抑菌圈直径。以CLSI文件M100药敏实验判定标准(Clinical and Laboratory Standards Institute, 2012)判定菌株对抗生素的敏感程度, 并以S(敏感)、I(中度)、R(耐药)表示。对各个菌株的抗性药物进行分类、记录, 形成其特有的耐药谱型(耐药谱型即菌株对不同抗生素的耐受情况),以便开展后续的耐药性分析(毛灿 等, 2020)。对3种及3种以上的抗生素存在抗性的菌株被判定为多重耐药菌(Magiorakos et al, 2012)。计算不同死亡率养殖区菌株的多重耐药指数为 Σn/(D×S)(Krumperman, 1983), 其中n为菌株存在抗性的药物数量, Σn即为所有菌株存在抗性的药物数量总和;D和S分别是实验所用的抗生素种类数量和菌株数量。耐药谱型丰富度(%)=耐药谱型种数/耐药谱型总数×100。
1.6 数据分析
使用Excel 2010软件、IBM SPSS 22进行实验数据及单因素方差分析, 利用Spearman进行相关性分析, 进一步统计分析异养细菌数量、弧菌数量和牡蛎死亡的相关性。
2 结果
2.1 牡蛎体内细菌与牡蛎死亡率的相关性分析及细菌数量统计
各养殖区的牡蛎体内异养细菌和弧菌经分离、培养和统计, 异养细菌数量由高到低依次为: 高死亡率养殖区[(8.6±0.4)×106CFU·g-1]>中度死亡率养殖区[(6.9±0.2)×106CFU·g-1]>低死亡率养殖区[(3.3±0.1)×106CFU·g-1]; 弧菌数量由高到低依次为:高死亡率养殖区[(9.5±0.4)×105CFU·g-1]>中死亡率养殖区[(4.5±0.6)×105CFU·g-1]>低死亡率养殖区[(2.5±0.6)×105CFU·g-1]。对各个养殖区牡蛎体内异养细菌和弧菌数量的平均值分别取对数值, 结果显示异养细菌数量比弧菌数量高1~2个数量级(图1)。高死亡率养殖区牡蛎体内异养细菌数量与低死亡率养殖区牡蛎体内异养细菌数量差异极显著(P<0.01);高死亡率养殖区牡蛎体内弧菌数量与低死亡率养殖区牡蛎体内弧菌数量差异显著(P<0.05)。根据各养殖区牡蛎体内异养细菌及弧菌数量经SPSS进行的Spearman相关性分析结果(见表1), 异养细菌数量与牡蛎死亡率的相关系数为0.996, 弧菌数量与牡蛎死亡率的相关系数为0.936。

图1 各养殖区域牡蛎体内的异养细菌数量和弧菌数量Fig.1 The numbers of heterotrophic bacteria and Vibrio in oysters from different farming areas

表1 牡蛎死亡率与细菌数量的相关性Tab.1 Correlation between oyster mortality and number of bacteria
根据不同抗生素培养基生长细菌数量的对数值(图2)可知, 来自不同死亡率养殖区域的牡蛎细菌数量差异较大, 并且以利福平和呋喃唑酮培养基生长的细菌数量较大。其中, 高死亡率环境中的牡蛎体内的细菌主要在庆大霉素、利福平、氯霉素、呋喃唑酮、环丙沙星培养基上生长, 数量分别为9.4×102CFU·g-1、7.8×103CFU·g-1、2.0×102CFU·g-1、1.1×104CFU·g-1、2.0×102CFU·g-1; 中度死亡率环境中的牡蛎体内的细菌主要在庆大霉素、利福平、氯霉素、呋喃唑酮培养基上生长, 数量分别为4.0×102CFU·g-1、1.1×104CFU·g-1、8.0×102CFU·g-1、1.4×104CFU·g-1; 低死亡率环境中的牡蛎体内的细菌仅在庆大霉素、利福平、呋喃唑酮培养基上生长,数 量 分 别 为 6.0×102CFU·g-1、9.0×103CFU·g-1、1.1×104CFU·g-1。
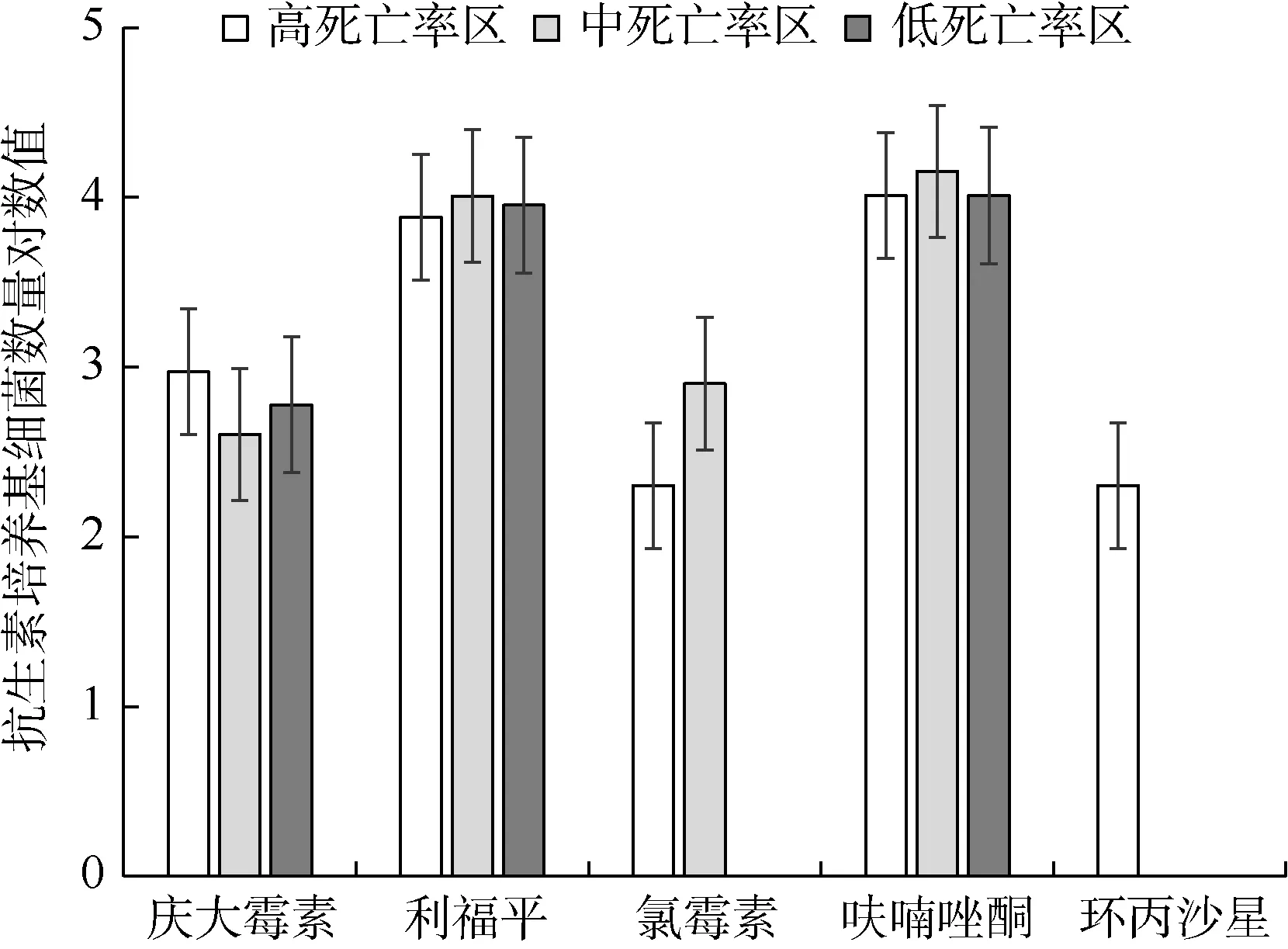
图2 不同抗生素培养基生长的细菌数量Fig.2 The numbers of heterotrophic bacteria and Vibrioin oysters from different farming areas
2.2 牡蛎体内耐药细菌的鉴定及分类
牡蛎体内的耐药细菌经添加单种抗生素的药物平板筛选后, 进一步进行分离、培养、鉴定。如表2所示, 在高死亡率环境中的牡蛎体内分离了64个菌株, 主要来自呋喃唑酮、利福平、庆大霉素、环丙沙星和氯霉素的培养基; 在中死亡率环境中的牡蛎体内分离了68个菌株, 主要来自呋喃唑酮、利福平、氯霉素、庆大霉素的培养基; 低死亡率环境中的牡蛎体内分离了24个菌株, 主要来自呋喃唑酮、利福平和庆大霉素的培养基。

表2 各养殖区牡蛎体内的耐药菌株种属及数量Tab. 2 Classification of antibiotic-resistant strains in oysters from different farming areas
根据表2所示, 高死亡率养殖区域牡蛎体内分离的耐药菌株主要为: 弧菌属(Vibrio)、发光杆菌属(Photobacterium)、大洋单胞菌属(Oceanimonas)、类香味菌属(Myroides)、海单胞菌属(Marinomonas)、藤杆菌属(Tenacibaculum)、希瓦氏菌属(Shewanella)、假单胞菌属(Pseudomonas)、短波单胞菌属(Brevundimonas); 中死亡率养殖区域牡蛎体内分离的耐药菌株主要为: 弧菌属(Vibrio)、发光杆菌属(Photobacterium)、海单胞菌属(Marinomonas)、大洋单胞菌属(Oceanimonas)、希瓦氏菌属(Shewanella)、芽孢杆菌属(Bacillus); 低死亡率区域牡蛎体内分离的耐药菌株主要为: 弧菌属(Vibrio)、发光杆菌属(Photobacterium)、不动杆菌属(Acinetobacter)、黄杆菌属(Flavobacterium)、芽孢杆菌属(Bacillus)、希瓦氏菌属(Shewanella)。
2.3 牡蛎体内细菌对不同抗生素的耐药情况
对牡蛎体内分离的耐药菌进行了16种常用药物敏感性实验, 耐药菌对各药物的耐药率如图3所示。由图3可知, 异养细菌对β-内酰胺类(青霉素、阿莫西林)、糖肽类(万古霉素)抗生素表现出较高的耐药率, 平均为69.2%; 对四环素类(四环素、多西环素)的耐药率平均为31.6%; 对氨基糖苷类(庆大霉素、链霉素、新霉素、妥布霉素)的耐药率平均为20.2%; 对大环内酯类(红霉素)、氯霉素类的耐药率平均为14.5%; 对喹诺酮类(诺氟沙星、环丙沙星、氧氟沙星、恩诺沙星)的耐药率平均为5.1%。

图3 异养细菌对不同抗生素的耐药率Fig.3 Resistant rate of bacteria to different antibiotics
低死亡率养殖区牡蛎体内分离的24个菌株对各种抗生素的耐药性存在差异(表3), 其中对青霉素、万古霉素、阿莫西林的耐药率较高, 分别为75%、50%和45.8%, 对妥布霉素、四环素、链霉素、多西环素的耐药率介于33.3%~20.8%, 对红霉素、氯霉素、新霉素、氟苯尼考、恩诺沙星、诺氟沙星、氧氟沙星、环丙沙星的耐药率在10%以下。根据表3所示, 低死亡率养殖区牡蛎体内分离的菌株的耐药谱型共17种, 分别为H1~H17, 谱型丰富度为70.8%。H1~H3型对1种抗生素耐药, 占总菌数的16.6%; H4、H5型对2种抗生素耐药, 占总菌数的25.0%; H6、H7型对3种抗生素耐药, 占总菌数的12.5%; H8、H9型对4种抗生素耐药, 占总菌数的16.6%; H10~H12型对5种抗生素耐药, 占总菌数的12.5%; H13~H15型对6种抗生素耐药, 占总菌数的12.5%; H16型对7种抗生素耐药, 占总菌数的4.16%; H17型对14种抗生素耐药, 占总菌数的4.16%。在低死亡率养殖区牡蛎分离的菌株中, 多重耐药菌株占58.4 %, 多重耐药指数(MARI)为0.28。
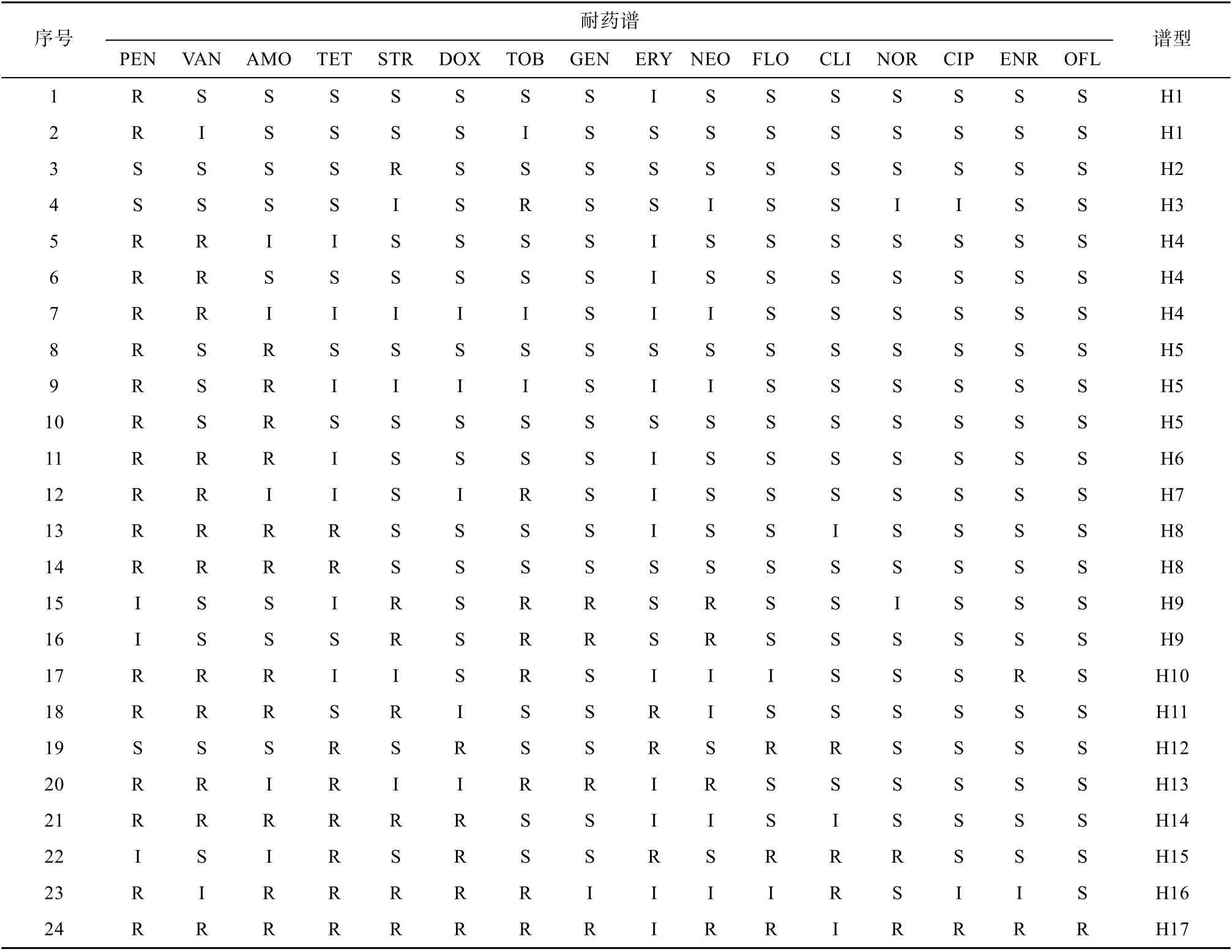
表3 低死亡率养殖区牡蛎体内异养细菌的耐药谱Tab. 3 Antibiotic resistance spectrum of heterotrophic bacteria in oysters in low-mortality farming area
中死亡率养殖区的牡蛎体内分离的68个菌株对16种抗生素的耐药存在差异, 其中对青霉素、万古霉素的耐药率为92.6%, 对阿莫西林、四环素、多西环素的耐药率分别为42.6%、32.3%、27.9%, 对链霉素、庆大霉素、红霉素、新霉素、氯霉素、氟苯尼考、恩诺沙星、诺氟沙星、氧氟沙星、环丙沙星的耐药率均在15%以下。中死亡率养殖区牡蛎分离的菌株的耐药谱型共30种(表 4), 分别为M1~M30, 谱型丰富度为44.2%。M1~M3型对1种抗生素耐药, 占总菌数的4.42%; M4、M5型对2种抗生素耐药, 占总菌数的29.4%; M6~M12型对3种抗生素耐药, 占总菌数的27.9%; M13~M19型对4种抗生素耐药, 占总菌数的16.1%; M20~M23型对5种抗生素耐药, 占总菌数的7.35%; M24~M27型对6种抗生素耐药, 占总菌数的8.82%; M28、M29型对7种抗生素耐药, 占总菌数的2.9%; M30型对8种抗生素耐药, 占总菌数的1.47%。在中死亡率养殖区牡蛎体内分离的菌株中, 多重耐药菌株占66.2%,多重耐药指数(MARI)为0.22。

表4 中死亡率养殖区牡蛎体内异养细菌的耐药谱Tab. 4 Antibiotic resistance spectrum of heterotrophic bacteria in oysters in medium-mortality farming area

续表
高死亡率养殖区的牡蛎体内分离的64个菌株对16种抗生素的耐药存在差异, 其中对青霉素、万古霉素的耐药率分别为81.3%、73.4%, 对链霉素、阿莫西林和四环素的耐药率分别为45.3%、42.3%、43.3%, 对红霉素、妥布霉素、诺氟沙星、庆大霉素、氯霉素、新霉素和多西环素的耐药率为29.7%~21.9%, 对恩诺沙星、氧氟沙星、环丙沙星的耐药率在11%以下。高死亡率养殖区牡蛎分离的菌株的耐药谱型共48种(表5), 分别为D1~D48, 谱型丰富度为75%。D1~D4型对1种抗生素耐药, 占总菌数的10.9%; D5型对2种抗生素耐药, 占总菌数的9.4%; D6~D15型对3种抗生素耐药, 占总菌数的27.9%; D16~D20型对4种抗生素耐药, 占总菌数的7.81%; D21~D26型对5种抗生素耐药, 占总菌数的14.1%; D27~D35型对6种抗生素耐药, 占总菌数的15.6%; D36~D40型对7种抗生素耐药, 占总菌数的10.9%; D41型对8种抗生素耐药, 占总菌数的3.1%;D42~D46型对9种抗生素耐药, 占总菌数的7.8%;D47型对11种抗生素耐药, 占总菌数的1.5%; D48型对12种抗生素耐药, 占总菌数的3.1%。在高死亡率养殖区牡蛎体内分离的菌株中, 多重耐药菌株占79.7%, 多重耐药指数(MARI)为0.31。
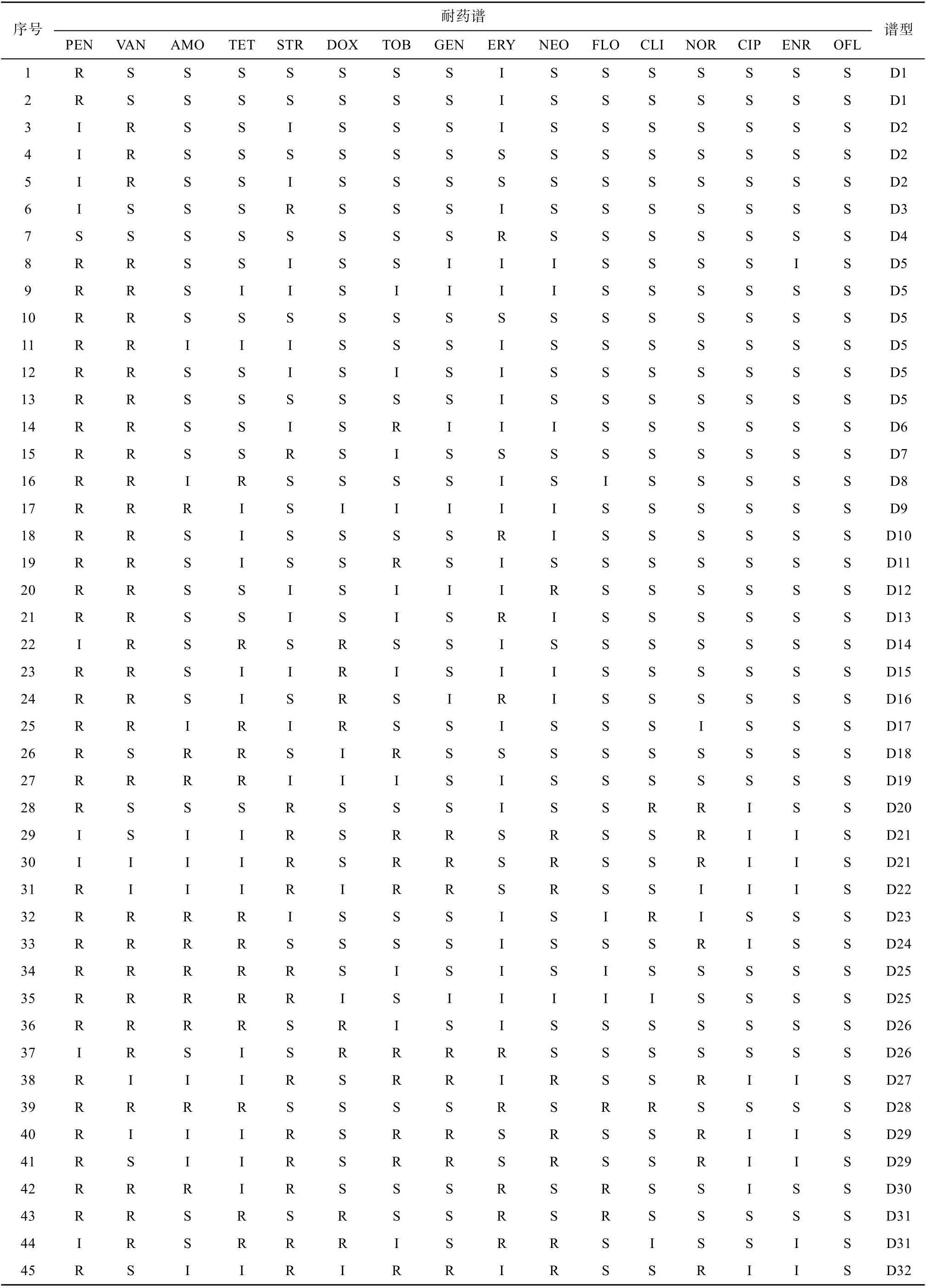
表5 高死亡率养殖区牡蛎体内异养细菌的耐药谱Tab. 5 Antibiotic resistance spectrum of heterotrophic bacteria in oysters in high-mortality farming area
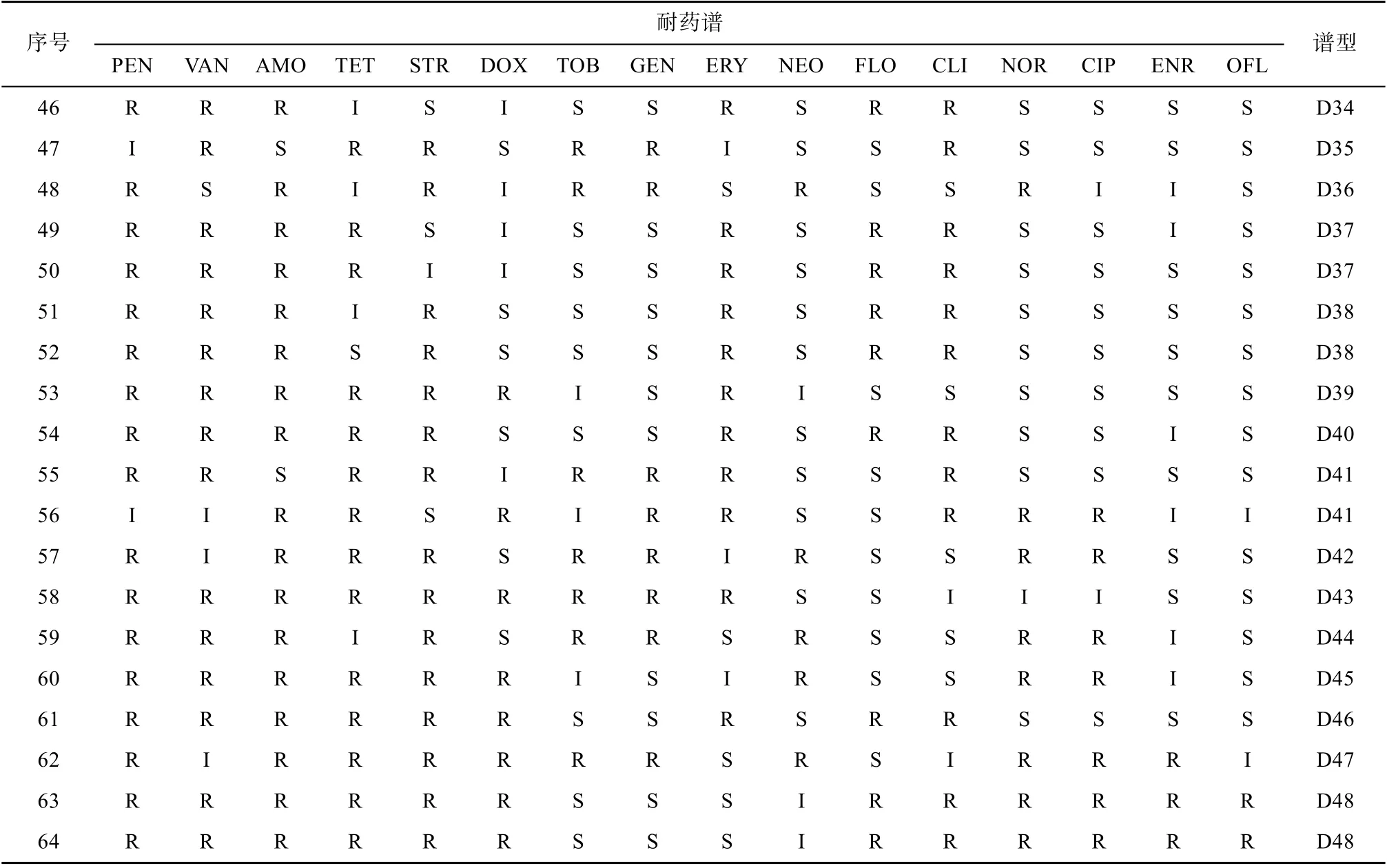
续表
3 讨论
3.1 不同死亡率养殖区的牡蛎体内异养细菌和弧菌数量分析
异养细菌在养殖生态系统中有着重要的作用,其生长速度快、周期短、变化快(Zaccone et al, 2002;Huang et al, 2020)。据报道, 异养细菌能够指示水体中有机质的高低, 在《水环境监测规范》(SL219-98)中是水体监测的必检项目(谢煜 等, 2017)。异养细菌的数量及组成的变化可间接地影响养殖动物的健康(González et al, 2003; 骆向萍 等, 2014)。异养细菌中的弧菌广泛存在于海洋环境和海洋动物体内,大多数病原弧菌具有侵袭贝类的外套膜、鳃、肝胰腺等组织的能力, 从而引起贝类大规模死亡(张颖雪等, 2019; Xie et al, 2020)。本研究中异养细菌数量由高到低依次为: 高死亡率养殖区(8.6×106CFU·g-1)>中死亡率养殖区(6.9×106CFU·g-1)>低死亡率养殖区(3.3×106CFU·g-1)。高死亡率和中死亡率养殖区牡蛎体内异养细菌多样性较丰富, 其中弧菌、发光杆菌、大洋单胞菌、希瓦氏菌等出现频率较高; 低死亡率养殖区牡蛎体内分离的异养细菌种类较单一, 主要为发光杆菌和弧菌。在易引发海参病害的池塘中,弧菌总数(3.4×105CFU·g-1)显著高于正常池塘(2.5×105CFU·g-1)(陈文博 等, 2012)。本研究中高死亡率养殖区牡蛎体内的异养细菌数量为8.6×106CFU·g-1,弧菌数量为9.5×105CFU·g-1, 较Wang等(2016)对牡蛎体内异养细菌数量(5.3×104CFU·g-1)和弧菌数量(6.0×103CFU·g-1)的周年监测结果高出1~2个数量级。
环境因子与异养细菌的数量有着密切的关系。钟硕良等(2012)对贝类养殖环境中异养细菌的研究发现, 异养细菌数量在不同环境中的大小排序为:虾塘养殖区>滩涂养殖区>浅海养殖区。根据凌慧等(2019)对方斑东风螺养殖水体中的细菌数量研究结果发现, 异养细菌的数量与氮氨呈正相关关系, 与亚硝酸盐氮则呈负相关关系, 弧菌数量与温度呈负相关关系。因此, 在后续的研究中应更多地关注环境因子对牡蛎体内异养细菌数量的影响, 了解异养细菌与盐度、温度、氮氨等环境因子之间的关系。本研究中3个不同牡蛎死亡率的采样点在同一海区,其盐度、温度等环境因素差异不大, 因而从微生物角度出发探究牡蛎不同死亡率之间的差异。有研究表明异养细菌和弧菌数量越高, 病害发生几率越大(Cao et al, 2015; 董杨 等, 2016)。本研究中弧菌数量由高到低依次为: 高死亡率养殖区(9.5×105CFU·g-1)>中死亡率养殖区(4.5×105CFU·g-1)>低死亡率养殖区(2.5×105CFU·g-1), 牡蛎体内异养细菌数量和弧菌数量与死亡率呈正相关关系, 相关系数分别为0.99和0.93。这表明在水产养殖中弧菌数量与养殖牡蛎的健康密切相关, 弧菌在异养细菌中占绝大多数, 牡蛎体内弧菌数量越多, 异养细菌丰度越大, 牡蛎发病死亡的风险就越高。
3.2 不同死亡率养殖区的牡蛎体内异养细菌耐药性分析
目前, 针对水产细菌性疾病的主要防治方式是使用抗生素。然而水生动物对抗生素药物的代谢吸收仅有20%~30%(李兆新 等, 2017), 水生环境中残留着大量的抗生素(Chen et al, 2019)。细菌在抗生素的选择性压力下发生自适应突变, 从而细菌耐药性变强, 甚至出现多重耐药的“超级细菌”(Huo et al,2010)。据报道, 水产养殖中细菌对酰胺醇类、四环素类的耐药率较高, 而对喹诺酮类的耐药率较低(王瑞旋 等, 2013; 吴小梅 等, 2015)。本研究中来自各养殖区的牡蛎所分离的异养细菌对β-内酰胺类抗生素(青霉素、阿莫西林)的耐药率较高, 对大环内酯类(红霉素)、喹诺酮类(诺氟沙星、环丙沙星、氧氟沙星、恩诺沙星)的耐药率较低, 这与李炳等(2020)对广东沿海牡蛎体内的细菌耐药性研究结果相似。本研究揭示了细菌对青霉素、卡那霉素、克林霉素、呋喃唑酮、阿莫西林及万古霉素表现出较强的耐药性。本研究分离的耐药细菌主要为弧菌属、发光杆菌属、假单胞菌属、希瓦氏菌属等革兰氏阴性(G-)菌, 其细胞壁的肽聚糖含量低, 细胞壁不易受损;青霉素、万古霉素、阿莫西林等抗生素主要针对革兰氏阳性(G+)菌细胞壁的肽聚糖, 故耐药率较高。本研究中, 高死亡率养殖区的牡蛎所分离的细菌主要来自呋喃唑酮、庆大霉素、利福平、氯霉素和环丙沙星培养基, 而低死亡率养殖区牡蛎体内的细菌仅在呋喃唑酮、庆大霉素和利福平培养基上生长, 在氯霉素、环丙沙星和复方新诺明培养基上却几乎没有生长。这一结果间接反映了不同死亡率养殖区牡蛎体内的细菌耐药性差异, 高死亡率养殖区的牡蛎体内耐药细菌数量多、耐药谱型较广; 低死亡率养殖区的牡蛎体内耐药细菌较少, 对环丙沙星、氯霉素和复方新诺明等药物较敏感。
多重耐药细菌广泛存在于养殖水体中(Prabhu et al, 2007; Abriouel et al, 2008)。据写腊月等(2011)对海水养殖弧菌耐药性的调查结果, 多重耐药细菌的比例高达80.4%; 王瑞旋等(2012)在对水产致病菌耐药性的研究中发现, 多重耐药菌株占68.5%。某些病原菌对抗生素具有广谱性的耐药, 其耐药性可能通过耐药基因等移动元件水平传播到其他致病菌,从而进一步威胁水生动物甚至人类的健康(Li et al,2020 )。本研究中由单种药物筛选分离得到的异养细菌大多数显示出多重耐药性, 其中高死亡率养殖区的牡蛎体内多重耐药菌占79.7%, 其耐药谱型(48种)较广; 中死亡率养殖区牡蛎体内多重耐药菌占66.2%, 其耐药谱型为30种; 低死亡率养殖区牡蛎体内多重耐药菌占58.4%, 其耐药谱型为17种。Krumperman(1983)在多重耐药指数研究中指出, 多重耐药指数>0.2说明细菌可能受到抗生素污染的风险较高。本研究中牡蛎体内异养细菌的多重耐药指数(MARI)为0.22~0.31, 多重耐药指数偏高, 异养细菌可能处于抗生素暴露状态。因此, 在生产实践中应尽可能地减少抗生素的使用, 避免抗生素滥用和污染等情况的出现。
4 结论
本文研究结果表明, 不同死亡率环境中牡蛎体内的异养细菌数量由高到低依次为: 高死亡率养殖区[(8.6±0.4)×106CFU·g-1]>中 度 死 亡 率 养 殖 区[(6.9±0.2)×106CFU·g-1]>低死亡率养殖区[(3.3±0.1)×106CFU·g-1]; 弧菌数量由高到低依次为: 高死亡率养 殖 区[(9.5±0.4)×105CFU·g-1]>中 死 亡 率 养 殖 区[(4.5±0.6)×105CFU·g-1]>低死亡率养殖区[(2.5±0.6)×105CFU·g-1]。牡蛎体内的弧菌数量与牡蛎死亡率呈正相关关系, 进一步反映了弧菌数量越多, 牡蛎死亡的风险越大。本研究分离获得的耐药细菌主要为弧菌属、发光杆菌属、假单胞菌属、希瓦氏菌属等革兰氏阴性菌。分离的菌株对β-内酰胺类抗生素(青霉素)、糖肽类(万古霉素) 的耐药率较高; 对四环素类(四环素、多西环素)的耐药率次之; 对氨基糖苷类(链霉素、庆大霉素、妥布霉素、新霉素)、大环内酯类(红霉素、氯霉素)、喹诺酮类(诺氟沙星、环丙沙星、氧氟沙星、恩诺沙星)的耐药率较低。不同死亡率养殖区牡蛎体内的多重耐药细菌数量由高到低依次为: 高死亡率养殖区(79.7%)>中死亡率养殖区(66.2%)>低死亡率养殖区(58.4%), 多重耐药指数(MARI)为0.22~0.31。牡蛎不同程度的死亡与其体内的异养细菌数量和细菌耐药性有关, 异养细菌数量与牡蛎死亡率呈正相关关系, 相关系数为0.996。

