1型发作性睡病非快速眼动睡眠期脑网络拓扑特征及其与认知行为评价的相关性
朱晓宇,倪坤林,谭慧文,刘奕姝,曾尹,郭启勇,肖莉,3,于兵*
1型发作性睡病(narcol epsy t ype 1,NT1)是一种典型的中枢性睡眠疾病,以白天不可抗拒的嗜睡、猝倒、睡眠幻觉、睡眠瘫痪、夜间睡眠紊乱为主要临床特点,是一种慢性神经系统疾病[1]。NT1患者通常会出现猝倒和神经肽or exin A(hypocr et in 1)的脑脊髓液浓度急剧下降,这是由于下丘脑中产生or exin的神经元大量丢失所致[2]。
目前针对NT1的多项精神病学研究表明,这些患者具有多种认知缺陷,包括异常的情绪学习[3]、主观感知的注意力缺陷[4]、缺乏毅力[5]、激活注意和唤醒相关区域的能力不足[6]。
为了探索NT1合并认知障碍的神经机制,最近十多年内开展了多项神经影像学研究,这些研究发现NT1患者双侧海马、杏仁核[7-10]及左侧缘上回[11]存在明显异常,双侧小脑半球、双侧丘脑、胼胝体和左侧颞前内侧也存在异常[12-14]。基于脑间连通性的功能磁共振成像(f unct ional magnetic r esonance imaging,f MRI)研究表明,NT1患者的执行注意网络存在损伤[15]和异常功能连接[16-17],且存在一个能控制情感对情感挑战反应的替代神经回路[18]。NT1患者皮层神经网络参与了奖赏和情绪的处理[19],较低阈值[20]或过度激活与猝倒有关[21-22]。另有研究发现,NT1患者大脑连接性和区域拓扑结构的改变与嗜睡、抑郁和冲动行为有关[23]。但是这些研究结果不完全一致,并且评估NT1患者全脑神经网络整体拓扑特性的研究很少。另外,上述研究尤其是f MRI的研究都是在清醒状态下完成的。f MRI睡眠状态下NT1患者脑功能网络特性研究目前未见报道。
同步脑电-功能磁共振成像技术(el ect r oencephal ogr aphy-f unct ional magnet ic r esonance imaging,EEG-f MRI)提供了一种在睡眠状态下研究脑功能的无创方法[24]。EEG数据可用于睡眠分期,f MRI数据可以帮助深入了解不同睡眠阶段的神经活动[25]。
本研究的目的是采用非侵入性同步EEG-f MRI方法分析NT1患者睡眠状态下脑功能网络的网络拓扑属性的特征性变化,及其与神经行为异常的关系。
1 材料与方法
1.1 研究对象
本研究是前瞻性研究。本项研究从中国医科大学附属盛京医院睡眠中心招募了36名右利手NT1患者(男∶女=21∶15;年龄10.0 ~27.0 岁),诊断标准按照国际睡眠障碍分类-第3版(International Cl assif ication of Sl eep Disorders,3rd edit ion,ICSD-3)[26]。另外从社区招募了33名健康对照组(男∶女=19∶14;年龄11.7 ~28.6 岁)。本研究排除了19名参与者:4例NT1患者和3名志愿者退出了夜间多导睡眠图(noct ur nal pol ysomnogram,nPSG)检查;7例患者和5名志愿者未能入睡、无法进入N2期睡眠或因头部运动过大导致无法获得包含完整睡眠阶段的f MRI数据。本研究经过本单位医学伦理委员会批准(批准文号:2019PS178J),受试者均已签署知情同意书。根据赫尔辛基宣言,在研究前所有参与者均签署了知情同意书并同意参与试验。
NT1患者的入组标准如下:依据发作性睡病的国际睡眠障碍分类标准,睡眠专家根据持续3个月的白天过多睡眠和明确猝倒史的临床表现做出诊断。通过nPSG和多次睡眠潜伏期试验(mul t ipl e sl eep l at ency t est,MSLT)做出最终诊断;利用Epwor t h嗜睡评估量表(Epwor t h Sl eeping Scal e,ESS)测量发作性睡病患者和健康对照组的白天过度嗜睡程度(excessive daytime sl eepiness,EDS)严重程度。在ESS测量中,要求参与者从0~3分来描述在8种不同情况下入睡的可能性大小,若总分≥10,则诊断为白天过度困倦[26]。
NT1患者和健康志愿者的排除标准如下:其他睡眠障碍;现患有或既往患有严重的躯体或神经系统疾病;常规磁共振扫描发现脑部异常(肿瘤、出血、梗死灶);直系亲属中有严重的精神或神经系统疾病史;现患有或既往患有抑郁、焦虑、物质滥用等精神系统疾病;先天性、遗传性疾病;存在MRI检查禁忌证。
所有的受试者包括NT1患者和健康志愿者在进行MRI扫描之前均进行了全面的神经系统检查,用于排除周围神经系统疾病和中枢神经系统疾病。在开始扫描前,向每一位受试者解释该研究的全部流程、目的、临床意义及注意事项。所有参与本研究的NT1患者和健康志愿者均签署了知情同意书。
1.2 Epwor t h嗜睡评估量表
使用ESS来测量NT1组和健康对照组的日间嗜睡程度。在ESS测量中,要求参与者从0~3分描述在8种不同情况下入睡的可能性大小,若总分≥10,则诊断为白天过度困倦[26]。
1.3 夜间多导睡眠图与日间过度嗜睡的评估
在参与该研究之前,要求所有患者在一天内禁止喝咖啡或酒精饮料。在MRI检查前一天,nPSG记录在呼吸电子系列生理监护系统(Al ice 6,飞利浦,美国佛罗里达州莫里斯维尔)上。nPSG记录时间为22:00~06:00,包括脑电图、眼电图、心电图等。根据美国睡眠医学学会指南,记录标准脑电图(额区、中央区、枕区脑电图:F4/M1、C4/M1、O2/M1,备用F3/M2、C3/M2、O1/M2),下颌肌电图(3个下颌电极和右胫骨前肌中部的肌电图),眼电图(EOG位于角膜和视网膜),还有心电图。记录口腔和鼻腔气流、打鼾、胸腹呼吸、血氧饱和度和体位,以及总睡眠时间、睡眠潜伏期、睡眠效率、觉醒和呼吸事件。根据美国睡眠医学学会手册,气流减少≥90%且持续至少10 s定义为阻塞性呼吸暂停,与持续的呼吸努力有关;气流减少≥30%且持续至少10 s定义为低通气,并伴有4%或更高的氧气饱和[27]。呼吸暂停低通气指数是根据每小时睡眠经历的呼吸暂停和低通气事件总数的平均值计算的。所有患者均在nPSG监测后第二天完成临床MSLT检查。参照美国睡眠医学学会特别工作组批准的修改[28],从早晨初醒后2 h开始,每隔2 h安排小睡一次。如果患者在20 min内没有睡眠,则结束小睡试验,并记录睡眠潜伏期为20 min。如果患者在20 min内发生睡眠,则起始时间定义为从熄灯到第一个睡眠时期(包括阶段1)的时间。为了评估快速眼球运动(rapid eye-movement,REM)睡眠的存在,在入睡后继续监测≥15 min。如果REM睡眠存在,则也记录了REM的潜伏期。然后计算MSLT中5个小睡的平均睡眠潜伏期和REM睡眠潜伏期。
由一位经验丰富的技师对PSG数据和EEG数据进行分析,其不了解参与者的临床和人口学状况。随后,由一名资深医生对分析的结果进行核实。依据美国睡眠医学协会(Amer ican Academy of Sl eep Medicine,AASM)标准,对参与者的睡眠根据睡眠和相关事件的分期进行评分,比如大脑皮层的唤醒和觉醒。各睡眠阶段的总睡眠时间(t ot al sl eep t ime,TST)和百分比TST(TST%),非快速眼动(non-r apid eye movement,NREM)(包括N1~N3阶段和REM),连同觉醒指数(ar ousal index,A指数,表示观察到睡眠中断)。
1.4 北京版蒙特利尔认知评估
使用北京版蒙特利尔认知评估(The Beij ing version of the Montreal Cognitive Assessment,MoCA-BJ)评估所有被试认知功能[29]。测试包含视空间与执行能力(5分)、命名(3分)、注意力与计算力(6分)、语言(3分)、抽象能力(2分)、延迟回忆(5分)、定向力(6分)等认知领域,总分30分,耗时10 min。得分<26分被认为是认知障碍。
在MoCA-BJ测试期间,斯坦福大学嗜睡量表(St anf or d Sl eepiness Scal e,SSS)[30]用于评估嗜睡程度。在测试前后,所有参与者都填写了量表。NT1患者在测试前平均得分为1.7 (SD=0.9 ),之后平均得分为1.9 (SD=1.1 )。健康对照组的平均得分在测试阶段之前为1.1 (SD=0.5 ),在测试阶段之后为1.4 (SD=0.7 )。
1.5 EEG-MRI扫描
在多导脑电图监测后1周内采集同步EEG-f MRI数据。EEG数据采集采用EGI公司的GES300核磁兼容脑电系统,按照Hydr oCel Geodesic Sensor Net 32 v1.0 系统盐水电极记录皮层放电,采样率为250 Hz,头皮电阻均小于5 kΩ,连续记录EEG信号并进行离线处理,并同步使用心电记录仪记录心电图。使用飞利浦Phil ips Ingenia 3.0 T超导磁共振扫描仪进行MR图像采集。受试者以舒适仰卧位平躺在磁共振检查床。佩戴防噪音耳塞,并使用泡沫填充固定受试者头部以减少头动。本研究中睡眠损害的数量与以前的研究处于同一范围[31]。为排除脑内明显的器质性病变,对所有发作性睡病患者和健康对照者均先进行常规轴位T2WI扫描,以听眦线为扫描基准线,由一名有经验的放射科医师在扫描结束后现场阅片。在扫描前告知被试详细扫描时间,嘱咐其在整个扫描过程中不要抗拒睡眠,尽量保持头部静止状态。当被试发出信号表示他们不能再在扫描仪中睡觉时,终止扫描。
使用梯度回波平面回波序列采集f MRI数据,TR=20 ms,TE=30 ms,空间分辨率=3.5 mm×3.5 mm×4 mm,矩阵大小=64×64,FOV=220 mm×220 mm,翻转角=79°,敏感度编码因子=2,扫描层数=32层,间距=0 mm。采集的连续体积运行次数为1200次,并在f MRI扫描开始时应用额外的虚拟扫描(持续时间1/8 s)以稳定磁场并消除化学位移伪影。因此,每段的f MRI扫描持续时间为40 min 8 s。
1.6 EEG数据预处理与睡眠分期
使用Net St at ions 5.4 软件包,去除EEG数据中的梯度和脉冲伪影。按照AASM标准,在不重叠的情况下对预处理的EEG数据进行睡眠分期,每段连续30 s,再由经验丰富的神经生理学家将其与标准睡眠蒙太奇进行比较。
1.7 f MRI数据预处理
在MATLAB版本R2016a平台上使用SPM12软件包对f MRI数据进行预处理。首先对不同层面的f MRI数据进行时间校正。然后将图像重新对准到第一层图像以进行头动校正,并估计每个方向的头部运动参数(平移和旋转)。然后将生成的图像空间归一化到蒙特利尔坐标系统(Mont r eal Neur ol ogical Inst it ut e,MNI),重采样的体素为:3 mm×3 mm×3 mm。将高斯核的半高全宽设为6 mm,对归一化图像进行空间平滑;对空间平滑后的图像进行时间滤波(0.0 1~0.1 5 Hz)。最后,使用脑成像数据处理与分析(t he Dat a Pr ocessing and Anal ysis of Br ain Imaging,DPABI)软 件 包[32](ht t p://r f mr i.org/dpabi)回归出头部运动参数、脑室信号和脑白质信号。然后将预处理的数据划分为连续30 s的段。由同步获取的EEG数据确定每段对应的特定睡眠阶段。对于受试者的每个睡眠阶段,f MRI数据的最小可接受长度为8段(4 min)。
1.8 脑网络结构与图论分析
使用图论网络分析工具箱Gr et na进行拓扑学性质分析,以构建脑功能网络[33],根据解剖自动标记(anat omical aut omatic l abel ing,ALL)模板将整个大脑划分为90个皮质和皮质下区域[34],并提取了90个区域的平均时间序列。对所有90个区域的平均时间序列计算每对区域的皮尔逊相关系数,利用Fisher的Z变换将数据转化为认为具有正态分布的Z值。然后根据相关矩阵的选定阈值范围,构造一个正二进制向量连接较少的通用网络。转换后,将每位受试者分配给相同睡眠阶段的Z评分相关系数平均(图1)。
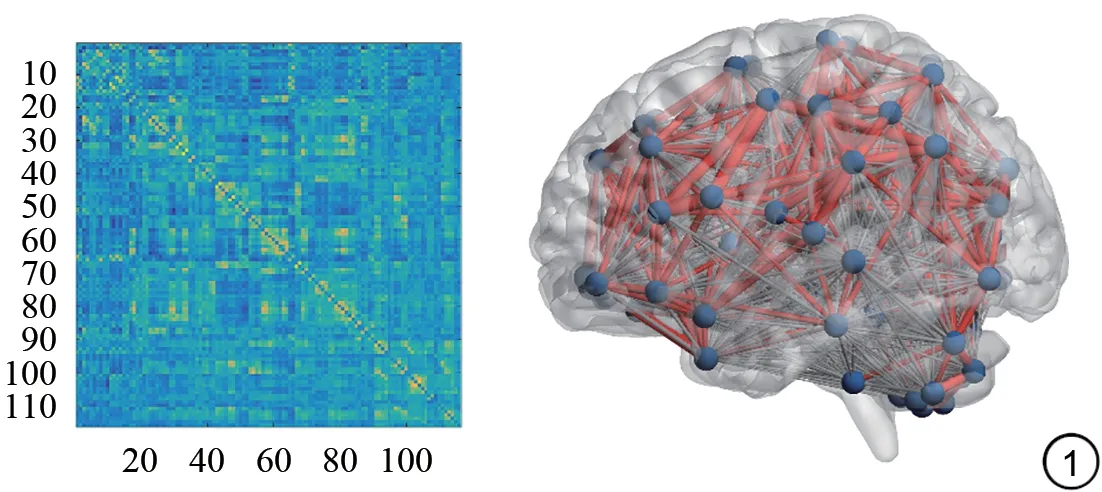
图1 参与者的脑网络构建Fig.1 Construction of brain network in the participants.
使用图论分析来评估全脑的拓扑和组织特性,分别计算全局效率(gl obal ef f iciency,Egl ob)、局部效率(l ocal ef f iciency,El oc)[35]和小世界属性[36]。稀疏度用作相关系数阈值范围的相关度量,相关系数阈值范围定义为图中可用边缘的数量除以最大可能边缘的数量。根据先前的研究[35],与具有最小数量的随机网络相比,将功能网络的稀疏性和Pear son相关阈值都设置在0.0 5~0.5 (以0.0 5步长)的范围内,以获得更有效的泛在网络。
1.9 数据分析
本研究使用IBM SPSS 17.0 版软件对常规数据、认知数据、脑功能网络数据及睡眠监测数据进行分析。使用Kol mogor ov-Smir nov检验对连续变量进行正态假设检验。首先进行描述性统计。具有正态分布的连续数据表示为均值±标准差,非正态分布的数据以四分位数区间的中位数表示。这些数据包括年龄和问卷得分,根据这些变量的正态性和同方差,在NT1患者组和健康对照组之间使用t检验或Mann WhitneyU检验进行比较。采用χ2或Fisher精确检验,比较不同群体之间的性别比例。退出的受试者的人口统计学特征与留下来的受试者的人口统计学特征也进行了比较。采用t检验或Mann-Whit neyU检验比较两组睡眠期间的PSG数据和脑功能网络的拓扑参数。采用Hol m-Bonf er r oni法对多重比较进行校正,校正后P<0.0 5表示差异有统计学意义。
Spear man的相关分析用于探讨NT1患者MoCA与脑f MRI功能网络的网络拓扑属性之间的关系。P<0.0 5为差异有统计学意义。
2 结果
本研究包含25例NT1患者和25名健康志愿者(共50名参与者)的人口统计学、PSG、MoCA-BJ量表和影像学数据。两组在年龄、性别和受教育年限上相匹配。健康对照组:年龄(22.5 ±3.8 )岁,男性15人,受教育年限(12.5 ±5.0 )年;NT1患者组:年龄(22.4 ±6.9 )岁,男性16例,受教育年限(11.9 ±4.7 )年。NT1患者组的MoCA-BJ评分(25分)显著低于对照组(30分)(P<0.0 01)。
2.1 PSG数据
与对照组相比,NT1组在TST期间N1和N2的百分比显著较高(t=8.4 79,校正后P<0.0 01;t=3.4 26,校正后P=0.0 01),而在N3期的TST%显著降低(t=4.6 55,校正后P值<0.0 01)。NT1患者的A指数明显高于对照组(t=10.6 30,校正后P<0.0 01)。但与对照组相比,NT1组的TST差异无统计学意义(P>0.0 5)(表1,图2)。
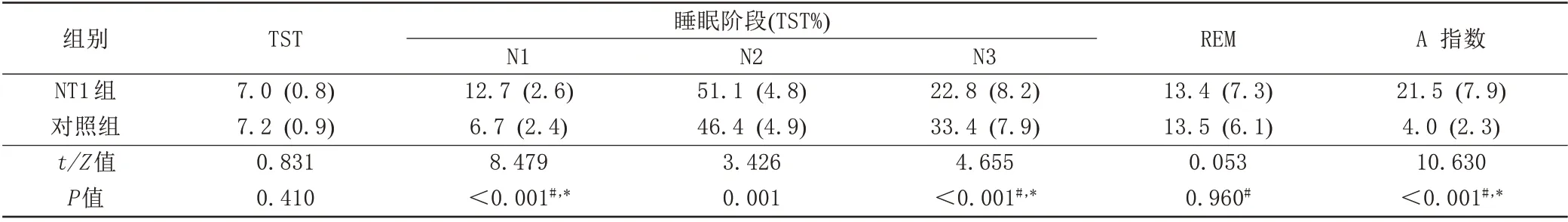
表1 NT1组和对照组夜间睡眠各参数比较Tab.1 PSGdata in NT1 participants and healthy controls
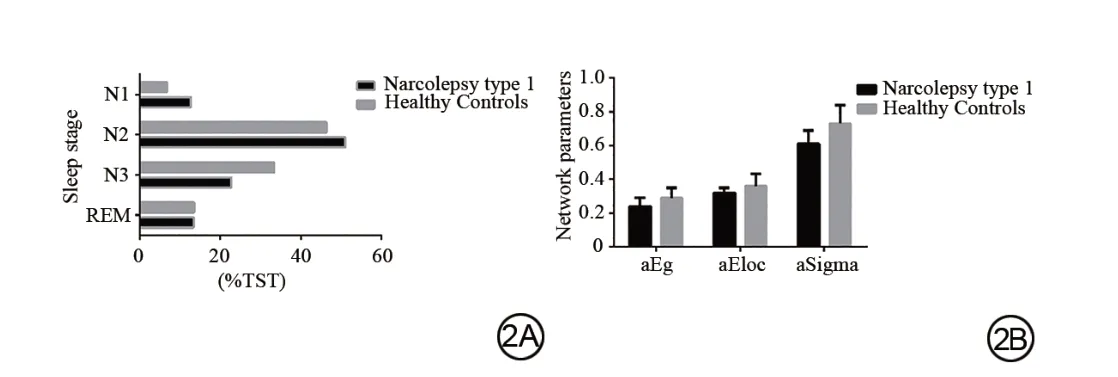
图2 组间TST%和脑拓扑参数的比较。A:与对照组相比,NT1患者在TST期间N1和N2的百分比显著较高(t=8.4 79,校正后P<0.0 01;t=3.4 26,校正后P=0.0 01),在N3期间的TST%显著降低(t=4.6 55,校正后P<0.0 01);B:与对照组相比,NT1患者的整体效率和小世界属性明显降低(Bonferroni correction,P<0.0 5)Fig.2 Comparisons of TST%and cerebral topological parameters between groups.A:Compared with the control group,patients with NT1 disorder had significantly higher percentage of N1 and N2 during TST(t=8.4 79,Pcorrected<0.0 01;t=3.4 26,Pcorrected=0.0 01)and significantly lower TST%during N3(t=4.6 55,Pcorrected<0.0 01);B:Compared with the control group,patients with NT1 disorder had significantly lower global efficiency and small-world attributes(Bonferronicorrection,P<0.0 5).
2.2 图论分析
与健康对照组相比,NT1患者的全脑全局效率以及小世界性明显降低(P<0.0 5,表2)。在N2睡眠期,NT1患者的全脑全局效率,发病时间与MoCA-BJ得分之间存在显著相关性(r=-0.5 89,P=0.0 02;r=0.6 32,P<0.0 01)(图3)。
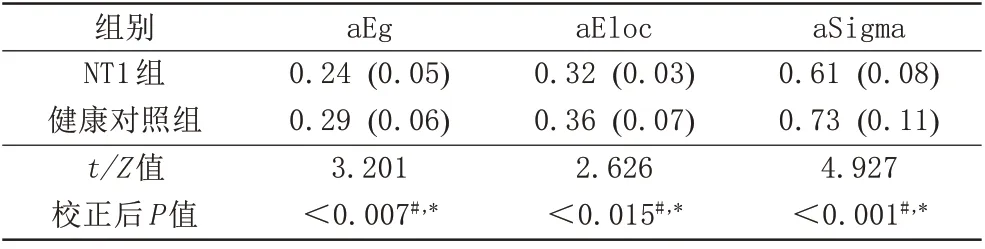
表2 NT1组和健康对照组的脑功能网络参数Tab.2 Brain functional network parameters in NT1 participants and healthy controls
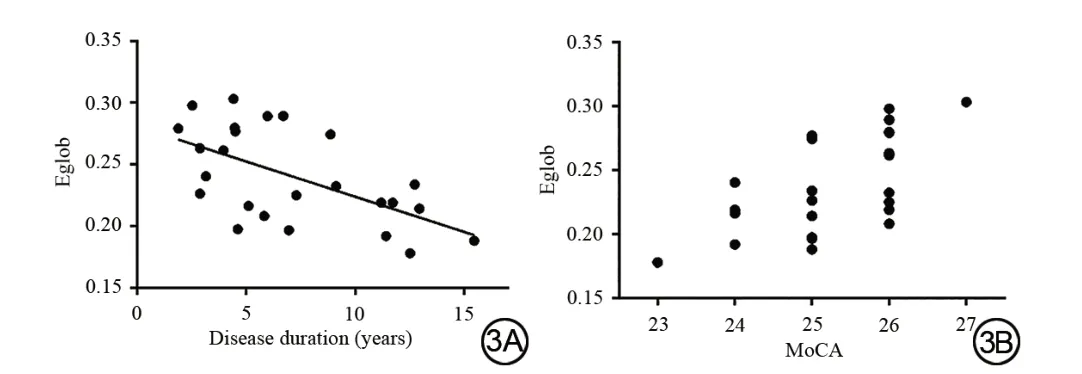
图3 NT1患者全脑功能网络全局效率,发病年限和MoCA评分之间的关系。A:NT1患者全脑功能网络全局效率与N2睡眠阶段的疾病持续时间之间存在显著相关性;B:N2睡眠期NT1患者全脑功能网络全局效率与MoCA评分之间存在显著相关性Fig.3 Relationship between the global efficiency of the whole brain functional network,and years of onset,and MoCA score in NT1 participants.A:There was a significant correlation between the global efficiency of the whole brain functional network,in patients with NT1 disorder,and disease duration in the stage N2 sleep;B:There wasa significant correlation between the global efficiency of the whole brain functional network,in patients with NT1 disorder,and MoCA score in the stage N2 sleep.
3 讨论
本研究发现在nPSG监测中,NT1患者的N1期和N2期比例较高,这与以前的研究一致[37]。由于嘈杂的环境,参与者难以在MRI扫描过程中到达N3期,并且本研究只有f MRI扫描的N2期数据能够分析,因此本研究仅分析了N2睡眠期的f MRI数据。
3.1 研究发现
本研究发现,NT1患者在N2期睡眠期间全脑全局效率以及小世界性低于正常对照组。数据表明,全局效率与发作时间呈正比,并与认知障碍的严重程度相关。由于脑功能网络的整体效率主要受网络内长距离连接的影响,因此笔者推测,睡眠期间脑网络的拓扑效率降低可能主要是由于长距离功能连接异常所致。这些脑网络拓扑效率的异常可能与先前在静息状态研究中发现的几个脑网络之间的连接异常有关,包括执行网络和显著性网络的连通性改变[16]、默认模式网络的破坏[38]、视觉网络的功能连通性增加以及显著性网络和默认模式网络的重构[23]。之前的研究发现,大脑在静息态下感觉运动网络,包括体动网络、视觉网络、听觉网络以及协会网络,包括默认模式网络、背部注意网络、腹部注意网络、语言网络、额顶网络、硬脑膜网络、显著网络、顶叶记忆网络、内侧颞叶网络、顶枕网络始终表现出恒定的神经功能活动[39]。因此,NT1患者的睡眠状态下脑功能网络的低效率很可能导致睡眠状态下信息处理能力的下降,进而扩展到清醒状态,导致认知障碍。
本研究发现,NT1患者在N2期睡眠状态下全脑功能网络低效,而且这种低效与发病时间的长度呈正比,与认知功能障碍的严重程度相关,这可能是由疾病的进展或疾病造成的睡眠异常而引起的。考虑到大脑在睡眠状态下依然有恒定的神经活动,所以NT1患者睡眠状态下脑功能网络的低效很可能导致睡眠状态下信息处理能力的下降,进而延续到清醒态,导致认知功能障碍。
3.2 局限性
尽管本研究提供了睡眠期间NT1患者脑功能网络异常的初步证据,但该研究仍存在一些局限性。(1)NT1疾病患者的数量有限,结果的可靠性有待加强。(2)患者的年龄分布较大,结果的代表性有待提高。(3)本研究仅分析了N2睡眠阶段的f MRI数据。
综上所述,本研究发现NT1患者在N2睡眠期全脑功能网络效率降低,而这种全脑功能网络效率降低可能与他们的认知障碍有关。
作者利益冲突声明:全体作者均声明无利益冲突。

