太湖生态保护引领区水体有机氯农药分布特征及生态风险评价*
陈 燕 任晓鸣# 邱 阳 王 菲 程加德 汪玲玲
(1.江苏省环境科学研究院,江苏 南京 210036;2.江苏省环境工程重点实验室,江苏 南京 210019)
有机氯农药(OCPs)是环境中广泛存在的一类有机污染物,其化学性质稳定,难降解,具有长期残留性,可富集在水体及底泥等环境介质中长达数年[1-2]。农药的大量使用虽然在保护农作物生长、控制病虫害方面成效显著,但也诱发了一系列环境问题,对生态环境及人体健康构成了严重威胁[3-5]。自1983年起,中国已明令禁止六六六类(HCHs)及滴滴涕类(DDTs)等部分OCPs的使用,但因其具有长期残留性、高毒性且易于生物蓄积和长距离迁移等特性,迄今为止在各种环境介质中检出率仍然较高,依旧是国内外广泛关注的环境研究热点问题之一[6-9]。
太湖是江苏省水环境治理的重点流域之一,常州市武进区和无锡市宜兴市地处太湖上游区域,其水环境质量对太湖具有重要影响。为大力推进生态环境保护工作,2017年,江苏省委省政府提出要在武进区、宜兴市建立生态保护引领区。生态保护引领区内汇集了大量的电镀、化工、印染、涂料等生产企业,涵盖了养殖、航运及旅游等众多功能区,加上农业生产活动的影响及农业面源的污染,区内OCPs污染对周边生态环境健康所造成的威胁不容忽视。近年来,中国对太湖流域内OCPs污染分布及风险特征已有部分研究[10-11]。计勇等[12]发现太湖北部湾沉积物中主要的OCPs污染物为HCHs及DDTs,且浓度水平存在季节差异性。蒋豫等[13]研究发现太湖流域沉积物中γ-六六六(HCH)、DDTs具有较大的潜在生物毒性。曾祥英等[14]对太湖西部入湖口沉积物中OCPs的溯源分析结果表明,HCHs及DDTs的来源主要为历史输入。然而,目前关于太湖流域OCPs的研究主要集中在单一环境介质中OCPs的残留水平,而关于流域内地表水和表层沉积物的综合评估和分析较少,更未见生态保护引领区内OCPs污染分布和风险特征的报道。因此,本研究以在中国使用时间最长、最广泛的OCPs(HCHs和DDTs)为研究对象,分析生态保护引领区内18个采样点的地表水及表层沉积物样品中HCHs和DDTs的残留水平和空间分布,并对其进行生态风险表征。最后结合流域及周边OCPs的历史使用情况,揭示地表水及表层沉积物中HCHS和DDTS的污染来源,以期为生态保护引领区内流域水体中OCPs的污染控制和风险管理提供科学依据和支撑。
1 材料与方法
1.1 样品采集
基于前期对研究区域的调研和考察,在宜兴市及武进区境内太湖水系上下游共布设18个采样点,主要包括工业区、市区、入湖口及饮用水源地,于2019年5月开展了地表水及表层沉积物的采样工作,具体采样点布设见图1。
使用采水器采集上述采样点的表层水样(样品采集深度为水下0.5 m,不足0.5 m时为水深的1/2),并测定水温、pH等基本参数,同时在相应采样点使用采泥器采集表层沉积物(样品采集深度为0~15 cm)。采集的水样和沉积物立即冷藏,采样结束后,迅速运回实验室置于冰箱中避光保存,并在一周内完成样品前处理工作。

注:U1~U8为上游采样点;D1~D8为下游采样点;Y1、Y2为饮用水源地采样点。图1 采样点分布Fig.1 Distribution of sampling sites
1.2 样品预处理
量取500 mL水样于1 L分液漏斗中,加入15 g NaCl混匀,再加入50 mL正己烷溶液,振荡10 min,静置分层后,弃去水层,取有机相于收集瓶中。重复上述操作,共收集100 mL有机相,经无水硫酸钠干燥脱水,氮吹浓缩至2~3 mL。用8 mL正己烷浸润Florisil柱,在液面消失前将萃取液转移至小柱上,用3 mL丙酮和正己烷(体积比为1∶9)淋洗3次,收集所有洗脱液并氮吹浓缩至1 mL,待上机测定。
沉积物经冷冻干燥后,利用加压流体萃取仪(DIONEX ASE 350)进行处理。称取10 g沉积物样品,与适量硅藻土充分混合研磨并放入34 mL萃取池中提取净化。收集萃取液经无水硫酸钠干燥并氮吹浓缩至2~3 mL,浓缩液经Florisil柱净化。用8 mL正己烷浸润Florisil柱,在液面消失前将萃取液转移至小柱上,用3 mL丙酮和正己烷(体积比为1∶9)淋洗3次,收集所有洗脱液并氮吹浓缩至1 mL,待上机测定。
1.3 样品分析测定
使用气相色谱仪(Agilent 7890B)进行OCPs的测定。色谱柱为HP-5(30 m×0.32 mm×0.25 μm);进样口温度为200 ℃;载气为高纯氮气,2.0 mL/min,恒流;柱温升温程序为起始温度175 ℃,保持14 min, 15 ℃/min升温至240 ℃,保持13 min;电子俘获检测器(ECD)温度250 ℃;尾吹气为高纯氮气,60 mL/min;进样量1 μL。
1.4 质量控制与保证
通过样品平行样、方法空白以及添加回收率指示物进行质量保证与质量控制。平行样品相对标准偏差<10%,空白实验中未检出目标污染物OCPs。地表水中OCPs测定方法检出限为0.15~1.85 ng/L;表层沉积物中OCPs测定方法检出限为0.01~0.56 ng/L。在样品测定时,通过添加已知浓度的OCPs标准品进行回收率验证,地表水及表层沉积物样品中OCPs的回收率分别为80%~105%和73%~104%。
1.5 生态风险评价方法
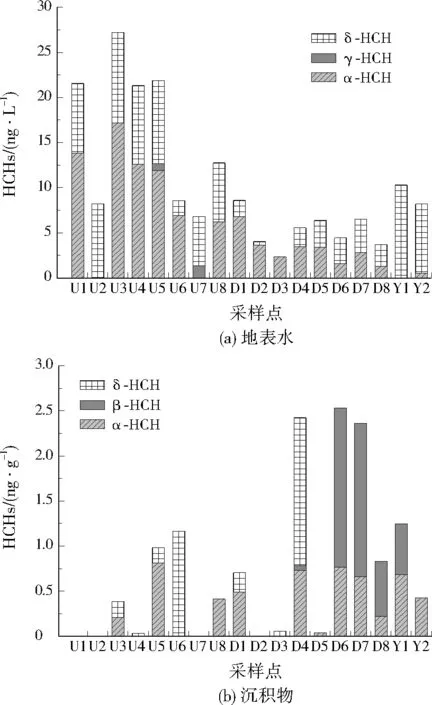
风险商值(RQ)法是目前使用最广泛的水体生态风险评价方法[15],用以表征水体有毒有害污染物的潜在生态危害。RQ为环境暴露浓度(MEC)与预测无影响浓度(PNEC)的比值,RQ≥1.0表示高风险,表明污染物存在严重的潜在生态风险危害,需采取相应的生态风险削减措施;0.1 表1 OCPs的PNECTable 1 PNEC of the OCPs μg/L 沉积物质量基准(SQG)法亦称为生态效应区间值法,多用于评估水体沉积物中有机污染物的生态风险。沉积物的生态风险水平一般用表征污染物潜在生态风险的效应区间低值(ERL)和效应区间中值(ERM)来衡量。当污染物浓度 表2 OCPs的ERL和ERMTable 2 ERL and ERM of the OCPs ng/g 生态保护引领区内地表水及表层沉积物中OCPs的分布见图2,其中∑OCPs为总OCPs。水体中主要检出的OCPs为HCHs和DDTs,其质量浓度分别为2.33~27.22、19.70~139.02 ng/L,均值分别为10.50、77.30 ng/L,DDTs浓度远高于HCHs。∑OCPs质量浓度为22.03~166.24 ng/L,均值为87.80 ng/L。沉积物中HCHs检出率约为78%、DDTs检出率约为89%,HCHs和DDTs的质量浓度分别为ND(未检出)~2.53、ND~18.43 ng/g,均值分别为0.76、7.66 ng/g,∑OCPs为ND~20.85 ng/g,均值为8.41 ng/g。与地表水类似,DDTs在OCPs中的占比高于HCHs,是主要的OCPs污染物。地表水中OCPs的残留水平呈现明显的空间分布特征,整体表现为工业区高于市区、上游高于下游。上游采样点涵盖3个污水处理厂(U1、U4及U8附近),周边工业企业集中,其地表水中OCPs浓度较高。表层沉积物中OCPs的检出浓度较低,区域间浓度差异较小,河流交界处(D6和D7)及入湖口(U3、D3、D4和D8)表层沉积物中OCPs略高于其他地区。 图2 地表水及表层沉积物中OCPs的分布Fig.2 Distribution of OCPs in surface water and sediments 国内外不同地表水及表层沉积物中OCPs的比较结果见表3。本研究区域地表水中HCHs浓度低于国内外大多数水体,明显高于西班牙阿利坎特湾。本研究地表水中DDTs浓度处于中等偏高水平,高于国内外大部分水体,仅低于印度艾哈迈达巴德湖及国内闽江口,与国内微山湖中DDTs的浓度相当。相较于前人在太湖流域的研究结果,本研究地表水中HCHs浓度略高,而DDTs浓度略低。 表3 国内外地表水及表层沉积物中HCHs 和DDTs对比Table 3 Comparison of HCHs and DDTs in surface water and sediments at home and abroad 与国内外其他不同水体沉积物中OCPs相比较发现,除中国渤海湾外,本研究中生态保护引领区内表层沉积物中HCHs浓度低于国内外大多数水体的浓度。其DDTs浓度也处于中等偏下水平,低于巴基斯坦奇纳布河、韩国海岸等国外水体以及中国柘林湾和洞庭湖,略高于巴基斯坦卡拉奇沿海区域、埃及卡伦湖、中国渤海湾,与中国大连湾表层沉积物中DDTs的浓度相当。与他人在太湖流域的研究结果相比,本研究中沉积物DDTs浓度整体偏低。 一般水环境中HCHs的来源主要有两种:一种是工业品HCHs,包括4种同分异构体,其占比分别为α-HCH(60%(质量分数,下同)~70%)、β-HCH(5%~12%)、γ-HCH(10%~12%)及δ-HCH(6%~10%);另一种为农业用林丹,主要由γ-HCH组成(>99%)[36]669。由图3可知,本研究区域内地表水及表层沉积物中α-HCH检出率最高,在绝大多数采样点均有检出,δ-HCH次之,β-HCH仅在沉积物的部分采样点有检出,而地表水和沉积物中均鲜有γ-HCH检出。γ-HCH的检出率低归因于近年来林丹的限制使用,太湖流域农业林丹农药源的输入较少,而α-HCH的高检出率也间接反映了区域内HCHs类农药多源于工业输入。地表水及表层沉积物中δ-HCH的浓度及检出率相对较高,这与彭诗云等[37]的研究结果具有一定的相似性。另外,由图3(b)可以发现,在下游城区(D6、D7和D8)和饮用水源地(Y1)沉积物中发现β-HCH检出浓度较高,β-HCH的环境稳定性较高,水溶性和挥发性较低[38],这些采样点β-HCH的高值可能是其早期存在于水底沉积物中的HCHs发生不同程度降解形成稳定的β-HCH所致。 图3 地表水和表层沉积物中HCHs组成特征Fig.3 Composition characteristics of HCHs in surface water and sediments DDTs主要是由p,p’-DDT、o,p’-DDT、p,p’-DDE、p,p’-DDD及少量未知化合物(<0.5%)组成,其中p,p’-DDT是DDTs的重要组成部分,约占75%[39]。有研究表明,水环境中的DDE是由DDT在好氧条件下氧化生成,而DDD则是由DDT在厌氧条件还原而成[40]。因此,研究者常用DDD/DDE与(DDD+DDE)/DDT来示踪环境中DDT的代谢转化及降解程度,并根据比值进一步判定研究区域内是否有新的DDT的输入。若(DDD+DDE)/DDT<1.0,表明该区域内有新的DDTs农药源的输入;若(DDD+DDE)/DDT>1.0,表示该区域无新的DDTs农药源输入,即DDTs多为历史残留[41]。由图4可知,太湖流域地表水中(DDD+DDE)/DDT为0~7.8,均值为4.9,表明水体中基本无新的DDTs农药源输入,DDTs的检出多为历史残留。生态保护引领区内入湖船只较多,船舶停靠及往来频繁,用作船舶防污漆的DDTs大量释放[42],虽然近年来DDTs船舶防污漆在逐渐被限制使用和替代,但其历史残留引起的DDTs高值还是应予以高度关注。而沉积物中,因DDD及DDE检出较少,难以进行溯源,本研究不再赘述。此外,由图4可以看出,绝大多数采样点DDD/DDE>1.0,表明水体中DDTs类农药以厌氧代谢为主[36]670。 图4 地表水中DDTs异构体比值Fig.4 DDTs isomer ratio in surface water 2.3.1 地表水中OCPs生态风险评价 生态保护引领区地表水中OCPs的生态风险评价结果见图5。水体中检出的7种OCPs,生态风险体现为p,p’-DDD>δ-HCH>o,p’-DDT>p,p’-DDT>α-HCH>p,p’-DDE>γ-HCH。上游部分采样点(U1~U5)及饮用水源地(Y1和Y2)中的p,p’-DDD存在高风险,潜在生态危害程度严重,应予以高度关注。所有采样点中检出的γ-HCH、α-HCH与p,p’-DDE的RQ均小于0.1,生态风险较小。 图5 地表水中OCPs的生态风险评价Fig.5 Ecological risk assessment of OCPs in surface water 2.3.2 沉积物中OCPs生态风险评价 河流湖泊中沉积物组成复杂,大多数研究是基于SOG法来科学系统地评价沉积物中OCPs的生态风险。本研究针对生态保护引领区沉积物中OCPs的生态风险进行评价,结果见表4。17个采样点中的p,p’-DDE低于ERL,仅有1个采样点超过了ERL,但低于ERM,表明研究区域内表层沉积物中p,p’-DDE的生态风险较低,对环境生物的毒副作用较小。p,p’-DDD的生态风险略高于p,p’-DDE,14个采样点沉积物中的p,p’-DDD低于ERL,4个采样点的p,p’-DDD介于ERL、ERM之间,但远低于ERM,表明偶尔会产生负面生物效应。相比于p,p’-DDD和p,p’-DDE,DDT整体呈现较高的生态风险效应,大部分采样点DDT处于ERL、ERM之间,河流交界处(D6)与入湖口(D4及D8)沉积物中p,p’-DDT浓度甚至超过了ERM,表明其风险较大,可能会对生态系统产生严重威胁,应重点关注。 表4 沉积物中OCPs的生态风险评价Table 4 Ecological risk assessment of OCPs in sediments (1) 生态保护引领区地表水和沉积物中∑OCPs分别为22.03~166.24 ng/L、ND~20.85 ng/g,DDTs为主要的OCPs污染物。与国内外其他地表水OCPs含量对比,生态保护引领区OCPs处于中等偏低水平。 (2) 生态保护引领区地表水中OCPs呈现明显的空间分布特征,受工业布局及历史残留影响,整体表现为上游高于下游、工业区高于市区。沉积物中农药的检出浓度较低,区域间浓度差异较小。 (3) 源解析结果表明,研究区域内HCHs以工业源输入为主,而DDTs主要为历史残留,且在水环境中以厌氧代谢为主。 (4) 生态保护引领区上游工业区及入湖口地表水和沉积物中p,p’-DDD、δ-HCH、o,p’-DDT及p,p’-DDT具有中等以上的潜在生态风险,国家已对该类农药施行限制使用等管控措施,后续需加强该区域工业及农业等相关污染源的防治工作。

2 结果与讨论
2.1 生态保护引领区OCPs的浓度及分布特征


2.2 生态保护引领区OCPs的组分特征及来源解析

2.3 生态保护引领区OCPs生态风险评价


3 结 语

