体素内不相干运动成像及微血管密度与宫颈癌病理分级的相关性研究
冉仪婷,卑贵光
作者单位:1.中国医科大学中国人民解放军北部战区总医院放射诊断科,沈阳,110812;2.电子科技大学医学院附属妇女儿童医院 成都市妇女儿童中心医院放射科,成都 610091;3.中国人民解放军北部战区总医院放射诊断科,沈阳 110812
宫颈癌是女性生殖系统中常见的恶性肿瘤,近年来,发生率日益攀升,现已位于女性中所有恶性肿瘤中诊断率及死亡率第四位[1]。宫颈癌的病理分级对治疗方案及预后有提示作用。磁共振扩散加权成像(diffusion-weighted imaging,DWI)作为一种具有无创优势的功能成像技术,尤其是DWI衍生技术体素内不相干运动成像(intravoxel incoherent motion,IVIM)依靠双指数模型技术能将组织内的扩散运动及灌注运动区分开,从而更加准确地反映肿瘤微环境状态的改变。现今,有研究证明IVIM 各参数在评价宫颈癌分化程度、病理类型方面也表现出差异及可鉴别性[2-4],但各IVIM参数与宫颈癌病理分化程度间的关系说法尚不一致。宫颈癌的病理级别影响临床的治疗方案,笔者探讨IVIM 各参数与宫颈癌病理级别的相关性,可以为临床诊疗提供参考。
微血管密度(microvesssel density,MVD)可以反映肿瘤组织内血管分布,是肿瘤生长、发展的基础,且与肿瘤生物学特征有一定相关性,能够提供肿瘤的血供特点和细胞活性信息,从而判断肿瘤的进展情况。肿瘤的分化程度降低,恶性程度明显增大,浸润能力也会进一步增强。大量研究证实肿瘤微血管的增多及血管内各血管生成因子的增加,有利于肿瘤细胞的增殖加速,肿瘤更容易发生浸润及转移。目前,在泌尿系肿瘤及脑胶质瘤等研究中表明[5-7],血管生成与肿瘤的分级明显相关,MVD随肿瘤分化级别的增高也明显增加。因此,通过评估MVD可以预测宫颈癌的病理分化程度,本研究将进一步论证,MVD反映的肿瘤灌注方面的信息,以及MVD与IVIM参数之间的联系。
1 材料与方法
1.1 研究对象
回顾性研究中国医科大学北部战区总医院2016年6月至2019 年7 月收治的26 例宫颈癌患者,年龄37~70 (52.9±7.93)岁;低分化患者8 例,高分化患者本6 例,中等分化患者12例;纳入标准:(1)进行手术并经病理证实分化程度;(2)在我院存档手术蜡块;(3)临床分期>IA1 期;(4)影像科数据站存有手术前多b 值序列数据的患者。排除标准:(1)磁共振检查前接受过放化疗;(2)图像质量欠佳。本研究经过中国人民解放军北部战区总医院医学伦理委员会批准(批准文号:BL201713),免除受试者知情同意。
1.2 仪器与检查方法
MRI检查采用GE Discovery MR750 3.0 T磁共振机进行常规扫描,所有患者取仰卧位,腹部8通道相控线圈。扫描参数:(1)横断面T2WI:fs-FRFSE,TR 3896 ms,TE 71.7 ms,视野(FOV)300 mm×225 mm;(2)矢状面T2WI:fs-FSE,TR 3516 ms,TE 69 ms,FOV 215 mm×270 mm;(3)横断面T1WI:FSE,TR 637 ms,TE 9.1 ms,FOV 280 mm×210 mm;(4)冠状面T2WI:WATER IDEAL,TR 1997 ms,TE 68.6 ms,FOV 280 mm×210 mm,以上序列层厚5 mm,层间距6 mm;(5)矢状面IVIM DWI 技术扫描:频率FOV 28,相位FOV 0.35~0.50,减小矩阵,改变频率编码方向,1 次扫描11 个b 值(0、30、50、100、150、200、300、500、800、1200、1500 s/mm2)。病理分级由2名高级别病理医生阅片,评估宫颈癌病灶分化程度,根据宫颈癌的组织学分级Borders修订版分级法,分级系统由细胞异型性、核分裂和角化珠的数量组成,分为低度恶性的高分化宫颈癌、中度恶性的中分化宫颈癌、高度恶性的低分化宫颈癌;病理学免疫染色取术后病变组织,采用甲醛固定,石蜡包埋,行病理切片。用CD34 染色剂染色,采用SP法测定MVD,试剂盒由北京中杉生物技术有限公司生产。
1.3 图像分析
IVIM 图像应用GE AW4.5 Functool MADC 软件,利用工作站软件测量感兴趣区ADC 值,感兴趣区为类圆形,取宫颈癌组织最大截面处,在病灶边缘勾画ROI 值,应避免囊变、出血、坏死区,部分较大病灶多点测量,通过双指数模型取得IVIM 各参数:慢速表观扩散系数(D)、快速表观扩散系数(D*),以及灌注分数(f)。病理图像:于光镜低倍镜(×20)物镜下选择肿瘤组织内MVD 密集处,再于高倍物镜(×40)下对MVD 进行测定,具体方法按照Weidner 等[8]的方法。每个标本计数5 个视野,取其平均数,MVD值=(n1+n2+n3+n4+n5)/5。由2名同级别医生分别对病灶进行二次勾画,并对各参数结果进行组间一致性差异检验,检查结果ICC在0.87~0.96。
1.4 统计学分析
使用SPSS 25.0统计学软件包,采用Kolmogorov-Smirnov检验判断不同分化程度患者的IVIM各参数值是否符合正态分布,若符合,采用ANOVA检验对比各组均值;若不符合正态分布,则采用非参数检验Kruskal-WallisH检验;P<0.05 表示差异有统计学意义;不同分化组中IVIM各参数与MVD之间的相关性采用Pearson相关性分析。
2 结果
2.1 子宫颈癌不同病理分级MRI参数比较
分析宫颈癌不同病理分级组(高分化:G1;中分化:G2;低分化:G3)与IVIM各参数(D、D*及f值)结果如表1、2及图1~3所示。非参数秩和完全随机设计多个样本比较的Kruskal-WallisH检验结果(表1)示D值、D*值在三组间差异有统计学意义,f值三组间差异无统计学意义;D值随分化级别增高数值减低(即低分化组D值中位数值最低);D*值中位数随分化级别增高数值逐渐减低。两两组间比较(表2)示D值在三组组间比较差异均有统计学意义,低分化组D*值低于高分化、中分化组,D*值在低分化与高分化组、低分化与中分化组组间比较差异有统计学意义,高分化组与中分化组组间比较差异无统计学意义。
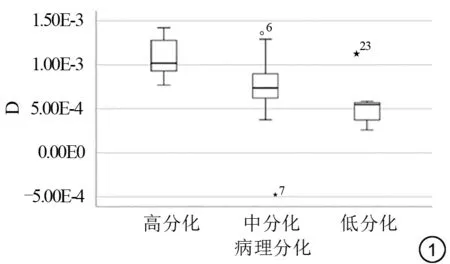
图1 宫颈癌IVIM D 值在各分化组中分布箱式图
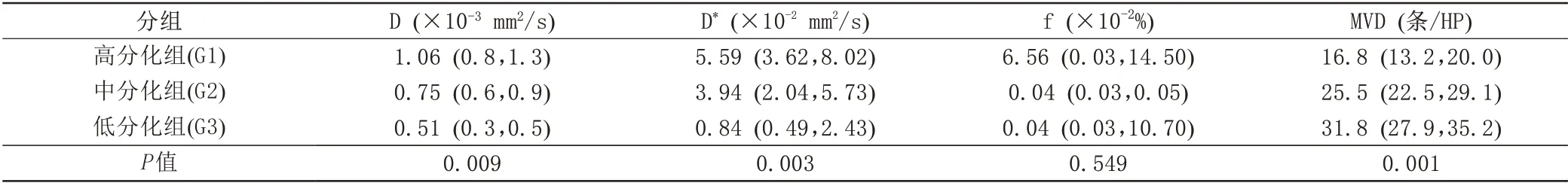
表1 宫颈癌不同病理分级与IVIM各参数比较
2.2 宫颈癌各分化组之间微血管密度比较
分析宫颈癌不同分化组(G1、G2、G3)与MVD 结果如表2 和图4所示,MVD在不同分化组组间比较,差异皆具有统计学意义。
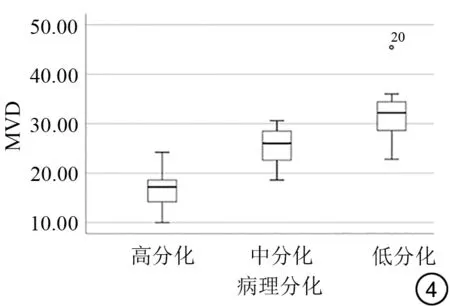
图4 比较宫颈癌各分化组MVD 分布箱式图

表2 三组组间两两比较各IVIM各参数及微血管密度
2.3 IVIM各参数及MVD之间及与病理分级的相关性分析
经一元线性回归方程检验,IVIM 各参数与MVD 进行相关分析,D*值与MVD 相关性有统计学意义,P<0.05;再由方差分析对包含常数项的回归方程做显著性检验,F=10.6,P<0.05,差异有统计学意义,回归方程有意义(图5)。直线方程为y (D*)=0.092-0.002×MVD,决定系数r2=-0.554。D*值与MVD成中度负相关(r2为0.41~0.70 表示中度相关)。其他IVIM参数(D 值、f)与MVD 相关性分析不具有统计学意义。G1、G2 及G3 各组中示例的IVIM 各参数(D、D*及f 值)、MVD 值如图6~8所示。
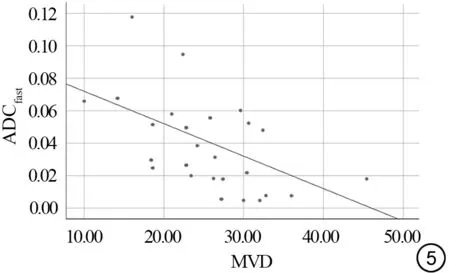
图5 宫颈癌IVIM D* (ADCfast)值与MVD 的Pearson相关分析

图6 女,70岁,高分化宫颈癌。A:DWI与肿瘤的双指数分析,在肿瘤边缘绘制ROI;B:在D参数图上,D值为2.17×10-3 s/mm2;C:在D*参数图上,D值是2.3×10-2 s/mm2;D:肿瘤标本的CD34染色(×400)显示约17个不成熟的肿瘤微血管 图7 女,59岁,中分化宫颈癌。A:肿瘤双指数分析的DWI图像;B:在D 参数图上,D 值为0.82×10-3 s/mm2;C:在D*参数图上,D*值为0.91×10-2 s/mm2;D:肿瘤标本的CD34 染色(×400)显示约27 个未成熟的肿瘤微血管 图8 女,57 岁,低分化宫颈癌。A:肿瘤双指数分析的DWI;B:在D 参数图上,D 值为0.12×10-3 s/mm2;C:在D*参数图上,D*值为0.62×10-2 s/mm2;D:肿瘤标本的CD34染色(×400)显示约31个不成熟的肿瘤微血管
3 讨论
3.1 IVIM各参数的基本原理、与病理分级的相关性探讨
目前妇科病理学者主要依据细胞形态将其分为G1、G2、G3级,G1级即高分化型,核分裂不多,恶性程度低;G2、G3级分别称中、低分化型,核分裂和细胞异型明显,恶性程度高。中高分化肿瘤的预后优于低分化肿瘤,但目前病理分级依靠活检,属于有创检查。因此磁共振成像作为无创检查,判断宫颈癌病理分级至关重要。常规磁共振技术尚不能满足肿瘤病理分化分类的需要,IVIM作为新发展领域,有望解决术前肿瘤病理分级难题。IVIM 作为DWI 技术的延伸,通过水分子的微观运动及局部的灌注改变来评估肿瘤组织的扩散和灌注特点,可定量测定解析多个模型参数值,真扩散系数D 值,理论上能去除微循环快速血流影响,更准确地反映水分子扩散。D*代表与血流灌注相关的快扩散系数,f 代表灌注分数,可探测到的水占毛细血管网的体积比[9]。
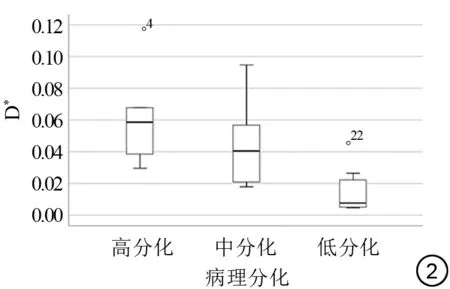
图2 宫颈癌IVIM D*值在各分化组中分布箱式图
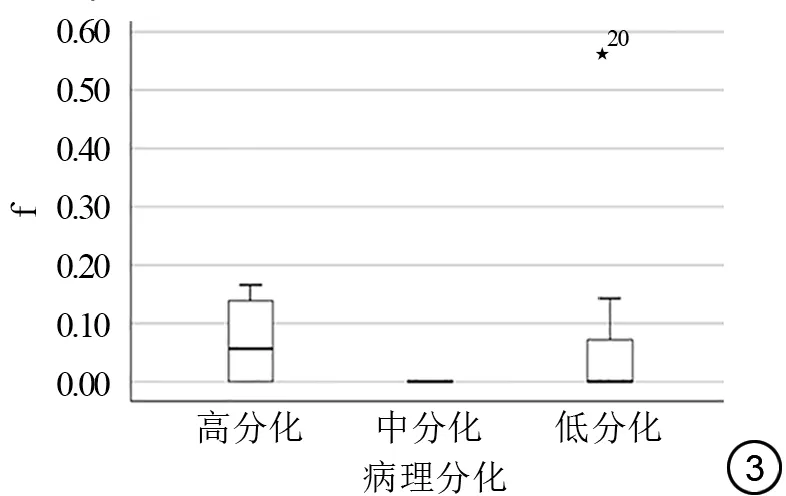
图3 宫颈癌IVIM f 值在各分化组中对比箱式图
有研究表明,IVIM 参数与各种肿瘤的病理分级相关[10]。其中,D*值表示除细胞间水分子运动以外的灌注信息,即病灶内血管灌注占较大灌注比例,同时还包括其他脉管系统的灌注情况(例如乳腺导管、唾液腺及胰管等)[11]。本实验结果表明,D*值随肿瘤分级的增高而降低,从病理学角度讲,随肿瘤的分级增高,恶性程度增高,血流灌注也会相应增高[12],这与本实验结果相反。目前,部分研究中关于D*值与病理分级之间的关系的结论也存在分歧,相世峰等[3]和Zhou等[4]研究结果显示D*值与病理分级之间的差异不具有统计学意义,Du 等[13]研究表明D*值随肿瘤分级增加而增高。Federau 等[14]在脑胶质瘤IVIM灌注参数值的研究中显示D*值与胶质瘤的病理分级无意义,这可能与肿瘤内大量新生血管生成,微血管网络结构改变有关系,此学者亦指出灌注参数(D*值、f值)与多种因素相关,例如血流压力、血流速度等。李乃玉等[15]提出,D*值随病理分级增加逐渐减小,可能是由于低分化病灶中微血管存在癌栓,本研究中低分化患者的病理结果亦表明大多数病灶中微血管存在癌栓,也支持这种观点。当然,这种理论目前需要大量研究继续探究验证。
D值反映细胞内外水分子的扩散,在不同分级的宫颈癌病理表现中,分级增高,分化程度越低,细胞核分化不成熟,核浆比增大,低分化型(G3 级)细胞异形性明显,体积增大,因此在显微镜下细胞显示密集,细胞外间隙减少。真扩散系数D 值反映细胞外水分子的运动,其主要影响因素是细胞外间隙及细胞内水分子扩散,分化级别越高,细胞外间隙越小,细胞外水分子活动受限明显,表现为D 值随分级增加而减低。本研究中D 值随病理分级增高而减低,各病理分化组中统计学结果均有意义,提示D 值在不同分化程度的宫颈癌中水分子扩散运动有明显差异。研究结果与大多数研究一致[3,15]。此外,将D值与MVD之间的关系进行分析,结果显示两者无直线相关性,提示IVIM技术中的D值能准确反映微观扩散运动,而不受局部灌注的影响。
灌注分数f 在区分宫颈癌病理分级方面存在争议,相世峰等[3]研究结果示f 值在不同宫颈癌病理分级之间的差异无统计学意义;部分学者研究结果则相反[15]。在本研究中,f 值与病理分级之间的差异无统计学意义。且与MVD 值不具有直线相关性。导致研究结果的不一致可能来源于灌注分数容易受到多种因素的影响,例如微血管网的数目、血流速度、血管壁压力或者IVIM 设定的b 值的不同[11,14]。因此,IVIM 中的灌注分数f在对宫颈癌病理分级的预测方面需要进一步论证。
3.2 微血管生成原理、与病理分级相关性
血管生成(angiogenesis)是指某些情况下,由于血管生成因子的作用,新生毛细血管从已有的血管中生长的过程,是许多实体肿瘤生长和转移的关键[16]。CD34 作为血管标记物,能标记大部分有明显血管管腔的血管内皮,通过抗体与相应内皮细胞结合,可以直接反映微血管的生成状况,具有肿瘤血管检测的重要意义[17]。目前,已有一些研究表明,MVD 与肿瘤的分级、预后有关系(肝癌、肠癌等)[18-20],并随肿瘤级别增高,微血管密度值逐渐增多。Liu 等[21]和冯仙明等[22]学者研究表明,用CD34染色的宫颈癌中,病理分级越高,MVD值也增高,两者成明显线性正相关,本研究结果与其一致。
3.3 微血管密度与快速表观扩散系数(D*)的相关性
如上文所述,IVIM 中能代表血流灌注的参数有D*及f 值,假设D*值能够代表肿瘤内的灌注信息,也就能反映肿瘤内MVD,那么,IVIM 参数D*值就有潜力成为评价肿瘤血管生成方面一个便捷有力的工具。目前,关于IVIM 中代表灌注的参数与肿瘤内MVD 的关系研究较少。Liu 等[21]在宫颈癌病理分级与磁共振扩散成像的ADC 差值相关联系的研究中提出,宫颈癌的病理分级与ADC差值显著相关。ADC差值指的是在多b值条件下,高b值(0~3000 s/mm2)与低b值(0~100 s/mm2)间ADC值的差值,在活体组织中,ADC 最大值来源于肿瘤内的微血管网的流动,与IVIM中的D*值意义相似,该研究证实了ADC差值与MVD 显著相关,与宫颈癌中的病理分级显著相关。Lee 等[23]在直肠癌的一项研究结果显示,多b 值双指数模型能够将扩散、灌注信息区分开,IVIM 灌注参数与MVD 明显相关,这与本研究结果一致。另外,在本研究中,D*值四分位分布区间较大,波动较大,其原因可能与肿瘤内微血管密集区分布变化大有关。在显微镜下,微血管密集区常位于癌巢周围,癌巢分布多位于肿瘤浸润边缘,分布散在,这与以上猜测符合。本研究中,快速表观扩散系数(D*)值与MVD 成负相关关系。两者之间的研究目前报道极少,D*值影响因素较多,变异性较大,因此两者之间关系仍需要大量研究来进一步论证。
综上所述,磁共振IVIM 灌注方面参数D*值与MVD 密切相关;在宫颈癌病理分化程度上,D*值能够区分出低分化肿瘤,D值可以区分三种不同分化程度的肿瘤。IVIM参数在临床应用上,能够为术前肿瘤病理分级预测及临床治疗指向提供有力信息,D*可以作为预测宫颈癌肿瘤血管生成的一项潜力指标。本研究尚有一些地方不足:第一,收集患者样本量不够大,特别是低分化组的患者,其原因是该病种由于恶性程度高,生长迅速,首诊已是晚期的可能性大,手术指征大多不满足,因此病理库蜡块样本较少。第二,肿瘤异质性会产生数据误差和偏倚。在肿瘤中有可能分布不同病理分级,而病理诊断是以恶性肿瘤中分级最高的区域决定的。本文采用多兴趣区测量求平均值、肿瘤边缘放置测量意在减少这种误差。第三,在IVIM工作站测量数值时,本文选择肿瘤实性部分测量,部分微小坏死及囊变因素会影响IVIM数值的改变。
作者利益冲突声明:全体作者均声明无利益冲突。

