多囊卵巢综合征低度慢性炎症与肥胖的关系
孙 淼,张晓颖,李洋洋,侯丽辉,孟小钰*
(1.黑龙江中医药大学附属第一医院妇科二科,黑龙江 哈尔滨 150040;2.黑龙江中医药大学2016级针灸专业,黑龙江 哈尔滨 150040)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种临床常见的内分泌妇科疾病,发病率高达10%[1]。PCOS的临床表现主要包括肥胖、胰岛素抵抗和高雄激素血症等主要病理生理学特征[2]。PCOS是临床一种高度异质、病因复杂的疾病,发病机制目前仍然不清楚。随着Kelly等[3]首次报道PCOS患者可能有慢性低度炎症,“炎症学说”在PCOS发病机制中的作用逐渐引起人们的关注,“炎症学说”逐渐成为PCOS研究热点[4-5]。一些专家认为肥胖伴胰岛素抵抗、血脂异常及慢性低度炎症状态是PCOS发生的危险因素。慢性低度炎症,也称为代谢性炎症,是由营养代谢引发的炎症反应,是低于感染性和自身免疫性炎症水平的炎症,无红肿热痛等局部和全身症状,主要表现为急性相反应产物,如C反应蛋白(C-reactive protein,CRP)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等的增加[6-8]。而代谢调节和生殖的关系亦非常密切,因此炎症反应在作为生殖内分泌代谢异常疾病PCOS中受到广泛关注。Gonzalez等[9]认为炎症可能直接导致PCOS患者发生高雄激素血症。高雄激素血症与慢性低度炎症之间存在密切关系[5,10],表明慢性低度炎症可能在PCOS的发病机制中起重要作用。本研究初步探索超重或者肥胖与PCOS患者临床低度慢性炎症之间的关系,旨在为后续进一步临床实验提供思路和方向。
1 资料与方法
1.1一般资料 选择2016年10月—2018年5月就诊于黑龙江中医药大学附属第一医院门诊的PCOS患者126例,按体重指数(body mass index,BMI)将患者分为正常组(BMI<23,n=69)和超重组(BMI≥23,n=57)。
本研究经医院伦理委员会批准通过,患者及家属知情同意并签署知情同意书。
1.2诊断标准、纳入标准及排除标准 PCOS的诊断标准:根据2003年鹿特丹会议制定的标准。纳入标准:符合上述诊断标准;年龄15~35岁。排除标准:患有其他雄激素过多相关的内分泌疾病。
1.3研究方法 临床采集患者资料,包括身高、年龄、体重、臀围(hip circumference,HC)、腰围(waist circumference,WC)、腰臀比(WHR)=WC(cm)/HC(cm)及BMI=体重(kg)/身高(m2)。于月经周期或者药物撤退出血第3天到第5天上午空腹抽血采集血清及全血,检测指标包括CRP、白细胞计数(white blood cell,WBC)、淋巴细胞数(lymphocyte,LYMPH)、单核细胞数(monocyte,MONO)、中性粒细胞数(neutrophil,NEUT)、嗜碱粒细胞数(basophil,BASO)、嗜酸粒细胞数(eosinophil,EO)、三酰甘油(triglyceride,TG)、总胆固醇(cholesterol total,TC)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)、载脂蛋白A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein A,ApoB)、空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)、胰岛素敏感指数(HOMA-IR)=FPG(mmol/L)×FINS(μU /mL)/22.5,睾酮(testosterone,T)、雄烯二酮(androstenedione,AND)、性激素结合雄蛋白(sex hormone binding globulin,SHBG)、雌二醇(estrogen,E2)、黄体生成激素(luteinizing hormone,LH)及卵泡生成素(follicle stimulating hormone,FSH)水平。
1.4统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用独立样本t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1两组临床指标比较 超重组重、WC、HC、WHR高于正常组,差异有统计学意义(P<0.05),见表1。
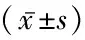
表1 两组临床指标比较Table 1 Comparison of clinical characteristics between two groups
2.2两组性激素和糖脂代谢指标的比较 超重组与正常组比较LH、FSH、LH/FSH、SHBG、HDL-C及Apo-A水平降低,差异有统计学意义(P<0.05),而FPG、FINS、HOMA-IR、TG、TC及LDL-C水平升高,差异有统计学意义(P<0.05),见表2~3。
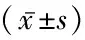
表2 两组性激素水平比较Table 2 Comparison of the levels of sex hormone between two groups
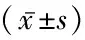
表3 两组糖脂代谢指标比较Table 3 Comparison of the levels of glucose and lipid metabolism between two groups
2.3两组CRP、白细胞计数等指标比较 超重组与正常组比较WBC、LYMPH、MONO、NEUT水平升高,差异有统计学意义(P<0.05),见表4。
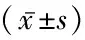
表4 两组CRP、HSCRP、白细胞计数等指标比较Table 4 Comparison of The levels of CRP,HSCRP,white blood cell count and other indicators between two groups
3 讨 论
根据PCOS的临床表现和发病机制,可分为下丘脑-垂体-卵巢轴紊乱,胰岛素抵抗两种类型,前者以LH水平升高为主要表现,后者以肥胖为主要表现,两种类型在分布上因地域,种族存在明显差异[11-12]。针对中国地区PCOS患者研究显示其主要临床表现为肥胖型[13]。而肥胖与低度慢性炎症之间存在密切关系[14]。作为评价炎症的主要指标-CRP,研究显示肥胖PCOS患者血清CRP水平显著升高,与BMI、WHR等呈正相关[15]。另一项研究表明,PCOS超重患者的WBC、LYMPH、NEUT、MONO以及EO高于体重正常PCOS患者(P<0.05)[16]。本研究结果显示,超重组WBC、LYMPH、MONO、NEUT水平较正常组高,提示超重或者肥胖PCOS患者与机体炎症状态存在关联。
研究认为单核细胞侵入组织,形成淋巴细胞、巨噬细胞,作用于脂肪内,促进脂肪分泌炎症因子,从而诱导胰岛素抵抗发生[16]。另外,超重PCOS患者体重、腰围、臀围、BMI、WHR值较大,表现为明显的中心性肥胖,以及黑棘皮评分增加明显,黑棘皮是高胰岛素血症和胰岛素抵抗的可靠皮肤标志[17]。超重PCOS组患者的空腹血糖,胰岛素以及胰岛素敏感指数,血清SHBG水平均升高,这些改变符合中心性肥胖的临床特征[18],同时超重PCOS组患者TG、TC、LDL-C水平升高,HDL-C、Apo-A水平降低,这些指标的改变,往往预示超重PCOS组患者慢性低度炎症状态,肥胖和胰岛素抵抗会增加远期心血管疾病,2型糖尿病的发生风险增加。有研究报道血脂异常与慢性低度炎症之间也存在密切关系,慢性炎症状态下,可导致集体的动脉粥样硬化,增加了心脑血管疾病的风险[19-21]。本研究结果显示,超重PCOS患者的糖脂代谢水平与炎症因子的水平密切相关。
而超重组的LH/FSH值与体重正常组比较,比值降低,曾有研究表明,与非肥胖型PCOS患者相比,肥胖PCOS患者LH、LH/FSH、E2、SHBG水平降低[22],提示肥胖对于PCOS月经紊乱的影响可能不是独立的影响因素。超重或者肥胖导致PCOS患者糖脂代谢异常甚至慢性低度炎症。
综上所述,PCOS的发病机制难以明确,但是PCOS患者存在低度慢性炎症,这一发病机制的证据正在被逐步证实。PCOS慢性低度炎症的严重程度与超重或者肥胖密切相关。

