18F-FDG PET/CT联合MRI评估直肠癌侧方淋巴结转移的应用研究
王铮,肖国有,赖少侣,金观桥,谢东,李丽娅,田连芬,梁彬玲,周传集,韦红娇,柴华,杨志
广西医科大学附属肿瘤医院 医学影像中心,广西影像医学临床医学研究中心 广西临床重点专科(医学影像科)优势培育学科(医学影像学科),广西 南宁 530021
引言
直肠癌侧方淋巴结转移是疗前N及M分期的重要内容之一[1]。侧方淋巴结受累,不仅更容易引起远处转移,还将改变术式及治疗模式。美国国家综合癌症网络直肠癌指南指出:直肠癌任何T分期患者,只要出现侧方淋巴结转移,都常规推荐盆腔侧方淋巴结扩大清扫[2]。MR图像软组织分辨率高,反映病灶三维空间解剖结构的同时,还能反应组织细胞微观病理信息;PET/CT图像质量稳定,能对活体组织、器官代谢信息进行实时、连续动态成像[3]。目前,评估直肠癌侧方淋巴结转移多以单一模态成像技术为主,多模态成像研究报道相对较少[4]。本研究通过回顾性研究,将MRI、PET/CT两种影像检查方法联合,探讨多模态成像疗前评估直肠癌侧方淋巴结转移的应用价值。
1 资料与方法
1.1 一般资料
收集本院2017年12月至2020年5月结直肠及肛门病区 就诊的患者。纳入标准:① 经纤维结肠镜取活检及直肠指诊证实为直肠癌;② 盆腔侧方淋巴结清扫术后,病理资料完整清晰,并能在MRI、PET/CT图像一一对应;③ 疗前既往无盆腔手术及抗肿瘤治疗史;④ 无MRI、PET/CT检查禁忌症,自愿签署知情同意书并顺利完成上述检查;⑤ 术前影像资料完整清晰。剔除标准:① 经纤维结肠镜取活检及直肠指诊证未能实为直肠癌;② 未能采用盆腔淋巴结清扫术式,术后病理资料无法证实淋巴结性质;③ 既往有盆腔手术史或术前接受过其他形式抗肿瘤治疗; ④ 有MRI、PET/CT检查禁忌或未能顺利完成检查。依照上述标准,符合本次研究要求的直肠癌患者共51例,男性39例,女性12例;年龄29~78岁,平均年龄(63.7±10.1)岁;临床主要表现为便血、大便习惯及性状改变、腹疼等。术前1周内分别行18F‐FDG PET/CT、MRI检查。
1.2 18F-FDG PET/CT显像
PET/CT是目前最明确、最精准的分子显像设备,是利用病变组织与正常组织生物学特点的差异而成像的功能显像方法。利用图像融合技术将PET的功能信息和CT的解剖信息进行同机融合,PET/CT检查优势(比CT、MRI等),PET+CT两者优势互补,PET/CT可以提前半年发现异常病变,不仅缩短了检查时间,而且精确定位,明显提高了诊断的准确性,起到1+1>2的效益。一次定位即可检查全身,节省了大量时间和金钱,且具有灵敏度高、特异性强、准确率高、无创、无痛、辐射量低等优点。
入组患者术前行PET/CT检查。常规CT检查多以病变形态学检出为主,而病变区组织细胞的代谢变化明显早于形态学改变。PET/CT检查依据注入显像剂后组织细胞摄取显像剂差异,将形态学与功能图像有机融合,从分子水平反映人体组织细胞病理及病理生理变化,在疾病定位及定性诊断上有更高的灵敏度和检出率。本次研究运用美国GE Discovery PET/CT 710成像,放射性正电子核素18F‐FDG由日本住友HM‐10HC回旋加速器生产,药物合成器为日本住友F300E‐2合成模块,18F‐FDG放化纯度>95%。患者检查常规禁食4~6 h以上,血糖控制在10 mmol/L以下,按体重静脉注射18F‐FDG 7.77 MBq/kg或5.18 MBq/kg。患者注射上述显像剂后避光、安静休息60 min。PET/CT显像前先行CT扫描,电压120 kV,电流120 mA,层厚5 mm或3 mm。CT扫描完成之后行发射扫描,采集5~7个床位,采集时间为2.5 min/床位,扫描范围包括头部至双侧股骨中段范围。应用CT进行衰减校正,所有获得的PET/CT的数据使用迭代法重建技术重建三维图像。扫描结束后自动将图像上传至Xeleris工作站。
1.3 MRI检查
PET/CT检查结束1 d后,再行MRI检查。近年来,MRI已成为直肠癌疗前评估的首选检查,其无创、多方位成像、软组织层次分辨率高、动态连续观察的优势弥补了诸多检查的不足。随着外部线圈(如相控阵线圈)的使用、图像后处理技术的不断完善、MRI各种新功能成像新技术的运用,获得了更多关于肿瘤形态学及血流动力学的信息,为疗前评估提供了更可靠的参考依据。应用Discovery 750w 3.0 T超导磁共振成像仪(GE Healthcare,美国)、8通道体部相控阵线圈。盆腔常规扫描采用快速自旋回波序列。T1WI序列扫描:TR/TE=579/12 ms,层厚/层间距=5 mm/1 mm,间隔=5 mm,视野=273 mm×273 mm,矩阵=2 5 6×2 5 6,N E X=1次;T 2 W I序列扫描:TR/TE=3715/94 ms,层厚/层间距=5 mm/1 mm,间隔=5 mm,视野=283 mm×283 mm,矩阵=256×256,NEX=1次;扩散加权成像(Dffusion‐Weighted Image,DWI)序列轴位扫描:扩散敏感系数b值分别为0、800 s2/mm,TR=8900 ms,TE=87 ms,层厚=3 mm,层间隔=0.3 mm,视野=232 mm×264 mm,NEX=4次,矩阵=122×168;动态增强磁共振(Dynamic Contrast Enhanced MRI,DCE‐MRI)轴位扫描:采用LAVA‐FLEX技术、T1WI脂肪抑制序列,TR =5.0 ms,TE =1.5 ms,层厚=2 mm,间隔=0.2 mm,翻转角=9°,视野=321 mm×362 mm,矩阵=201×318,无间隔动态重复扫描6期。第1期扫描时相结束后立即经肘静脉以1.5 mL/s流率团注对比剂钆喷酸葡胺注射液(Gd‐DTPA),剂量0.2 mmol/kg,20 s后进行第2~6期连续扫描,各期扫描时间为1 min,注射完毕后用以相同流率的生理盐水冲管。
1.4 图像分析
由2名医学影像中心腹部疾病影像诊断经验丰富的高年资主治医师盲法分析PET/CT、MRI图像,确定侧方淋巴结位置并进行标记,评估意见不一致时以讨论后的意见作为最终诊断结论。
1.4.1 PET/CT图像评估
图像评阅者在Xeleris工作站上调阅CT平扫横断面图像测量侧方淋巴结短径;在横断面PET/CT融合图像上沿淋巴结边缘勾画选择感兴趣区(Region of Interest,ROI),选取淋巴结全部层面以手动方式进行勾画,测量淋巴结SUVmax。取2位医师测量所得数据的平均值,以均数±标准差表示。
1.4.2 MRI图像评估
图像评阅者运用医学影像存档与联络系统 浏览全部序列图像,观察侧方淋巴结形态学表现。选取T2WI高分率图像上淋巴结全部层面测量短径,所得数据的平均值以均数±标准差表示;表观扩散系数(Apparent Diffusion Coefficient,ADC)值ROI的选择及测量方法如下:① 以盆腔常规T1WI、T2WI及增强扫描明确侧方淋巴结具体位置,观察b值=800 mm2/s时DWI图像上信号;② 尽量避开血管影及伪影,以手动方式测绘;③ 选取淋巴结全部层面进行多次测量,以均数±标准差表示。
1.5 病理检查
所有侧方淋巴结均经手术完整切除,依据术前PET/CT、MRI图像的定位对淋巴结进行编号,经过组织固定,代表性取材,脱水,包埋后做成蜡块,制片。根据镜下表现,选取病变典型的组织蜡块,重新切片进行免疫组化检查。所有淋巴结切片由具有由两名病理科主治医师盲法阅片,最后将影像同病理诊断结果进行对照分析。
1.6 统计学分析
采用SPSS 21.0软件分析数据,符合正态分布的计量资料用均数±标准差表示,计数资料用数字表示。采用两样本t检验比较转移性淋巴结与非转移性淋巴结的短径、ADC值和SUVmax;分别用不同指标及指标组进行诊断,计算各指标诊断直肠癌侧方淋巴结转移的灵敏度、特异性和准确性;率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 术后病理
51例直肠癌患者术后镜下病理类型为:管状腺癌35例,黏液腺癌8例,印戒细胞癌5例,神经内分泌癌2,类癌1例。所有患者共切除侧方淋巴结237枚,其中78枚淋巴结(转移淋巴结33枚,非转移性淋巴结45)与PET/CT、MRI图像能够一一对应(图1~2)。
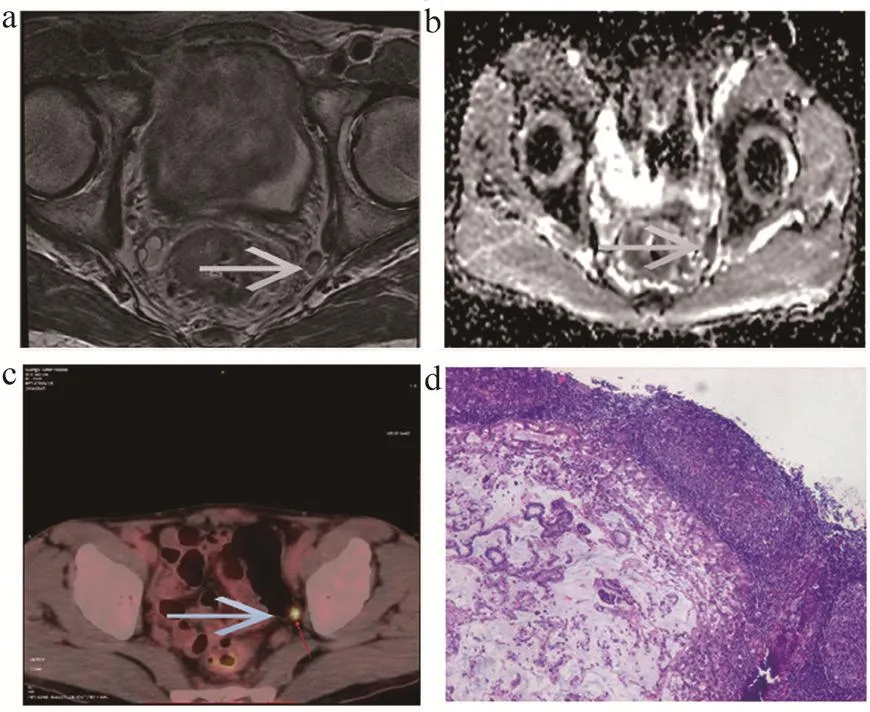
图1 患者1图像
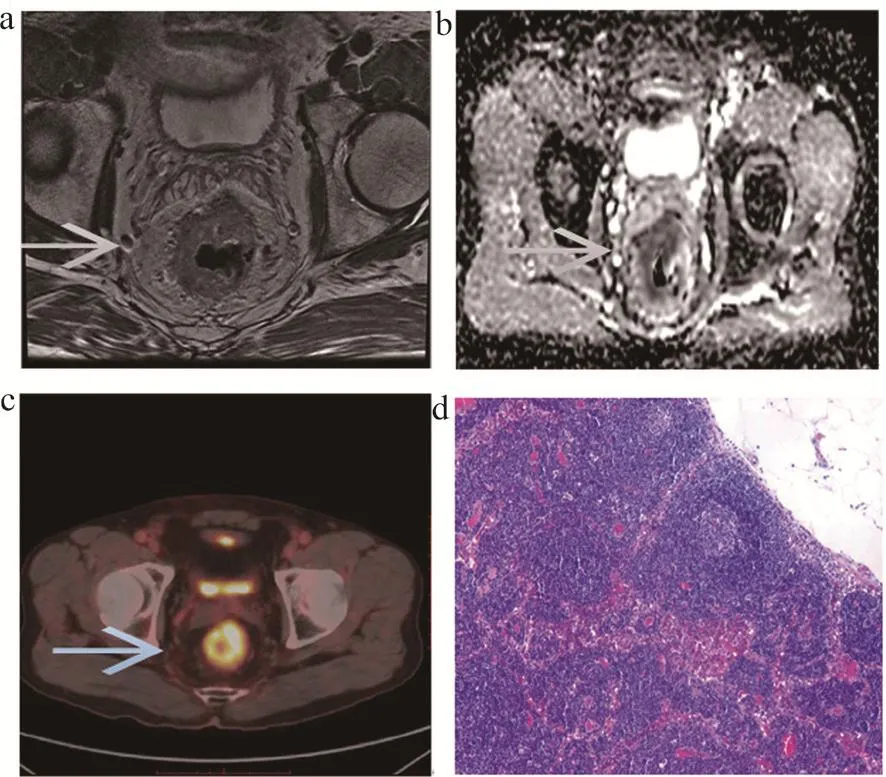
图2 患者2图像
2.2 PET/CT、MRI淋巴结短径及PET/CT联合MRI信号诊断直肠癌侧方淋巴结转移
MRI、PET/CT测量非转移性淋巴结、转移性淋巴结短径二者间差异没有统计学意义(P>0.05,表1);分别以MRI短径≥6.75 mm、PET/CT短径≥5.05 mm为转移性淋巴结诊断标准[5],两者灵敏度、特异性、准确性差异不大(P>0.05);将PET/CT短径≥5.05 mm联合MRI淋巴结信号不均诊断转移性淋巴结时,其灵敏度、特异性、准确性明显上升(P<0.05,表2)。
表1 PET/CT、MR测量78枚转移、非转移性淋巴结短径比较(±s,mm)
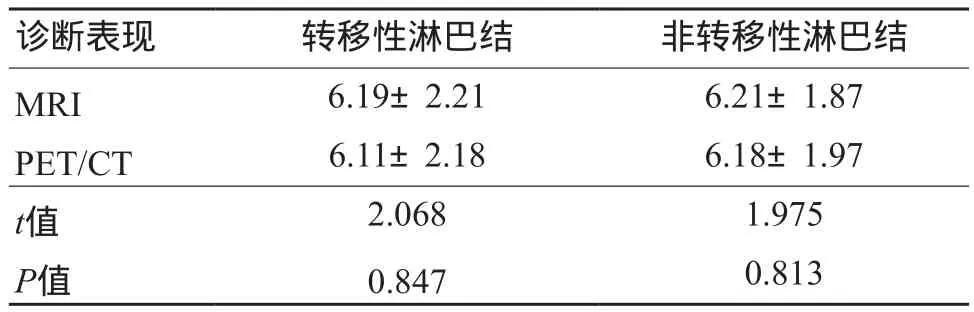
表1 PET/CT、MR测量78枚转移、非转移性淋巴结短径比较(±s,mm)
诊断表现 转移性淋巴结 非转移性淋巴结MRI 6.19±2.21 6.21±1.87 PET/CT 6.11±2.18 6.18±1.97 t值 2.068 1.975 P值 0.847 0.813
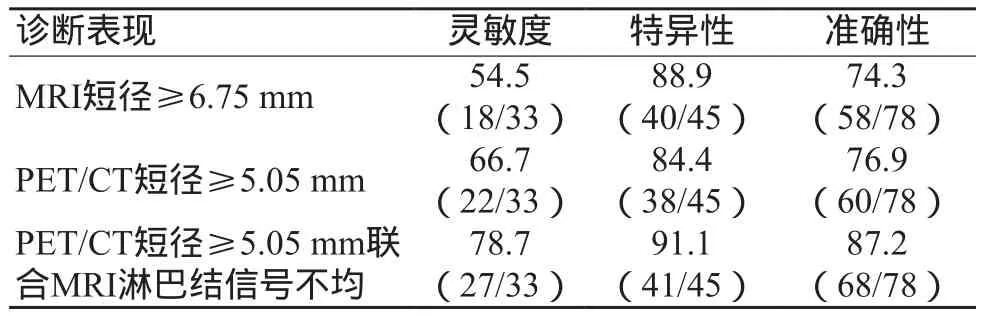
表2 PET/CT、MRI淋巴结短径及PET/CT结合MRI信号对78枚转移性淋巴结的诊断效能(%)
2.3 SUVmax、ADC值及SUVmax联合ADC值诊断直肠癌侧方淋巴结转移
非转移性淋巴结、转移性淋巴结的SUVmax、ADC值二者间差异没有统计学意义(P>0.05,表3);分别以SUVmax≥1.45、以ADC值≤1.049为转移性淋巴结诊断标准[6],两者灵敏度、特异性、准确性差异不大(P>0.05);以SUVmax≤1.45且ADC值≤1.049×10‐3mm2/ s诊断转移性淋巴结时,其灵敏度、特异性、准确性明显提高(P<0.05,表4)。
表3 78枚转移、非转移性淋巴结SUVmax、ADC值比较(±s)
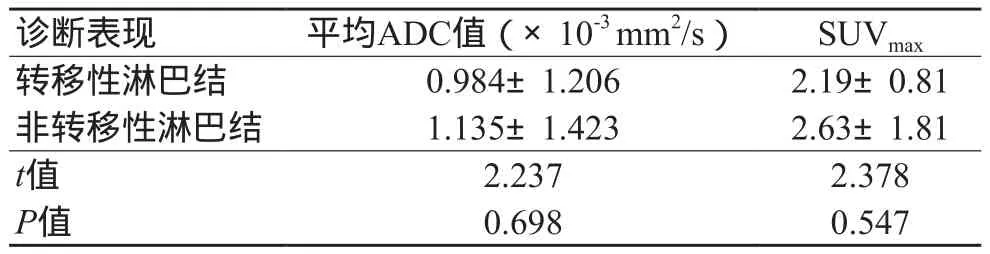
表3 78枚转移、非转移性淋巴结SUVmax、ADC值比较(±s)
诊断表现 平均ADC值(×10‐3 mm2/s) SUVmax转移性淋巴结 0.984±1.206 2.19±0.81非转移性淋巴结 1.135±1.423 2.63±1.81 t值 2.237 2.378 P值 0.698 0.547
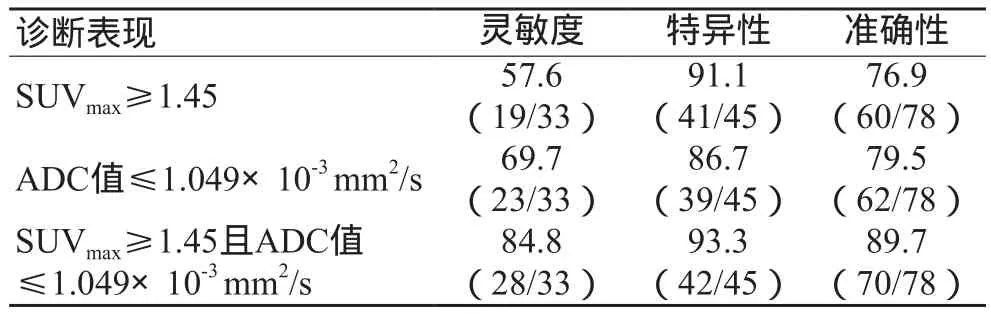
表4 SUVmax、ADC值及SUVmax联合ADC对78枚转移性淋巴结的诊断效能(%)
3 讨论
直肠癌的发生、发展、转移是多阶段、多步骤的过程,与多种原癌基因及抑癌基因失活或激活引起的各种信号通路持续活化或失活密切有关[7‐8]。直肠癌各种转移途径中,侧方淋巴结转移重要的转移途径之一,疗前准确评估侧方淋巴结状态,与患者术式及预后评价密切相关[9]。目前,CT和MRI评价直肠癌侧方淋巴结准确性、灵敏度不太理想[10]。本研究分别选择转移性淋巴结PET/CT短径>5.05 mm,高分辨率T2WI序列短径>6.75 mm进行研究,但两者诊断价值一般且没有统计学差异。其原因在于直肠肿瘤细胞通过脉管微转移至淋巴结时,其大小往往尚无明确变化[11‐12]。因此,术前单纯运用经线来判断直肠癌侧方淋巴结是否转移,预测效果不尽如人意[13‐14]。有学者认为:联合MRI其他形态表征(如边界、内部信号、强化方式等),诊断转移性淋巴结的灵敏度及准确性明显提高,但目前多以直肠系膜内淋巴结研究为主[14]。本次研究笔者将PET/CT短径与高分辨率T2WI序列信号相结合,诊断直肠癌侧方转移性淋巴结的灵敏度及特异性明显提高。故可认为高分辨率T2WI序列信号不均诊断转移性淋巴结有一定的提示作用。既往对于短径≤5 mm淋巴结,由于PET/CT图像分辨率的限制而易被研究者舍弃,而该部分往往包含转移性淋巴结。而将高分辨率T2WI序列与PET/CT联合,不仅能提高短径≤5 mm的淋巴结显示率,还能结合其信号情况,诊断直肠癌侧方淋巴结转移的灵敏度及特异性明显提高[15]。
本 次 笔 者 还 分 别 将SUVmax≥1.45、ADC值≤1.049×10‐3mm2/ s作为直肠癌侧方淋巴结转移的诊断阈值时,诊断灵敏度、特异性和准确性差别不大。而将SUVmax≥1.45且ADC值≤ 1.049×10‐3mm2/s进行联合诊断时,其诊断灵敏度、特异性和准确性明显上升。笔者分析认为:直肠癌侧方转移性淋巴结短径较小,癌细胞浸润密度相对较低;周边区域其他非病变结构高摄取状态导致不易区分,以上因素往往影响SUVmax测量的准确性。直肠癌其他病理分化类型,如印戒细胞癌、黏液腺癌肿瘤细胞相对成分较少,黏液分泌较多,该类转移性淋巴结与病灶本身存在一定相似性,PET/CT上呈现低代谢征象[16],有可能将其误认为非转移性淋巴结。此外,本研究中有4例患者的7枚侧方淋巴结SUVmax≥1.45,术前诊断为转移性淋巴结,但术后病理提示为慢性炎性淋巴结。追踪既往病史后发现,该类患者合并不同程度慢性盆腔炎症及盆腔少量积液,而慢性盆腔炎症引起淋巴结细胞内单核巨噬细胞及淋巴细胞数量、密度明显增加,PET/CT显像亦呈现类似转移性淋巴结高表达、高摄取状态。有学者[17‐18]也证实女性直肠癌患者中,常伴有盆腔慢性炎性病变者常常引起盆腔淋巴结渐进性肿大,上述表现是引起术前过度N分期不可避免的原因之一。
近年来,DWI成像能够直接检测人体组织细胞间水分子扩散运动情况,间接反映组织细胞数量及密度变化、细胞膜结构及功能完整性、大分子蛋白定性及定量诊断信息。转移性淋巴结细胞数目增多,密度增大,细胞外间隙相对减小;大分子蛋白的增多,对水分子的吸附作用也增强,使细胞内外水分子活动空间相对减少,呈扩散受限状态[19‐20]。笔者将直肠癌侧方淋巴结ADC诊断阈值1.049×10‐3mm2/s与SUVmax≥1.45进行联合诊断,较单一指标诊断灵敏度、特异性和准确性明显高。由此可见,MRI功能学指标与PET/CT代谢指标相结合时,能反映更多直肠癌转移性淋巴结代谢及分子生物学信息,提高治疗前N分期评估的准确性。然而,本研究依然存在一定的局限性:① 本次入组的病例中,病理组织学类型以管状腺癌较多,可能存在选择性偏倚,有待于日后扩大样本量继续深入研究;② ADC值、SUVmax值测量影响因素较多,不仅受细胞分布状态、细胞间隙水分子扩散程度、局部血流灌注的影响,还与图像评阅者主观因素有一定关系,上述因素均不可避免地影响了直肠癌术前侧方淋巴结评估的准确性。
综上所述,18F‐FDG PET/CT联合MRI多模态成像在直肠癌术前转移性淋巴结评估、N分期中有者重要的临床意义,能为术式选择、个体化治疗方案的制定提供有价值的临床决策信息。

