昆明滇润楠叶缘枯病病原鉴定及生防菌筛选
魏玉倩陈健鑫唐婕孙会林黄培珊伍建榕
(1.西南林业大学云南省高校森林灾害预警控制重点实验室,云南昆明 650224;2.西南林业大学国家林业和草原局西南地区生物多样性保育重点实验室,云南昆明 650224;3.会泽县者海林场,云南会泽 654200)
滇润楠Machilus yunnanensis为樟科Lauraceae润楠属Machilus的常绿乔木,主要分布在云南中部、西部至西北部,四川西南部和西部等地区[1],因其树龄长、生长快、树形美,能抵抗环境污染等特性,已列为昆明市园林规划中采用的乡土树种之一[2]。由于大面积绿化种植,近年来,滇润楠叶缘枯病发生日趋严重,削弱树势,影响城市景观。目前对滇润楠的研究主要集中在组织培养[3]、光合速率[4]、苗木培育技术[5]等方面,未见对滇润楠叶缘枯病的研究报道。该病主要危害叶片,从叶尖及叶缘开始发病,病斑圆形至椭圆形,中部灰褐色,边缘褐色,后期病斑上散生黑褐色小点即病原菌的分生孢子盘。该病主要引起叶尖或叶缘变褐坏死或干枯,导致大量落叶影响观赏。笔者以昆明地区及西南林业大学校园滇润楠叶缘枯病的病害调查为切入点,通过形态学和分子生物学鉴定相结合的方法对滇润楠叶缘枯病进行病原鉴定,并通过柯赫氏法则进行致病性测定的验证,确定引起该病害的病原菌,同时进行病原生防菌的筛选。该研究属国内首次报道,以期为城市绿化树种滇润楠叶缘枯病的绿色防控提供新思路。
1 材料与方法
1.1 调查地概况 昆明位于云贵高原中部,滇池盆地北部,海拔1 800~4 200 m,属北纬低纬度亚热带-高原山地季风气候,年平均气温15℃,年降水量1 040 mm左右。昆明市区及西南林业大学校园内滇润楠树龄为20 a,树高4.5~5.0 m,冠幅约为3.0 m×3.0 m。
1.2 试验材料 试剂:2×Taq Maseter Mix购自近岸蛋白质科技有限公司;HP Fungal DNA Kit试剂盒、DM 2000 plus Marker、通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和 ITS4(5′-ACCCTCAGTGTAGTGACCCTTGGC-3′)均购自昆明硕阳科技有限公司;凝胶(1×TAE 23 mL、琼脂糖0.23 g、4s Green 2.3 μL)。
仪器:低温高速离心机 Eppendorf(5811ZJ44568),昆明倍捷科技有限公司;格兰特XB70-FZ雪花形制冰机,宁波格兰特制冷设备制造有限公司;ZWY-200D恒温培养振荡器,上海智城分析仪器制造有限公司;846-X-070-101梯度PCR仪,Biometra GmbH;721BR13670凝胶成像仪,Bio-RAD。
菌株:枯草芽孢杆菌Bacillus subtilis、胶质类芽孢杆菌Paenibacillus mucilaginosus和多粘芽孢杆菌Paenibacillus polymyxa均由西南林业大学森林病理学实验室提供。
1.3 滇润楠叶缘枯病发病情况调查及标本采集2018年3月至2020年3月,采用普查和专题调查相结合的方法对昆明地区及西南林业大学校园等9个滇润楠行道树种植区发生严重的滇润楠叶缘枯病进行了发病率及危害程度调查,昆明地区的8个调查地点采用五点法,每点调查30株,西南林业大学校园内共调查100株。观察记录病害的发病特点,并拍照记录。根据病害分级标准(表1)计算病情指数。同时,采集具有典型叶缘枯病症状的病害叶片标本带回实验室进行病原形态鉴定及分离培养。病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)。
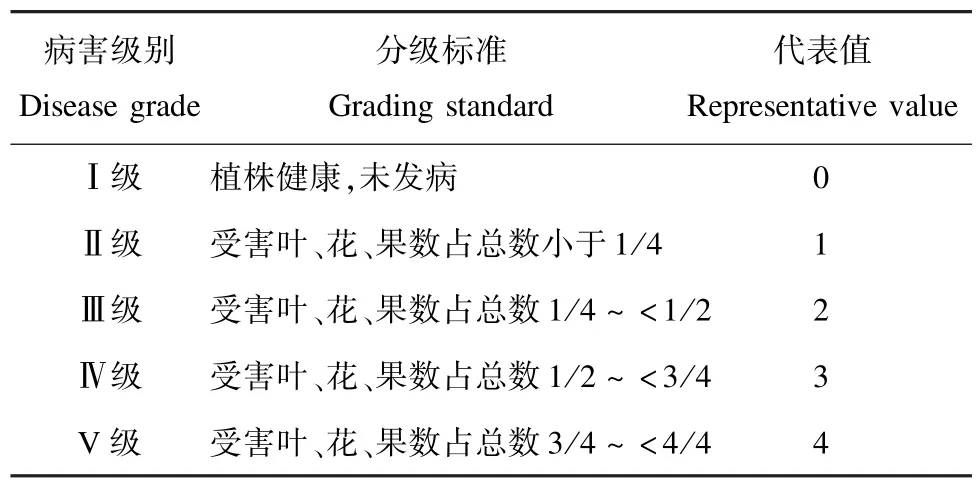
表1 滇润楠叶缘枯病分级标准Tab.1 Classification standard for leaf spot of M.yunnanensis
1.4 病原菌分离与致病性测定
1.4.1 病原菌的分离培养与纯化 采用组织分离法对滇润楠病叶上的病原菌进行分离。病健交界处切取病组织4~5 mm的小块,置于75%乙醇中浸泡10 s,移入0.1%氯化汞溶液中浸泡3~5 min,再转移到无菌水中漂洗3遍,最后置于PDA培养基上,25℃培养箱中培养,待长出菌丝后,挑取少量菌丝移到PDA平板上,25℃培养箱中进行纯化培养,观察并记录病原菌形态特征[6]。
1.4.2 致病性测定 根据柯赫氏法则采用伤口接种测定致病性,将健康叶片用75%乙醇进行表面消毒,用灭菌针轻微刺伤或烫伤叶片表皮,然后用打孔器打取菌丝块贴于接种处,置于灭菌塑料袋内于培养箱内25℃恒温保湿培养,以不接菌为对照,定期及时观察发病情况,发病后重新分离病原菌,如与接种前病原菌形态相同即可确定为病原菌[7]。
1.5 病原菌鉴定
1.5.1 形态学鉴定挑取叶缘枯病症状上的病原菌子实体(褐色小点)进行徒手切片镜检,观察病原菌的形态特征;如果病叶未产生子实体,将病部用无菌水保湿培养24~72 h,待子实体成熟产孢后再进行切片镜检,观察病原菌的孢子形态和产孢结构[8-9];并显微拍照。根据病原菌形态、大小,查阅相关资料进行病原鉴定[10-11]。
1.5.2 分子生物学鉴定
1.5.2.1 DNA提取 将分离纯化的病原菌菌株转到PDA培养基上培养7 d,选用HP Fungal DNA Kit试剂盒提取基因组DNA。
1.5.2.2 PCR扩增 采用通用引物ITS1和ITS4;PCR 反应体系:Mix,25 μL;ddH2O,20 μL;ITS1,1.5 μL;ITS4,1.5 μL;DNA,2.0 μL。 PCR 反应条件:94 ℃,3min;94 ℃,30 s;56 ℃,40 s;72 ℃,50 s;72℃,10 min;30次循环。PCR扩增产物经凝胶电泳检测后送至擎科生物系统有限公司进行测序。
1.5.2.3 rDNA-ITS序列及系统发育分析 滇润楠叶缘枯病菌分离物测序获得rDNA-ITS序列,用生物信息学软件BioEdit和Clustalx进行拼接,人工校对,编辑后获得准确序列提交NCBI下载与该病原菌的rDNA-ITS序列进行分析,采用PAUP4进行系统发育分析,用NJ(neijhbor-joining,邻接)算法,1 000次重复构建系统发育树。
1.6 筛选对滇润楠叶缘枯病有抑菌效果的生防菌
1.6.1 芽孢杆菌菌液制备 首先活化由西南林业大学森林病理学实验室提供的枯草芽孢杆菌Bacillus subtilis、胶质类芽孢杆菌Paenibacillus mucilaginosus和多粘芽孢杆菌Paenibacillus polymyxa,然后进行扩繁。枯草芽孢杆菌、胶质类芽孢杆菌和多粘芽孢杆菌菌株均在LB斜面上活化24 h,配成1×108cfu/mL的菌悬液,取500 μL接入装有50 mL LB培养液的三角瓶中,28℃,180 r/min振荡培养120 h,制备成浓度为1×108cfu/mL的菌液。
1.6.2 病原菌孢子悬浮液制备 将滇润楠叶缘枯病病原菌活化3 d后,在PDA平板上生长7 d,用挑针轻刮子实体,再用无菌去离子水使孢子悬浮,并通过4层纱布过滤到250 mL三角瓶中,用无菌去离子水稀释,血球计数板计数,将分生孢子浓度调整为1×105个/mL。
1.6.3 抑菌效果检测 选择健康的滇润楠叶片,70%乙醇表面消毒,用灭菌的针刺或烫伤,造成微伤口,接种设置3个抑菌处理和1个对照处理。①接种1×108cfu/mL枯草芽孢杆菌B.subtilis溶液20 μL和1×105个/mL滇润楠炭疽菌孢子悬浮液20 μL;②接种 1×108cfu/mL胶质类芽孢杆菌P.mucilaginosus(G-51)溶液 20 μL 和 1×105个/mL滇润楠炭疽菌孢子悬浮液20 μL;③接种1×108cfu/mL多粘芽孢杆菌P.polymyxa(BYEC2)溶液20 μL和1×105个/mL滇润楠炭疽菌孢子悬浮液20 μL;④接种蒸馏水20 μL和 1 ×105个/mL滇润楠炭疽菌孢子悬浮液20 μL。每处理l0片叶片,重复3次。计算发病率,测量病斑直径并计算各处理的抑菌效果,观察分生孢子盘的发育情况和计算分生孢子盘发育指数。分生孢子盘发育分级标准:0级,未形成分生孢子盘;I级,出现黑色分生孢子盘;Ⅱ级,分生孢子盘颜色加深,但不成轮纹状排列;Ⅲ级,出现深褐色分生孢子盘且成轮纹状排列。
发病率(%)=发病叶数/接种总叶片数×100
分生孢子盘发育指数=100×∑(各级分生孢子盘数×各级代表值)/(镜检总分生孢子盘数×最高级代表值)
抑菌效果(%)=(对照组病斑直径-抑菌组病斑直径)/对照组病斑直径×100
1.6.4 数据统计 病原菌的抑菌效果采用DPS软件Duncan氏多重极差检验法,进行差异显著性分析[12-14]。
2 结果与分析
2.1 滇润楠叶缘枯病发病情况 昆明市区滇润楠行道树8个地点的行道树各150株树平均有102株受到叶缘枯病危害,发病率68%,病情指数均达到47.4;西南林业大学校园100株滇润楠有69株受到叶缘枯病危害,发病率69%,病情指数均达到46.7。该病主要危害叶缘及叶尖,发病初期先在叶尖或叶缘出现浅褐色病斑,随着病情的发展,病斑逐渐扩大,形成灰褐色病斑,叶斑从外向内逐渐干枯,发病后期在病斑上出现黑色小颗粒(子实体,分生孢子盘),后期叶片变黄枯死,导致大量落叶(图1)。

图1 滇润楠叶缘枯病发病症状Fig.1 Symptom of leaf margin blight of M.yunnanensis
2.2 病原菌分离与致病性测定结果
2.2.1 病原菌分离 分离菌株在PDA培养基上培养性状表现为菌落圆形,5 d观察到菌落白色,菌落边缘排列整齐,7 d菌丝辐射状生长,颜色变灰白色(图2)。

图2 滇润楠叶缘枯病病原菌在PDA培养基上菌落形态及颜色Fig.2 Colony morphology and color of leaf margin blight pathogen of M.yunnanensis on PDA medium
2.2.2 致病性测定 分离纯化的病原菌接种到经针刺或烫伤处理叶片后,叶片均发病,而清水对照叶片不发病。接种7 d后在接种部位产生褐色圆斑,12 d后圆斑逐渐扩大,并产生黑色小点,接种导致叶片尖端变枯,与自然发病症状相同。对接种获得的病叶进行重分离培养后,获得相同的病原菌,说明该菌是滇润楠叶缘枯病的致病菌(图3)。

图3 滇润楠叶缘枯病离体接种症状Fig.3 Symptoms of leaf margin blight of M.yunnanensis after in vitro inoculation
2.3 病原菌鉴定结果
2.3.1 形态学鉴定 自然条件下发病的病斑通过徒手切片观察,显示分生孢子盘褐色,有刚毛;分生孢子梗细长柱形、长筒形,无色、无隔膜,大小为(16.8~18.2)μm ×(3.9~5.4)μm;分生孢子圆柱形,两端钝圆,单孢,大小为(10.9~15.6)μm×(2.8~4.2)μm。经分离纯化得到的病菌与切片得到的病原菌相同。初步确认引起滇润楠叶缘枯病的病原为胶孢炭疽菌Colletotrichum gloeosporioides(Penz.)Penz.&Sacc.(图4)。

图4 胶孢炭疽菌C.gloeosporioides分生孢子盘、孢子及刚毛Fig.4 Acervulus,conidium and seta of C.gloeosporioides
2.3.2 分子生物学鉴定 扩增病原菌ITS-rDNA基因,得到573~577 bp的DNA片段。序列测定并比对结果表明,供试菌株(DRN)基因组ITS-rDNA序列与NCBI库内的炭疽病菌 (GenBank登录号为KC010549.1)同源性达到了100%,据此确认致病菌为Colletotrichum gloeosporioides。同时采用贝叶斯分析方法所构建的炭疽菌属Colletotrichum和其近缘类群的系统发育树揭示其分类地位(图5)。

图5 采用PAUP4所构建的病原菌菌株DRN和其近缘类群的系统发育树Fig.5 Phylogenetic tree of DRN pathogen and its related groups constructed by PAUP4
2.4 生防菌对滇润楠叶缘枯病菌抑菌效果 经枯草芽孢杆菌Bacillus subtilis、胶质类芽孢杆菌Paenibacillus mucilaginosus和多粘芽孢杆菌Paenibacillus polymyxa处理,3个菌株对滇润楠叶缘枯病原菌的抑菌效果与对照之间都达到显著性差异,其中枯草芽孢杆菌处理18 d后,滇润楠叶片发病率为25.66%、病斑直径为 0.68 cm、抑菌效果为84.92%,分生孢子盘发育指数为0.12,达极显著水平(P<0.01),抑菌效果最好;其次是胶质类芽孢杆菌,再次是多粘芽孢杆菌(表2)。

表2 接种18 d后3种芽孢杆菌对滇润楠叶缘枯病病原菌的抑菌效果Tab.2 Antifungal effect of Bacillus spp.against leaf margin blight pathogen on M.yunnanensis 18 days after inoculation
3 讨论
因滇润楠抗旱及抗寒性好,昆明市现已将原来的绿化行道树种银桦Grevillea robusta和小叶榕Ficus concinna更换为滇润楠,可见滇润楠在昆明市绿化中起到举足轻重的作用。目前,仅见关于滇润楠组织培养及快速培养技术,育苗造林技术以及滇润楠上害虫长脊冠网蝽Stephanitis svensoni的防治[15]等方面的报道,而本次对滇润楠叶缘枯病的研究属首次报道。传统真菌学系统分类是以形态学特征及孢子形态为主要依据,尤其是将产孢结构等用作分类鉴定的主要性状,并遵循柯赫氏法则进行鉴定。
本试验中,通过野外调查,样本采集,将分离培养、回接、重新分离获得的病原菌经显微观察,形态学与分子生物学鉴定相结合,确定了引起滇润楠叶缘枯病的致病菌为胶孢炭疽菌C.gloeosporioides。在一定程度上克服了仅以形态学为基础的分类系统的人为和环境条件影响,从更深层面进行分析研究,两种方法的结果得到相互印证,保证了研究结果的可靠性。滇润楠叶缘枯病病原菌经鉴定为半知菌类腔孢纲黑盘孢目黑盘孢科炭疽菌属的胶孢炭疽菌C.gloeosporioides,与王柏泉 等[16]报道的樟树炭疽病病原菌一致。
3种芽孢杆菌处理离体叶片对病原菌的抑菌试验表明:枯草芽孢杆菌、胶质类芽孢杆菌和多粘芽孢杆菌均可抑制滇润楠叶缘枯病原菌,特别是枯草芽孢杆菌对引起滇润楠叶缘枯病的炭疽菌的抑菌效果最佳,达到极显著性差异,抑制了病斑的扩展和分生孢子盘的发育,但枯草芽孢杆菌对滇润楠叶缘枯炭疽病的生防机理尚不清楚,因而还需要深入研究枯草芽孢杆菌的生防机理,找到有效的预防和早期治疗措施。

