基于治疗药物监测的舍曲林在抑郁症患者中血药浓度/剂量比的影响因素分析Δ
谭亚倩,陈紫琦,刘舒静,李晓琳,肖 桃,黄善情,温预关,尚德为#
(1.广州医科大学附属脑科医院药学部,广东 广州 510370; 2.广州医科大学药学院,广东 广州 511436)
抑郁症已成为全球第三大疾病负担[1]。舍曲林是抑郁症治疗的一线用药[2-3],其主要在肝脏中代谢为无活性的N-去甲基舍曲林[4]。本课题组在舍曲林临床药物浓度监测的过程中发现其血药浓度差异较大。尽管有大量研究结果显示,抑郁症患者对舍曲林的耐受性良好[5-7],但研究其在临床应用中的个体化差异仍然是有必要的,通过探讨舍曲林血药浓度的影响因素,有助于解释其临床反应的个体化差异,也有助于临床医师调整给药方案。同时,舍曲林是神经精神药理学与药物精神病学协会(arbeitsgemeinschaft für neuropsychopharmakologie und pharmakopsychiatrie,AGNP)精神科治疗监测指南中推荐进行浓度监测的药物[8]。本研究通过回顾性分析广州医科大学附属脑科医院(以下简称“我院”)进行舍曲林血药浓度监测的住院患者资料,探讨舍曲林血药浓度/剂量比(C/D)的影响因素,为舍曲林的个体化用药提供参考。
1 资料与方法
1.1 资料来源
收集2019—2020年在我院进行过舍曲林治疗药物监测的抑郁症患者的性别、年龄、身高、体重、给药剂量、给药频次、联合用药以及稳态血药浓度等资料。纳入标准:(1)需为住院患者,病历资料记录完整;(2)诊断为抑郁症;(3)在我院监测过舍曲林的血药浓度且血药浓度达到稳态。排除标准:(1)门诊患者及外院外送标本者;(2)资料不齐患者;(3)采血点未达到稳态谷浓度者;(4)血药浓度为0 ng/ml或者超过定量范围者;(5)严重肝肾功能不全者;(6)合并其他严重躯体疾病者。共纳入符合标准的患者373例(529份血药浓度监测数据),患者平均年龄为(28.96±17.91)岁,其中男性106例,女性267例。
1.2 舍曲林血样样本采集以及血药浓度测定
患者需连续服用舍曲林至少达到5个半衰期。清晨患者服用舍曲林前采集其全血3~5 ml,以3 000 r/min离心5 min,得血清后,采用液相色谱串联质谱法检测舍曲林血药浓度。我院采用AGNP精神科治疗药物监测共识指南推荐浓度范围10~150 ng/ml作为舍曲林的血药浓度参考范围[3]。
1.3 色谱条件和质谱条件
色谱柱为Agilent ZORBAX Eclipse XDB-C18柱(1.8 μm,4.6 mm×50 mm),流动相为甲醇-水(V∶V=90∶10,2 mmol/L甲酸铵),舍曲林和内标舍曲林-d3的定量离子对分别为m/z306.05→m/z158.90和m/z309.05→m/z158.90[9]。
1.4 统计学方法
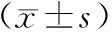
2 结果
2.1 舍曲林剂量与血药浓度
患者的平均舍曲林剂量为(153.40±69.68)mg/d。所有患者均只收集同一给药方案下的最后1次舍曲林血药浓度数据,舍曲林平均血药浓度为(85.85±59.11) ng/ml,其中有5份(占0.95%)血药浓度低于参考值下限;455份(占86.01%)血药浓度在参考范围内;69份(占13.05%)血药浓度高于参考值上限。
给药剂量是影响血药浓度的重要因素,将给药剂量与血药浓度进行简单线性回归,得到线性回归方程[Sertraline]=0.338+0.398[dose](R2=0.157)。回归方程显示,给药剂量与血药浓度成正比,但是给药剂量与血药浓度之间的相关性较弱,给药剂量仅能解释15.7%的血药浓度变化。
2.2 性别、年龄、体重指数(BMI)、给药频次以及联合用药对舍曲林稳态血药浓度的影响
性别、年龄、BMI、给药频次以及联合用药对舍曲林稳态血药浓度的影响见表1。

表1 性别、年龄、BMI、给药频次以及联合用药对舍曲林稳态血药浓度的影响Tab 1 Effects of gender, age, BMI, frequency of administration and drug combination on steady-state blood concentration of sertraline
2.2.1 性别差异对舍曲林血药浓度的影响:比较性别差异对舍曲林血药浓度的影响,男性、女性患者的舍曲林平均血药浓度分别为(81.18±53.68)、(87.61±61.02)ng/ml,女性患者服用舍曲林后的血药浓度与男性患者相比,差异无统计学意义(P>0.05);通过剂量校正对血药浓度的影响后,男性、女性患者剂量校正后的舍曲林平均血药浓度分别为(0.52±0.29)、(0.58±0.34)ng/(ml·mg)·d,女性患者剂量校正后的舍曲林血药浓度与男性患者相比,差异也无统计学意义(P>0.05),见表1。
2.2.2 年龄差异对血药浓度的影响:将患者按照年龄分为儿童组(≤12岁)、未成年人组(>12~<18岁)、成年人组(18~<65岁)以及老年人组(≥65岁),四组患者的舍曲林平均血药浓度分别为(86.77±76.73)、(76.80±46.70)、(92.23±64.31)以及(81.45±60.22)ng/ml,四组之间的差异无统计学意义(P>0.05);四组患者剂量校正后的舍曲林平均血药浓度分别为(0.63±0.39)、(0.52±0.27)、(0.58±0.35)以及(0.56±0.37)ng/(ml·mg)·d,四组之间的差异无统计学意义(P>0.05),见表1。
2.2.3 BMI对血药浓度的影响:基于中国BMI标准[10],将患者按照BMI分为低体重组(<18.5 kg/m2)、正常组(18.5~23.9 kg/m2)、超重组(24.0~27.9 kg/m2)及肥胖组(≥28 kg/m2),四组患者的舍曲林平均血药浓度分别为(96.14±76.90)、(81.60±52.70)、(93.16±54.93)及(70.28±41.56)ng/ml,四组之间的差异无统计学意义(P>0.05);但四组患者剂量校正后的舍曲林血药浓度比较,差异有统计学意义(P<0.05);四组患者的C/D分别为(0.61±0.39)、(0.58±0.30)、(0.64±0.34)及(0.47±0.23) ng/(ml·mg)·d,见表1。
2.2.4 给药频次对血药浓度的影响:将患者按照给药频次分为1日1次给药组和1日2次给药组,1日2次给药组患者的舍曲林剂量、血药浓度显著高于1日1次给药组,差异均有统计学意义(P<0.001);剂量校正后,两组之间的差异有统计学意义(P<0.05),见表1。
2.2.5 联合用药对血药浓度的影响:与舍曲林联合应用频率排序居前4位的药物为喹硫平、奥氮平、丙戊酸盐以及锂盐。比较联合应用喹硫平、奥氮平、丙戊酸盐以及锂盐与相对应的未联合应用组之间的剂量校正后舍曲林血药浓度是否存在差异,结果显示,仅联合应用奥氮平或锂盐组与相对应的未联合应用组的剂量校正后血药浓度的差异有统计学意义(P<0.05),见表1。
2.3 多重线性回归分析探究影响舍曲林血药浓度的重要因素
将本研究纳入的数据进行多重线性回归分析,探讨预测舍曲林血药浓度的重要因素,将剂量、性别、年龄、BMI、给药频次以及联合用药共同纳入回归方程中,结果显示,剂量、给药频次以及联合应用奥氮平或锂盐等4个协变量在方程中具有统计学意义(F=8.283,P<0.01,R2=0.192),见表2。
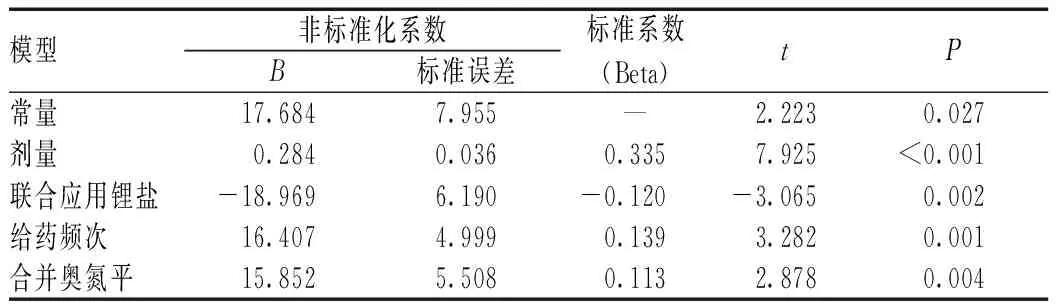
表2 多重线性回归分析——不同协变量对舍曲林血药浓度的影响Tab 2 Multiple linear regression analysis——effect of different covariates on blood concentration of sertraline
3 讨论
本研究结果提示,影响舍曲林血药浓度的因素较为复杂。舍曲林主要经肝脏中CYP酶代谢为无活性的N-去甲基舍曲林[11]。代谢酶是影响舍曲林血药浓度的重要因素,但本研究中未纳入相关的CYP酶进行研究。关于舍曲林代谢的关键CYP酶也是有争议的,AGNP精神科药物监测共识指南中显示,CYP2B6和CYP2C19会显著影响舍曲林的血药浓度,抑制CYP2B6和CYP2C19会显著影响舍曲林血药浓度[8]。也有研究结果显示,CYP2B6、CYP2C9、CYP2C19、CYP2D6和CYP3A4都会影响舍曲林代谢为N-去甲基舍曲林[12-13]。下一步应纳入CYP酶的影响因素,来进一步探讨影响舍曲林血药浓度的因素。本研究结果还显示,联合应用奥氮平可以升高舍曲林的血药浓度,可能是由于奥氮平抑制了舍曲林相关的代谢酶,使得舍曲林浓度增加,这也可能是舍曲林联合奥氮平治疗抑郁症的疗效优于单纯使用舍曲林的原因之一[14-15]。另外,许多精神药物相关研究结果显示,舍曲林在女性患者中的血药浓度显著高于男性患者[16-20];也有文献报道,性别差异对舍曲林的药动学有影响[21],但本研究结果未显示性别对舍曲林的血药浓度有影响,有可能是男性样本量偏少所致。
综上所述,舍曲林的血药浓度主要与舍曲林的剂量相关,联合应用奥氮平或锂盐也会进一步升高舍曲林的血药浓度,提示联合应用奥氮平或锂盐时可能要注意舍曲林剂量调整。另外,BMI和给药频次也会影响舍曲林的C/D,而性别、年龄以及联合应用喹硫平、丙戊酸盐并不影响舍曲林的C/D。

