慢性乙型病毒性肝炎合并NAFLD患者发生中重度肝损伤的影响因素
李生浩 ,丁 洁 ,王晴晴 ,刘思奇 ,华丽娟 ,段劲宇 ,柏保利 ,杜安瑞 ,常国楫 ,李俊义
(1)昆明市第三人民医院传染科;2)信息科,云南 昆明 650041)
慢性乙型病毒性肝炎(chronic hepatitis B,CHB)是全球重要的公共卫生问题,据估计,全球乙肝病毒感染者至少有2.4~3.5亿人,单中国便有近8 600万人,约占全球总数的25%,乙型肝炎病毒(hepatitis B virus,HBV)感染的患者由于肝硬化、肝癌等临床并发症的发生使其死亡率大大增加,CHB合并肝脂肪变性更增加了肝硬化及肝外恶性肿瘤的发生风险[1-2],危害十分严重。据统计,CHB人群中非酒精性脂肪性肝病(nonalcoholic fatty liverdisease,NAFLD)的 发 病 率 在11.4%[3]~43.7%[4]之间。NAFLD是普通人群发生肝损伤、肝纤维化、肝硬化及肝癌的的独立危险因素[5],是世界范围内肝脏相关疾病发病与死亡的首要病因[6],成为当前慢性肝病研究领域的重点和热点问题,但CHB合并NAFLD患者发生肝损伤的影响因素目前尚不十分清楚,严重限制有效防治措施的制定。
临床上主要根据丙氨酸氨基转移酶(alanineaminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、凝血酶原活动度(prothrombin activity,PTA)等肝功能相关指标将肝损伤的严重程度分为轻度、中度和重度,其中,中度或重度肝损伤是降低患者生活质量、影响日常工作、促使患者被动住院甚至导致死亡的最主要原因之一,因此,迫切需要探清CHB合并NAFLD患者发生中度或重度肝损伤的影响因素,以利于及早和精准的作出判断,从而制定有效的防治措施。
本研究回顾性分析了225例CHB合并NAFLD患者的临床资料,进行单因素和多因素分析,为CHB合并NAFLD患者发生中度或重度肝损伤的准确判断和早期诊断奠定数据基础,并为深入探索有效的防治措施从而改善其生活质量、降低住院率和死亡率提供科学的理论根据。
1 资料与方法
1.1 研究对象
选取2020年1月1日至2020年12月31日期间在昆明市第三人民医院就诊的CHB合并NAFLD患者为研究对象。纳入标准:CHB诊断标准参照2019年版《慢性乙型肝炎防治指南》[7]即:由HBV持续感染引起的肝脏慢性炎症性疾病。NAFLD诊断标准参照《非酒精性脂肪性肝病防治指南(2018更新版)》[5]。排除标准:恶性肿瘤、浆膜腔积液、细菌感染、消化道出血、肝性脑病、肾功能不全、孕产妇、心肺功能不全及临床资料不全的患者。最终225例符合纳排标准的患者临床资料将用于进行本研究的后续分析。本研究经昆明市第三人民医院伦理委员会审查批准通过。
1.2 病例分组
根据肝功能生化指标(TBIL、AST、ALT、ALB)及PTA将研究对象分为A组(120例,无肝损伤或轻度肝损伤)和B组(105例,中度或重度肝损伤)。肝损伤严重程度的判断参照第6版《传染病学》[8]的标准,即:无肝损伤(TBIL、ALB、AST/ALT均无异常)、轻度肝损伤(17.1 μmol/L <TBIL<34.2 μmol/L或ASL≥120 U/L或ALT≥120 U/L,但达不到中重度肝损伤的标准)、中度肝损伤(34.2 μmol/L≤TBIL<85.5 μmol/L或32 g/L <ALB<35 g/L或60%<PTA<70%或ASL≥120 U/L或ALT≥120 U/L,但达不到重度肝损伤的标准)、重度肝损伤(TBIL≥85.5 μmol/L或ALB≤32 g/L或PTA≤60%)。
1.3 临床资料收集
收集患者年龄、性别、体重指数(body mass index,BMI)以及就诊当日或次日空腹静脉采血检测的乙肝相关病原学[乙肝表面抗原(hepatitis B surface antigen,HBsAg)、乙肝e抗原(hepatitis B e antigen,HBeAg)、乙型肝炎病毒DNA(hepatitis B virus DNA,HBV-DNA)]、代谢相关指标[总胆固醇(total cholesterol,CHOL)、甘油三脂(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、空腹血糖(fasting plasma glucose,FPG)]、肾功能[肌酐(creatinine,CREA)、尿酸(uric acid,UA)、血尿素氮(blood urea nitrogen,BUN)]、血细胞分析[白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、血小板(plateletcount,PLT)]等常规临床资料。
1.4 统计学处理
将HBV-DNA进行对数转换。所有数据输入SPSS 26.0软件中进行统计学分析。计量资料服从正态分布用均数±标准差()表示,两组间比较采用独立样本t检验,不服从正态分布用中位数(下四分位数~上四分位数)表示,即:M(P25,P75),两组间比较采用两样本非参数秩和检验,计数资料用率(%)表示,两组间比较采用卡方检验。首先对收集到的临床资料采用上述统计学方法进行单因素分析,然后以分组作为因变量将单因素分析中筛查得到的指标全部纳入二元Logistic回归分析,探索CHB合并NAFLD患者发生中度或重度肝损伤的影响因素。P<0.05为差异有统计学意义。用GraphPad Prism 8.0软件作图。
2 结果
2.1 单因素分析
如表1所示,B组男性、HBeAg阳性占比高于A组,差异有统计学意义(均P<0.05);B组CHOL、PLT、BUN、UA、HDL-C、LDL-C水平低于A组,差异有统计学意义(均P<0.05);B组Ln(HBV-DNA)水平高于A组,差异有统计学意义(均P<0.05);BMI、CREA、WBC、RBC、HGB、TG、FPG、HBsAg在两组间的差异无统计学意义,均P>0.05。单因素分析结果显示HBeAg、CHOL、PLT、BUN、UA、HDL-C、LDLC、HBV-DNA与CHB合并NAFLD患者发生中度或重度肝损伤之间存在一定的关联关系。
表1 单因素分析CHB合并NAFLD患者发生中重度肝损伤的影响因素[/n(%)/M(P25,P75)]Tab.1 Univariate analysis of suspected influencing factors of moderate to severe liver injury in patients with CHB and NAFLD[/n(%)/M(P25,P75)]

表1 单因素分析CHB合并NAFLD患者发生中重度肝损伤的影响因素[/n(%)/M(P25,P75)]Tab.1 Univariate analysis of suspected influencing factors of moderate to severe liver injury in patients with CHB and NAFLD[/n(%)/M(P25,P75)]
*P<0.05。
2.2 多因素分析
以分组作为因变量,将上述单因素分析中筛查得到的指标全部纳入二元Logistic回归分析(Enter法),结果显示(表2、表3及图1):HBVDNA是CHB合并NAFLD患者发生中度或重度肝损伤的危险因素(OR:1.138;95%CI:1.045~1.239,P=0.003),Ln(HBV-DNA)每上升1个单位,发生中度或重度肝损伤的可能性增加13.8%;而HDL-C(OR:0.175;95%CI:0.060~0.510,P=0.001)、BUN(OR:0.726;95%CI:0.565~0.932,P=0.012)、UA(OR:0.994;95%CI:0.990~0.998,P=0.007)和PLT(OR:0.993;95%CI:0.987~0.999,P=0.017)属于CHB合并NAFLD患者发生中度或重度肝损伤的保护性因素,上述指标每下降1个单位,发生中度或重度肝损伤的可能性分别增加82.5%、27.4%、0.6%和0.7%;性别、HBeAg阳性与否、CHOL、LDL-C则不是CHB合并NAFLD患者发生中度或重度肝损伤的影响因素。

表2 变量赋值Tab.2 The variable assignment table
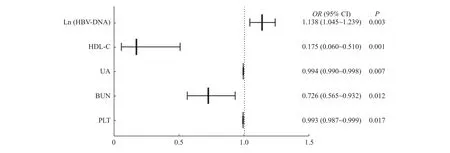
图1 CHB合并NAFLD患者发生中重度肝损伤的影响因素森林图Fig.1 Forest diagram of independent influencing factors of moderate to severe liver injury in patients with CHB and NAFLD
3 讨论
CHB是我国的重大传染病之一,HBV感染是我国肝硬化和肝癌的最主要病因[9]。NAFLD是代谢综合征累及肝脏的一种常见临床综合征,包括单纯肝细胞脂肪变性、非酒精性脂肪肝炎以及相关肝硬化甚至肝癌[10]。CHB合并NAFLD的发病率也逐年增加。研究显示,CHB患者合并肝脂肪变更容易发生肝损伤,可能与内质网应激、胰岛素抵抗、脂毒性、遗传、肠道微生物[11]有关,也有报道称低HbsAg水平CHB患者可能更易发生肝脂肪变性[12]。目前,CHB合并NAFLD患者发生中度或重度肝损伤的影响因素尚不十分清楚,不利于有效防治策略的制定。
本研究中,通过对CHB合并NAFLD患者的临床资料进行分析发现性别、PLT、BUN、UA、HDL-C、LDL-C、HBV-DNA、HBeAg与肝损伤的严重程度相关,其中,PLT、BUN、UA、HDL-C和HBV-DNA是CHB合并NAFLD发生中重度肝损伤的影响因素。众所周知,HBV-DNA持续高表达可使肝脏发生炎症,是肝硬化、肝癌发生的重要原因之一。乙肝病毒X蛋白是由HBV-DNA编码的一种蛋白,可通过调控法尼醇X受体/肝X受体/胆固醇调节元件结合蛋白和过氧化物酶体增殖物激活受体γ等靶点从而引起脂质代谢紊乱,使得甘油三酯在肝脏蓄积,最终导致肝脏发生炎症反应[13]。同时由于炎症反应持续存在,激活磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白介导了自噬,促进HBsAg和乙肝核心抗体的mRNA表达增加,导致HBV-DNA复制活跃,进一步加重肝损伤[14-15]。这与本研究的中重度肝损伤患者HBV-DNA载量更高的现象相吻合。
另有研究发现,血小板减少与肝脏损害程度密切相关,可能是因为肝脏是表达凝血因子和促血小板生成因子的重要器官,肝功能进行性损伤时,促血小板生成素合成能力下降,进而导致血小板生成减少[16]。本项研究也进一步证实了中重度肝损伤患者血小板水平低于无肝损伤或轻度肝损伤患者。
中重度肝损伤组患者中LDL-C和HDL-C水平低于无肝损伤或轻度肝损伤者。在肝损伤早期,脂质合成的关键酶活性明显增加,LDL-C水平升高,然而随着肝损伤的加重,肝脏合成功能降低,LDL-C水平随之降低,其对肝损伤严重程度的预测起重要作用。HDL-C可逆向转运肝脏中胆固醇,属于防止代谢性疾病的保护性因素[15],当肝脏发生严重损害时,机体大量消耗HDL-C,胆固醇转运能力下降[17],所以,HDL-C作为CHB合并NAFLD患者发生明显肝损伤的影响因素是合理的。当肝脏受到严重损害时,内源性血管活性物质失衡,缩血管因子释放增加引起肾血管明显收缩,可导致BUN及UA升高[18],说明BUN及UA与肝损伤之间存在一定的关联关系。本研究中BUN和UA属于CHB合并NAFLD患者发生明显肝损伤的保护性因素,其具体机制尚不明确。
综上所述,PLT、BUN、UA、HDL-C、HBVDNA可作为CHB合并NAFLD发生中重度肝损伤的早期诊断指标,对于临床上预测CHB合并NAFLD患者发生明显肝损伤具有重要的应用价值。更重要的是这些指标在基层医院就可以完成,具有普适性,容易实现早发现、早诊断、早治疗,有利于提高这类人群的生活质量、降低住院率和死亡率。但该研究属于回顾性研究,且样本量较小,仍需更大样本量的前瞻性队列研究加以证实,另外,PLT、BUN、UA、HDL-C、HBV-DNA影响CHB合并NAFLD患者肝损伤程度的机制尚不十分清楚,有待进一步深入研究。

