穗花杉双黄酮对过氧化氢诱导血管内皮细胞氧化应激损伤的影响
何锋荣 操龙斌 张琳 郑介婷 邱欣 邱峰南方医科大学南海医院医学检验科,广东 5844;南方医科大学中医药学院,广州 5055
动脉粥样硬化(atherosclerosis,AS)是由环境和遗传等多种因素共同作用所导致的一类长期且复杂的血管病变,是冠心病、脑血管病和血栓栓塞性疾病等缺血性心脑血管病的主要病理基础[1-2]。血管内皮细胞是直接暴露于循环系统中代谢产物等相关内源性危险因子的细胞,氧化应激诱导血管内皮细胞损伤对AS形成和发展中的诸多病理学环节均具有重要作用[3]。因此,寻找能够对抗活性氧引起的氧化应激损伤对治疗动脉粥样硬化具有重要临床意义。我们前期研究发现,穗花杉双黄酮(AF)可有效保护羟基自由基(•OH)氧化诱导的细胞损伤,但具体机制不明,既往也没有研究。本研究用过氧化氢(H2O2)处理血管内皮细胞,构建氧化应激损伤的血管内皮细胞模型,采用不同浓度的AF干预。观察AF对内皮细胞活力、凋亡等指标的影响,检测相关细胞因子、基因、蛋白表达情况。旨在初步探索穗花杉双黄酮对巨噬细胞极化的分子调控作用,为动脉粥样硬化提供新的治疗靶点和理论依据。
1 材料与方法
1.1 实验材料、试剂 人脐静脉内皮细胞系(HUVECs)购自美国ATCC,RPMI1640培养基、双抗(青霉素-链霉素)、胰蛋白酶(Hyclone)、胎牛血清(FBS)购自赛默飞世尔生物化学制品(北京)有限公司,AF、二甲基亚砜(DMSO)、3%H2O2购自美国Sigma公司,细胞计数试剂盒8(cell counting kit-8,CCK-8)检测试剂购自东仁化学科技上海有限公司,乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所,Hoechst 33258染色液及Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,抗体Bcl-2、Bax、Bcl-x、Cleaved-caspase3、GAPDH 购自美国 Cell Signaling Technology(CST)公司。
1.2 细胞培养与分组 HUVECs细胞用含有10%热灭活FBS和10 U/ml青霉素、10μg/ml链霉素的RPMI1640培养液,在37℃、5%CO2培养箱中静置培养,维持细胞数1×108/培养瓶左右。胰酶消化细胞稀释成1×106/ml,接种于对应的培养皿中,用于后续实验。细胞分组:对照组、H2O2组、H2O2+AF组。对照组为单纯HUVECs培养,H2O2组为单纯HUVECs培养基础上加入H2O2,终浓度为300μm。H2O2+AF组为含300μm H2O2+不同浓度的AF共孵育。
1.3 CCK-8测定 细胞毒性检测:在96孔板中每孔加入HUVECs细胞(1×105/ml)100μl的细胞悬液,设置5个复孔,待细胞贴壁后,饥饿12 h,在每组中加入AF 0.0、5.0、10.0、20.0、40.0、80.0、100.0μm分别于24、48、72 h后,按照CCK-8说明书进行检测确定实验的安全浓度。细胞增殖检测:按上述方法将细胞铺板,待细胞贴壁后,细胞分组,300μm H2O2处理24 h加不同浓度的AF,作用规定时间后分别加入20μl CCK-8溶液,37℃避光孵育30 min,检测450 nm吸光度,与对照组比较细胞存活率。
1.4 ELISA法检测细胞上清液中相关细胞因子含量将建模成功的HUVECs细胞每孔以1×106个接种于24孔板中,每孔加入不同浓度AF药物处理24 h。按照ELISA试剂盒说明书操作,检测细胞上清中LDH、SOD的表达水平。
1.5 Wound healing实验 培养板接种细胞之前先用Marker笔在24孔板背面画横线标记,细胞消化后每孔接入5×104个HUVECs细胞,每组设立3个复孔,细胞铺满板底后,用20μl微量移液枪头在单层细胞上呈“|”字形划痕,制造细胞创伤模型,吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。300μm H2O2处理12 h后加入低血清浓度的MPMI1640培养基配制的含不同浓度AF的药物培养基培养,分别在划痕0 h和48 h时观察创伤愈合程度,并用显微镜在100倍视野下拍照(目镜10×,物镜10×)。
1.6 细胞凋亡检测 流式细胞术检测:取2 ml HUVECs细胞以5×105个/ml密度接种于12孔板中,待贴壁后300μm H2O2处理14 h加不同浓度的AF培养箱内孵育24 h。孵育后,用不含EDTA的胰酶消化,1 000转/min(离心半径为10 cm),4℃离心5 min收集细胞。预冷的PBS洗涤细胞2次,每次均在1 000转/min(离心半径为10 cm),4℃离心5 min。收集约(1~5)×105个细胞。100μl 1×Binding Buffer重悬细胞混匀。每管加入5μl Annexin V-FITC和5μl PI,轻轻混匀后室温避光反应10 min。反应结束后,每管加入400μl 1×Binding Buffer,混匀,1 h内上流式细胞仪检测。荧光染色:对数生长期细胞接种于12孔板,待贴壁后300μm H2O2处理24 h加不同浓度的AF培养箱内孵育24 h。小心吸去培养基,冷PBS清洗2次后每孔加入DAPI染液或Hochest 33258染液0.5 ml室温避光反应20~30 min。PBS清洗3次,每次5 min。荧光显微镜下紫外光激发观察采像。
1.7 Western blot法检测蛋白表达水平 取4 ml HUVECs细胞以2.5×104个/ml密度接种于6孔板中,实验分组同上。规定时间后收集细胞,冰上裂解30 mim,12 000转/min(离心半径为10 cm)离心30 min,吸取上清液,用BCA蛋白浓度测定试剂盒(碧云天生物)检测总蛋白浓度,将裂解液蛋白(50~100μg)进行8%~15%SDS-PAGE,电泳转移至聚偏二氟乙烯膜(Amersham Bioscience)上。印迹后,将膜与特异性一抗在4℃孵育过夜。与HRP连接的二抗杂交后,通过增强的化学发光检测试剂[Amersham Biosciences,中国(代理)]显可视化蛋白质条带。
1.8 统计分析方法 实验数据采用SPSS 25.0统计软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,多组比较采用单因素方差分析及双因素方差分析,组间比较采用独立样本t检验,P<0.05认为差异有统计学意义。
2 结 果
2.1 AF对细胞的毒性作用 CCK-8检测结果表明,随着AF浓度的增加和作用时间的延长,其抑制细胞的增殖效果增强,且高浓度具有杀伤作用。AF对HUVECs细胞24、48、72 h的IC50值分别为(54.57±4.28)μm、(15.97±4.13)μm和(7.55±1.87)μm。根据实验结果,选择5μm、10μm浓度进行后续实验。
2.2 AF对H2O2损伤的细胞增殖活力的影响 CCK-8检测结果表明,药物作用48 h后,H2O2组与H2O2+AF组比较,差异有统计学意义。两两比较,H2O2作用24 h能显著抑制HUVECs的增殖,差异有统计学意义(P<0.05);应用AF(10μm)处理后,能显著逆转H2O2诱导的HUVECs细胞生长增殖抑制,提 高 细 胞 存 活 率(P<0.01)。见图1。
2.3 AF对H2O2诱导的细胞LDH含量和SOD活性水平的影响 ELISA法检测结果显示:与对照组相比,H2O2诱导后的HUVECs细胞LDH[(85.75±2.97)U/ml]升高,SOD[(11.01±0.84)U/ml]活性水平降低。与H2O2组比较,AF干预后能使SOD活性水平上调,而使LDH表达水平下调。特别是10μm的AF可使LDH表达水平下调至(40.78±0.97)U/ml,SOD活性水平上调至(15.98±1.86)U/ml(P<0.05)。见图2。这说明AF能改善H2O2对细胞的氧化损伤作用。
2.4 不同剂量AF对H2O2诱导的HUVECs细胞迁移能力的影响 Wound healing实验证明HUVECs细胞在H2O2作用下横向迁移能力减弱,差异有统计学意义(P<0.05);而AF能有效促进细胞的迁移,其效果具有浓度依赖性,即与H2O2组比,各浓度H2O2+AF组HUVECs的迁移能力显著提高,差异均有统计学意义(均P<0.05)。见图3。

图1 AF对H2O2诱导的HUVECs细胞增殖的影响(n=3)

图2 AF对H2O2诱导的细胞LDH含量和SOD活性水平的影响(n=3,A为AF对H2O2诱导的细胞LDH含量的影响,B为AF对H2O2诱导的细胞SOD活性水平的影响)

图3 AF和H2O2对HUVECs迁移能力的影响(n=3,A为各组Wound healing实验图片,B为各组划痕面积比值)
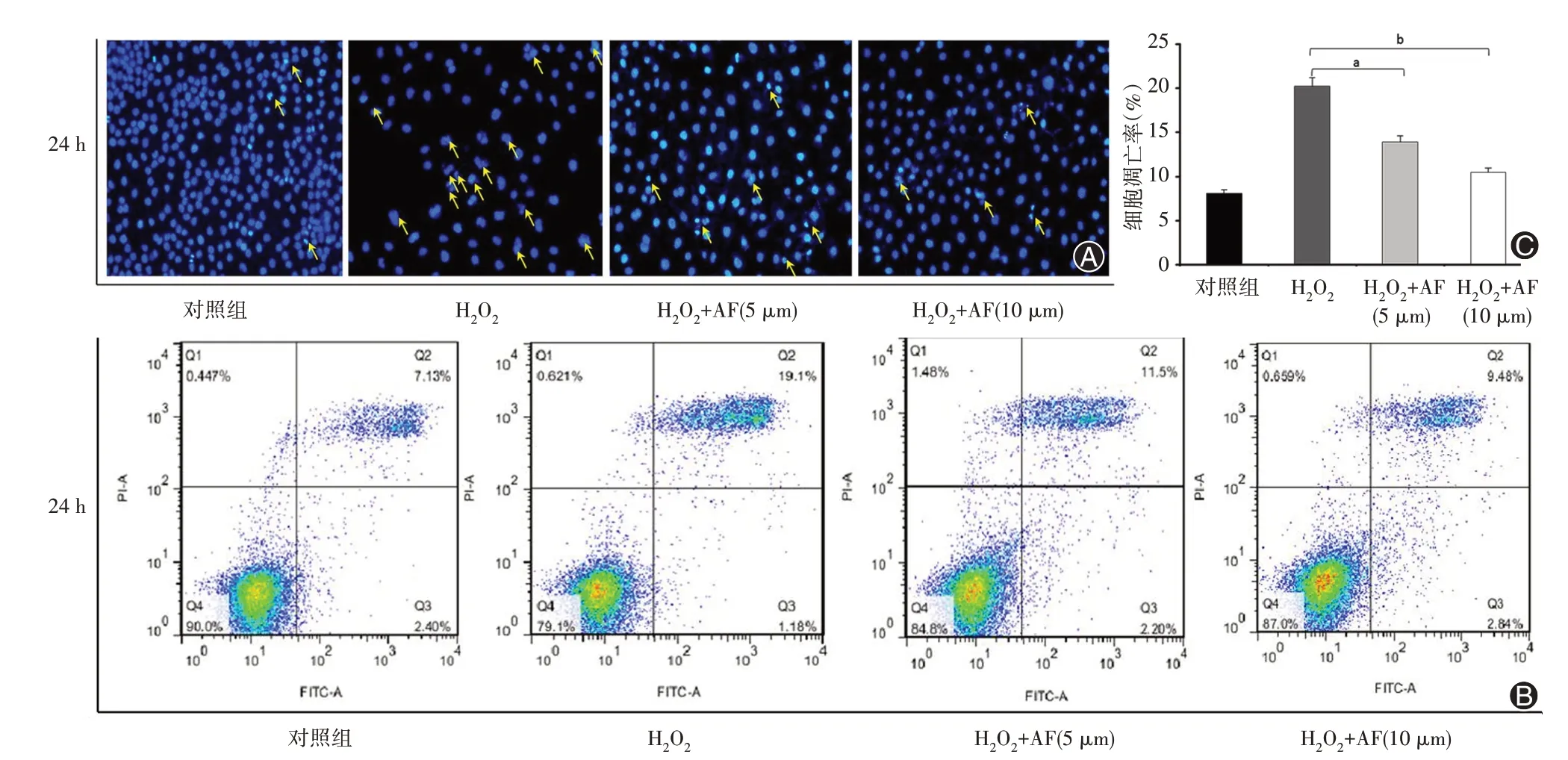
图4 AF干预H2O2诱导的HUVECs凋亡情况(n=3,A为Hochest33258染色荧光显微镜图片×200,B为流式细胞术各区比例图片,C为实验组与H2O2组细胞凋亡率比值)
2.5 不同剂量AF对H2O2诱导的HUVECs凋亡的影响 为了解AF是否干预H2O2诱导的HUVECs凋亡情况,利用Hochest33258染色荧光显微镜观察法和流式细胞术分析不同浓度解AF处理后的情况。结果发现AF减少H2O2诱导的HUVECs凋亡,且有浓度依赖性。Hochest33258染色荧光显微镜观察到作用48 h后,10μm AF明显减少H2O2诱导的HUVECs凋亡(P<0.01)。流式细胞术统计到对照组、H2O2组、H2O2+AF(5μm)组、H2O2+AF(10μm)组的细胞[早期凋亡区域(Q3)和晚期凋亡区域(Q2)]凋亡率分别为(8.57±0.86)%、(20.64±0.90)%、(13.05±2.57)%、(11.23±1.74)%,10μm AF明显减少H2O2诱导的HUVECs Q3和Q2的比例(P<0.01)。见图4。
2.6 不同剂量AF对H2O2诱导的HUVECs细胞相关蛋白表达水平影响 在上述表型实验的基础上,我们推测AF可能对凋亡相关蛋白有影响。Western blot检测结果显示,H2O2诱导的细胞中,药物同步处理24 h后,促凋亡蛋白Bax下调,抗凋亡蛋白Bcl-2和Bcl-x上调,凋亡执行因子Cleaved-caspase-3蛋白表达下调(图5)。
3 讨 论
AS是由环境和遗传等多种因素共同作用所导致的一类长期且复杂的血管病变,是目前对人类健康影响最严重、最常见的慢性病之一,是冠心病、脑血管病和血栓栓塞性疾病等缺血性心脑血管病的主要病理基础[4]。目前,AS发病的炎症机制学说得到诸多研究的证实,炎性细胞与血管内皮细胞、平滑肌细胞、细胞外基质之间相互作用调控着AS的发生、发展及消退。AS病理过程中的多种危险因子例如高糖、氧化型低密度脂蛋白、胆固醇晶体、活性氧自由基、高同型半胱氨酸等均参与AS发生发展[5],但是这些物质参与AS的发生发展的机制未明。AS的抗炎治疗也得到国际医学界认可,中医药可通过调控巨噬细胞极化改善动脉粥样硬化斑块稳定性,在防治AS易损斑块中展现良好的应用前景[6-7]。他汀治疗率低、依从性差,患者使用他汀后的不良反应(肌病或肝酶升高)严重,依哲麦布降低低密度脂蛋白胆固醇的幅度有限,只能辅助治疗且对肝脏有损伤[8-10]。因此,寻找安全、有效的抗AS新药势在必行。AF是一种黄酮类中药单体,既往的研究显示它有抗炎、抗氧化等作用[11]。AF可有效保护•OH氧化诱导的细胞损伤,但具体机制不明,既往少有文献报道。

图5 AF对H2O2诱导的细胞中凋亡相关蛋白影响
活性氧自由基(reactive oxidative species,ROS)包括H2O2、氧自由基(O-)、超氧自由基(O2-)、•OH等,其中H2O2、是细胞内最主要、最早期的两类ROS[12]。ROS是通过外源环境和细胞自身或作为其他生物学反应的副产物而生成,它可引起血管内皮细胞凋亡,但机制尚未明确。细胞内大多数的ROS都来源于细胞内线粒体中的呼吸链反应,并随之产生具有毒性的代谢副产物[13];在线粒体氧化磷酸化电子传递过程中,2%~4%的氧气没有被还原产生水而是转变为ROS[14]。线粒体被认为是细胞内ROS来源的主要亚细胞结构,线粒体膜上的许多氧化还原酶也会产生ROS,线粒体至少拥有10个能够产生ROS的位点[12]。除了线粒体外,过氧化物酶体、内质网、质膜、溶酶体等也都能产生ROS[12]。ROS这种复杂的角色使其在生物代谢过程中必须受到严格的控制,任何细胞内ROS水平的改变,则很可能导致细胞内部活性的变化。
本研究显示,10μm的AF可使LDH表达水平下调至(40.78±0.97)U/ml,SOD活性水平上调至(15.98±1.86)U/ml(P<0.05)。HUVECs在H2O2作用下横向迁移能力减弱,而AF能有效促进细胞的迁移,其效果具有浓度依赖性。另外,利用Hochest33258染色荧光显微镜观察法和流式细胞术分析不同浓度AF处理后,发现AF减少H2O2诱导的HUVECs凋亡,10μm AF明显减少H2O2诱导的HUVECs Q3和Q2的比例(P<0.01)。这些表型实验说明AF有效调节ROS水平可抑制血管内皮细胞凋亡。
过高的ROS可造成线粒体损伤,诱导线粒体内细胞色素C释放入胞浆进而激活Caspase级联反应,最终通过线粒体凋亡途径诱发凋亡[15]。因此本实验对这个基因转录水平均进行了检测,Western blot检测结果显示AF可下调H2O2诱导的凋亡执行因子Cleaved-caspase 3蛋白表达。细胞凋亡过程中细胞色素C的释放受Bcl-2家族蛋白调控,其中抗凋亡Bcl-2蛋白与促凋亡Bax蛋白常被用来评价线粒体完整性和Caspase级联反应激活程度,是决定细胞凋亡的关键[16]。为了进一步探究AF降低细胞凋亡的机制,本实验重点观察了Bcl-2、Bax及Bcl-x蛋白的表达情况,结果显示,血管内皮细胞经H2O2诱导氧化损伤后,Bcl-2和Bcl-x蛋白下调,Bax蛋白上调;而AF处理能够上调Bcl-2和Bcl-x蛋白,下调Bax蛋白,提示AF可能通过上调Bcl-2/Bax蛋白比值,从而减少细胞凋亡,但具体机制尚需进一步研究。
综上所述,中药单体AF能对血管内皮细胞的氧化应激损伤具有保护作用,其机制可能与抑制Cleaved-caspase-3级联反应,上调Bcl-2和Bcl-x蛋白,下调Bax蛋白,减少细胞凋亡有关,但对细胞更深层次机制还需进一步研究。
利益冲突:作者已申明文章无相关利益冲突。

