水杨酸对NaHCO3胁迫下桂西北喀斯特地区青冈栎种子萌发的影响
邓 平,赵 英,王 霞,陈秋佑,吴 敏*
(1.玉林师范学院,桂东南珍稀经济物种保护利用重点实验室培育基地,广西 玉林 537000;2.西北农林科技大学林学院,陕西 杨凌 712100)
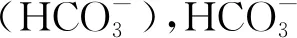
水杨酸(salicylic acid,SA)是高等植物体内普遍存在的一种内源性激素,可作为植物抗逆反应的信号分子,并激活其防御保护系统,在植物的抗逆过程中起关键作用[5-6]。研究表明,施用一定浓度的外源SA能诱导种子产生许多抗盐性状,缓解盐胁迫对种子的伤害,提高种子对盐胁迫的适应性[7-8]。例如,Nimir等[9]研究发现在100和200 mmol/L NaCl胁迫下,用360.0 μmol/L SA浸泡高粱(Sorghumbicolor)种子,可以显著提高种子萌发率、蛋白质含量和超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛(malondialdehyde,MDA)含量。Asadi等[10]对NaCl胁迫鹰嘴豆(Cicerarietinum)种子萌发试验发现,用1.5和3.0 mmol/L SA浸种均可以增加种子抗氧化酶活性,降低脯氨酸和MDA含量,提高其耐盐性。Bagheri[11]和Yadav等[12]研究也发现在NaCl胁迫下,用低浓度的SA浸种玉米(Zeamays)通过提高其过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性及总蛋白质含量,减轻盐胁迫下细胞的膜脂过氧化程度,降低细胞膜渗透率。此外,国内学者对花椰菜(Brassicaoleraceavar.botrytis)、菜豆(Phaseo-lusvulgaris)、甘草(Glycyrrhizauralensis)和羽衣甘蓝(B.oleraceavar.acephala)等研究也发现,添加适当浓度SA能够相对提高盐胁迫条件下种子萌发的数量、速度和质量,提高渗透调节能力和抗氧化能力[13-16]。综上所述,国内外关于SA对盐胁迫下种子萌发影响的报道主要集中在农作物和园艺产品的研究,而针对SA作用于重碳酸盐胁迫下生态树种种子萌发的研究鲜见报道。
青冈栎(Cyclobalanopsisglauca)为壳斗科青冈属,是喀斯特亚热带常绿落叶阔叶混交林建群种之一,对岩溶环境具有较强的适应性,是该地区植被恢复的优良造林树种[17]。前期野外调查发现,青冈栎虽结实量大,但其生境土层浅薄、重碳酸盐含量高,种子萌发率低,影响其植物体重建,限制种群自然更新。目前,针对青冈栎的研究主要集中在种群生殖生态、人工林培育、种苗抗旱性等方面[18-22],但从生理生态学角度系统研究SA对重碳酸盐胁迫下青冈栎种子萌发影响的研究鲜见报道。因此,本试验通过配制不同浓度的NaHCO3溶液,研究喀斯特地区土壤中重碳酸盐对青冈栎种子萌发特性以及有机渗透调节物质含量、抗氧化保护酶活性变化的影响;用低浓度SA溶液浸种,以期阐明SA对重碳酸盐胁迫下青冈栎种子萌发是否有促进作用;揭示影响种子萌发的条件,为喀斯特地区青冈栎的推广造林、植被恢复与重建提供理论参考。
1 材料与方法
1.1 试验材料
试验地位于青冈栎种群分布核心区桂林市雁山区大埠乡甘棠村后山(110°18′~110°22′E,25°01′~25°03′N),海拔150~210 m,阳坡或半阳坡,坡度9°~11°。其中,青冈栎平均树高(13.43±3.98)m,平均胸径(21.54±4.73)cm。于2016年11月12—22日,选择树势健壮、树冠发育良好、无病虫害的母树,采集其成熟种子,放于牛皮袋标记保存带回实验室。在实验室清洗并筛选出下沉健康饱满的种子,自然阴干,置于4 ℃冰箱储存。
1.2 试验设计
于2016年12月12日起,取大小相近、饱满的种子分别用游标卡尺(精度0.01 cm)、电子天平(精度0.01 g)和TTC染色法,测定种子平均百粒质量、单粒种子的纵径和横径、新鲜种子活力,上述指标均重复3次取平均值。最终选取供试种子百粒质量(428.03±18.79)g、纵径(2.19±0.28)cm和横径(1.98±0.32)cm、活力为90%以上。种子在水中浸泡48 h后,用质量分数0.5%高锰酸钾溶液消毒30 min,再用蒸馏水冲洗3次,滤纸吸干表面备用。
分别用0、0.05、0.10、0.50、1.00、2.00和4.00 mmol/L的SA对青冈栎种子萌发进行预实验(每个梯度100粒种子),发现0.50 mmol/L SA浸种12 h的青冈栎种子,其萌发周期短、速度快,萌发率最高(图1),因此,0.50 mmol/L 为促进青冈栎萌发的SA合理浓度。重碳酸盐胁迫通过配制不同浓度NaHCO3溶液获得,共设7个浓度梯度,分别为0、24、48、72、96、120、144 mmol/L;SA处理共设2个梯度,浓度分别为0和0.50 mmol/L;其中7个NaHCO3胁迫梯度处理开始前用清水(0 mmol/L SA)浸种12 h,另外7个NaHCO3胁迫梯度处理开始前用0.50 mmol/L SA浸种12 h,共计14个处理,每个处理5个重复,每个重复20粒种子,故每个处理共计100粒种子。培养皿(20 cm × 20 cm)和培养基质(珍珠岩)在105 ℃烘箱消毒2 h;青冈栎种子播于3层医用脱脂纱布下铺有消毒珍珠岩(厚度2 cm)的培养皿中,每个培养皿放种子20粒(预先用清水或0.50 mmol/L SA浸泡);最后向培养皿中加入40 mL不同浓度的NaHCO3,每3 d更换1次培养基,置于恒温25 ℃智能人工气候箱内(BIC-400型,上海博迅医疗生物仪器公司),相对湿度60%,周期性光照处理:光12 h/暗12 h,光照强度200 μmol / (m2·s),实验共进行28 d。

图1 SA处理下青冈栎栓皮栎种子萌发动态
1.3 指标测定方法
1.3.1 发芽指标测定
以种子露白为发芽标志,从实验开始的第2天起,每天18:00记录发芽种子数量,测量胚根长度。在实验末期,当连续3 d青冈栎种子萌发数量不足供试种子总数的1%时,视为发芽实验结束[23]。按下列公式计算种子发芽率、发芽指数、活力指数[24-25]:
发芽率=种子发芽数/供试种子数×100%;
发芽指数=逐日发芽数/对应的发芽天数;
活力指数=发芽指数×幼苗鲜质量;
耐盐指数=处理组活力指数/对照组活力指数×100%;
相对盐害率=(对照组发芽率-处理组发芽率)/对照组发芽率×100%。
1.3.2 生理指标测定
待种子发芽实验结束时(第28天),从各处理中选择胚根长度>5 cm,且未萌发出胚芽的种子以液氮速冻,超低温保存,统一进行种子保护酶、有机渗透调节物质和丙二醛(MDA)含量的测定。超氧化物歧化酶(SOD)活性测定用氮蓝四唑(NBT)法,设A560下抑制NBT光化还原50%所需酶量为1个酶活力单位(记为U);过氧化物酶(POD)活性测定用愈创木酚热色法,以1 min内A470变化0.01为1个过氧化物酶活性单位(U);过氧化氢酶(CAT)活性测定用紫外线吸收法,以1 min内A240减少0.1的酶量为1个酶活性单位(U)。可溶性糖含量、可溶性蛋白和脯氨酸含量分别用蒽酮法、考马斯亮蓝G-250和磺基水杨酸-酸性茚三酮显色法测定。丙二醛(MDA)含量用硫代巴比妥酸(TBA)法测定。以上生理指标的测定均参考李合生[26]的方法,每个指标重复测定3次,取其平均值。
1.4 数据分析
用SPSS 18.0软件进行单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD)检验比较相同SA处理下,不同浓度NaHCO3处理间青冈栎种子萌发的差异显著性;用独立样本t检验比较相同浓度NaHCO3处理下,不同浓度SA处理间种子萌发的差异显著性。使用Origin 9.0软件绘图。
2 结果与分析
2.1 SA处理对NaHCO3胁迫下青冈栎种子萌发参数的影响
经测定发现(图2A),无SA处理时,随NaHCO3胁迫浓度的增加,青冈栎种子发芽率显著下降(P< 0.05);经SA处理后,随NaHCO3胁迫浓度的增加,发芽率呈先降后升再下降的趋势,但当NaHCO3浓度分别为0和72 mmol/L时,发芽率均高于对照组,且在NaHCO3浓度为72 mmol/L时,发芽率最高(80.00±6.13)%。在相同NaHCO3胁迫浓度处理下,SA处理后青冈栎种子发芽率均高于无SA处理组,其中当NaHCO3浓度为24、48、72和96 mmol/L时,分别比无SA处理组显著增加了16.67%、25.21%、45.45%和14.29%(P< 0.05)。
从图2B、2C可以看出,无SA处理时,在不同NaHCO3浓度胁迫下青冈栎种子发芽指数与活力指数均显著低于对照组(P< 0.05);经SA处理后,随着NaHCO3浓度的增加,种子的发芽指数与活力指数均呈先降后升再下降的趋势,当NaHCO3为浓度72 mmol/L时,发芽指数与活力指数达到峰值分别为10.87±0.99和48.15±3.44,且当NaHCO3浓度为0~72 mmol/L时二者的值均高于对照组。在NaHCO3浓度为24~144 mmol/L时,经SA处理青冈栎种子的发芽指数和活力指数总是显著高于无SA处理组(P< 0.05)。

不同小写字母表示在相同浓度SA处理下,不同浓度NaHCO3处理间差异显著(P < 0.05);*和**表示在相同浓度NaHCO3处理下,不同SA浓度间差异显著;*.P<0.05;**.P<0.01。下同。The different lowercase letters indicate significant differences in the same SA concentration among different salt treatments at 0.05 level. * and ** indicate significant differences in the same treatment under different SA concentrations at 0.05 and 0.01 level. The same below.
2.2 SA处理对NaHCO3胁迫下青冈栎种子萌发耐盐指数和相对盐害率的影响
由SA对NaHCO3胁迫下青冈栎种子萌发耐盐指标(表1)来看,无SA处理时,各NaHCO3浓度下的青冈栎种子耐盐指数均显著低于对照组(P< 0.05);经SA处理后,当NaHCO3浓度为48和72 mmol/L时,耐盐指数均高于对照组,分别比对照增加了16.74%和29.34%。在相同浓度NaHCO3胁迫处理下,经SA处理后种子的耐盐指数均显著高于无SA处理组(P< 0.05)。
无SA处理时,随NaHCO3胁迫浓度增加,青冈栎种子的相对盐害率迅速显著增加(P< 0.05,见表1)。经SA处理后,当NaHCO3胁迫浓度为0~120 mmol/L处理组时,相对盐害率均显著低于无SA处理组(P< 0.05),且在NaHCO3浓度为0和72 mmol/L时,种子未受到毒害,其中在72 mmol/L NaHCO3胁迫下,种子的相对盐害率最低。但当NaHCO3胁迫浓度为144 mmol/L时,即使种子经0.50 mmol/L SA处理也未能显著降低相对盐害率(P> 0.05)。

表1 SA处理对NaHCO3胁迫处理下青冈栎种子耐盐指数、相对盐害率的影响(n=5)
2.3 SA处理对NaHCO3胁迫下青冈栎种子丙二醛含量的影响
由SA对NaHCO3处理下青冈栎种子丙二醛含量的影响(图3)可以看出,无SA处理时,随NaHCO3胁迫浓度增加,青冈栎种子丙二醛(MDA)含量极显著增加(P< 0.01);经SA处理后,随NaHCO3浓度增加,其MDA含量呈波动性变化,在NaHCO3胁迫浓度为0~72 mmol/L时,其含量均低于对照组,其中当NaHCO3胁迫浓度为24 mmol/L,其MDA含量最低,比对照组减少了12.75%。在相同NaHCO3胁迫浓度下,经SA处理的青冈栎种子MDA含量均显著低于无SA处理组(P< 0.05)。
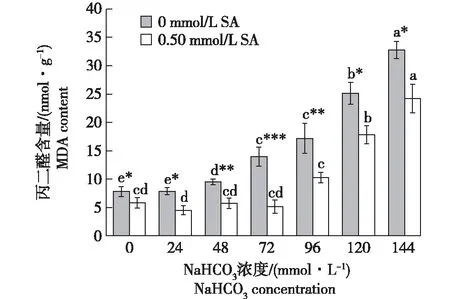
图3 SA处理对NaHCO3胁迫处理下青冈栎种子丙二醛含量的影响(n=3)
2.4 SA处理对NaHCO3胁迫下青冈栎种子抗氧化酶活性的影响
由SA对NaHCO3胁迫下青冈栎种子抗氧化酶活性的影响(图4A)可知,无SA处理时,随NaHCO3胁迫浓度增加,青冈栎种子的SOD活性呈波动性变化,但均显著低于对照组(P< 0.05);经SA处理后,随NaHCO3胁迫浓度增加,其SOD活性先增加后减少,当NaHCO3胁迫浓度为24~72 mmol/L时,其SOD活性均高于对照组,且在72 mmol/L NaHCO3时,SOD活性达到峰值(10 122±473)U/g。当NaHCO3浓度为24~144 mmol/L时,经SA处理的种子SOD活性均极显著高于无SA处理组(P< 0.01)。

图4 SA处理对NaHCO3胁迫处理下青冈栎种子抗氧化酶活性的影响(n=3)
由图4B可知,在0和0.50 mmol/L的SA处理下,随NaHCO3胁迫浓度的增加,青冈栎种子的POD活性均是先增加后减少,但其活性均高于对照组;且经SA处理后,NaHCO3浓度为72 mmol/L时,POD活性到达峰值(1 199±72)U/(g·min)。在相同浓度NaHCO3胁迫处理下,SA处理组种子POD活性均极显著高于无SA处理组(P< 0.01)。
由图4C可以看出,在0和0.50 mmol/L的SA处理下,随NaHCO3胁迫浓度的增加,青冈栎种子的CAT活性均是先增后减;仅在无SA处理,NaHCO3胁迫浓度为144 mmol/L时,其活性低于对照组;而经SA处理后,NaHCO3浓度为96 mmol/L时,CAT活性达到峰值(460±26)U/(g·min)。在相同浓度NaHCO3胁迫处理下,SA处理组种子CAT活性也均显著高于无SA处理组(P< 0.05)。
2.5 SA处理对NaHCO3胁迫下青冈栎种子渗透调节物质的影响
由SA处理对NaHCO3胁迫下青冈栎种子渗透调节物质含量的影响(图5A)可知,无SA处理时,随NaHCO3胁迫浓度增加,青冈栎种子可溶性糖含量整体呈增加趋势,且当NaHCO3浓度为96~144 mmol/L时,其可溶性糖含量显著高于对照组(P< 0.05);经SA处理后,随NaHCO3胁迫浓度增加,可溶性糖含量先增加后减少,且均高于对照组,当NaHCO3浓度为72 mmol/L时,可溶性糖含量达到峰值(7.43±0.34)mg/g。在相同浓度NaHCO3胁迫处理下,经SA处理后种子可溶性糖含量均显著高于无SA处理组(P< 0.05)。
由图5B和5C可知,无SA处理时,随NaHCO3胁迫浓度增加,青冈栎种子可溶性蛋白和脯氨酸含量均先增加后减少,且高于对照组;经SA处理后,随NaHCO3胁迫浓度增加,可溶性蛋白含量呈波动性变化,而脯氨酸含量则先增后减,但二者含量均高于对照组,在NaHCO3胁迫浓度为72 mmol/L时,可溶性蛋白和脯氨酸含量均达到峰值,分别为(0.43±0.04)mg/g和(250±34)μg/g。在相同浓度NaHCO3处理下,经SA处理后种子可溶性蛋白和脯氨酸含量均显著高于无SA处理组(P< 0.05)。
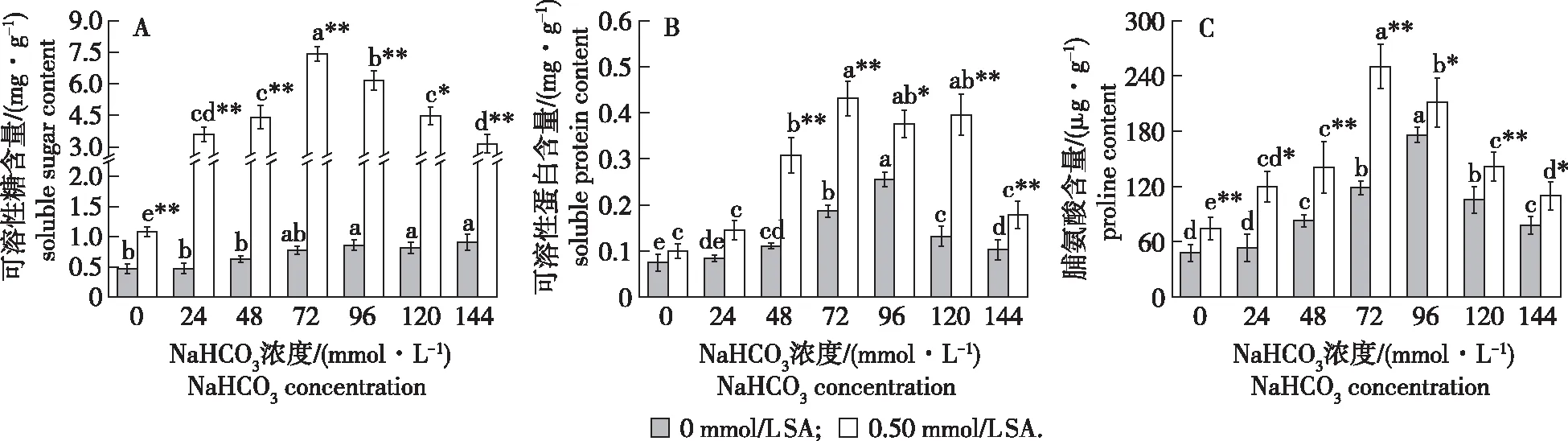
图5 SA处理对NaHCO3胁迫处理下青冈栎种子渗透调节物质含量的影响(n=3)
3 讨 论
种子萌发是植物生命周期的第一阶段,是决定喀斯特森林植被能否成功定居建植的关键因素;若此阶段受到重碳酸盐胁迫,种子萌发特性常表现为发芽率下降,萌发进程延迟,甚至导致种子代谢紊乱,失去生活力而致死[27]。然而,外源水杨酸(SA)能够调节植物体内多种新陈代谢过程和生理反应,在盐胁迫等逆境下影响植物种子的萌发及生长[28]。本研究结果显示,无SA处理时,NaHCO3胁迫抑制了青冈栎种子的萌发;而经SA处理后,对NaHCO3胁迫下青冈栎种子萌发能力和生理指标产生了不同程度的影响,一定程度上提高了青冈栎种子对重碳酸盐的耐受力,降低了重碳酸盐对青冈栎种子萌发的伤害。
3.1 无SA处理时,NaHCO3对青冈栎种子萌发的影响
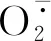
3.2 SA处理下,NaHCO3对青冈栎种子萌发的影响
SA通过复杂的信号转导网络参与调节与盐胁迫相关的代谢反应,能诱导种子产生许多耐盐性状,缓解盐胁迫对种子的伤害[34-35]。本研究结果表明,经SA处理后,在24~144 mmol/L NaHCO3胁迫处理下,青冈栎种子的萌发参数(发芽率、发芽指数和活力指数)、耐盐指数、渗透调节物质含量(可溶性糖、可溶性蛋白和游离脯氨酸含量)以及抗氧化酶活性(SOD、POD、CAT)均较无SA处理组有不同程度的提高;MDA含量和相对盐害率则有不同程度的降低。这与Nimir等[9]的研究结论一致。说明SA处理可以缓解NaHCO3胁迫对种子萌发的抑制作用,提高种子耐盐性,但在不同胁迫浓度NaHCO3处理下SA缓解效果不同,且不能有效根除高浓度NaHCO3胁迫对青冈栎种子的伤害。

本研究还发现,经SA处理后,当NaHCO3浓度超过72 mmol/L时,青冈栎种子的渗透调节物质含量(特别是可溶性糖和游离脯氨酸)以及保护酶活性均呈显著下降趋势。特别是在96~144 mmol/L时,随NaHCO3胁迫浓度的增加,SOD活性开始低于对照组,导致MDA含量迅速增加,各萌发参数和耐盐指数均低于对照,相对盐害率则快速增加;当NaHCO3浓度达到144 mmol/L时,则不能有效抑制相对盐害率的增加。说明在一定NaHCO3胁迫浓度范围内,SA处理是提高青冈栎种子萌发率的一种有效的方法,但在高浓度NaHCO3胁迫处理下,SA作用减弱。
综合分析表明,尽管青冈栎种子经0.5 mmol/L的SA处理后,可降低NaHCO3胁迫对青冈栎种子萌发造成的伤害,但SA缓解作用在不同NaHCO3浓度下处理效果不同。在NaHCO3浓度为24~72 mmol/L时,特别是当NaHCO3为72 mmol/L时,青冈栎种子可以通过增强抗氧化防御能力、增加渗透调节物质避免其胁迫伤害,促进种子萌发,表现出最强的耐重碳酸盐性。另外,当NaHCO3浓度超过72 mmol/L时,SA的作用效果开始减弱,抗氧化酶活性和渗透调节物质含量开始下降,导致MDA含量迅速增加,相对盐害率则开始迅速增加。总之,在喀斯特岩溶地区进行青冈栎实生苗繁殖过程中,可以在播种前用0.5 mmol/L外源SA浸种,以提高种子萌发率,且当NaHCO3浓度为72 mmol/L时,处理效果最佳。但是否SA处理效果会受处理时间和方式等多因素的影响还需进一步研究,故在喀斯特岩溶地区青冈栎造林育苗生产中还应根据实际情况进行处理。
参考文献(reference):
[1]郭柯,刘长成,董鸣.我国西南喀斯特植物生态适应性与石漠化治理[J].植物生态学报,2011,35(10):991-999.GUO K,LIU C C,DONG M.Ecological adaptation of plants and control of rocky-desertification on Karst region of southwest China[J].Chin J Plant Ecol, 2011, 35(10): 991-999.DOI: 10.3724/SP.J.1258.2011.00991.
[2]王德炉,喻理飞.喀斯特环境生态脆弱性数量评价[J].南京林业大学学报(自然科学版),2005,29(6):23-26.WANG D L, YU L F. The quantitative assessment of ecological frangibility in Karst areas[J]. J Nanjing For Univ (Nat Sci Ed), 2005, 49(6): 23-26. DOI:10.3969/j.issn.1000-2006.2005.06.006.
[3]吴沿友,邢德科,刘莹.植物利用碳酸氢根离子的特征分析[J].地球与环境,2011,39(2): 273-277.WU Y Y,XING D K,LIU Y. The characteristics of bicarbonate used by plants[J].Earth Environ, 2011, 39(2): 273-277.DOI: 10.14050/j.cnki.1672-9250.2011.02.022.
[4]MUNNS R,TESTER M. Mechanisms of salinity tolerance[J]. Annu Rev Plant Biol, 2008, 59: 651-681.DOI: 10.1146/annurev.arplant.59.032607.092911.
[5]FARIDUDDIN Q,KHAN T A,YUSUF M,et al.Ameliorative role of salicylic acid and spermidine in the presence of excess salt inLycopersiconesculentum[J].Photosynthetica, 2018, 56(3): 750-762.DOI: 10.1007/s11099-017-0727-y.
[6]ALI E A,MAHMOUD A M.Effect of foliar spray by different salicylic acid and zinc concentrations on seed yield and yield components of mungbean in sandy soil[J].Asian J Crop Sci, 2012, 5(1): 33-40.DOI: 10.3923/ajcs.2013.33.40.
[7]HAYAT Q,HAYAT S,IRFAN M,et al.Effect of exogenous salicylic acid under changing environment: a review[J].Environ Exp Bot, 2010, 68(1): 14-25.DOI: 10.1016/j.envexpbot.2009.08.005.
[8]HAO L,ZHAO Y,JIN D D,et al.Salicylic acid-alteringArabidopsismutantsresponse to salt stress[J].Plant Soil, 2012, 354(1/2): 81-95.DOI: 10.1007/s11104-011-1046-x.
[9]NIMIR N E A,LU S Y,ZHOU G S,et al. Comparative effects of gibberellic acid,kinetin and salicylic acid on emergence, seedling growth and the antioxidant defence system of sweet sorghum (Sorghumbicolor) under salinity and temperature stresses[J].Crop Pasture Sci, 2015, 66(2): 145.DOI:10.1071/cp14141.
[10]ASADI M,HEIDARI M A,KAZEMI M,et al.Salicylic acid induced changes in some physiological parameters in chickpea (CicerarietinumL.) under salt stress[J].Int J Agr Tech, 2013, 9(2): 311-316.
[11]BAGHERI M Z.The effect of maize priming on germination chara-cteristics,catalase and peroxidase enzyme activity,and total protein content under salt stress[J].Int J Biosci, 2014, 4(2): 113-119.DOI:10.12692/ijb/4.2.113-119.
[12]YADAV V,SINGH H,SINGH A,et al.Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress in maize (ZeamaysL.) grown under cinnamic acid stress[J].Russ Agric Sci, 2018,44 (1): 9-17.DOI: 10.3103/S1068367418010202.
[13]王玉萍,董雯,张鑫,等.水杨酸对盐胁迫下花椰菜种子萌发及幼苗生理特性的影响[J].草业学报,2012,21(1):213-219.WANG Y P,DONG W,ZHANG X,et al.Effects of salicylic acid on seed germination and physiological characters of cauliflower seedlings under salt stress[J].Acta Prata culturae Sin, 2012, 21(1): 213-219.
[14]张凤银,陈禅友,胡志辉,等.外源水杨酸对盐胁迫下菜豆种子萌发和幼苗生理特性的影响[J].东北农业大学学报,2013,44(10):39-43.ZHANG F Y,CHEN C Y,HU Z H,et al.Effect of exogenous salicylic acid on seed germination and seedling physiological characteristics of kidney bean (PhaseolusvulgarisL.)under salt stress[J].J Northeast Agric Univ, 2013, 44(10): 39-43.DOI: 10.19720/j.cnki.1005-9369.2013.10.008.
[15]李润枝,靳晴,李召虎,等.水杨酸提高甘草种子萌发和幼苗生长对盐胁迫耐性的效应[J].作物学报,2020,46(11):1810-1816. LI R Z,JIN Q,LI Z H,et al.Salicylic acid improved salinity tolerance ofGlycyrrhizauralensisFisch during seed germination and seedling growth stages[J]. Acta Agron Sin, 2020, 46(11): 1810-1816.DOI: 10.3724/SP.J.1006.2020.04080.
[16]曹栋栋,陈珊宇,秦叶波,等.水杨酸调控盐胁迫下羽衣甘蓝种子萌发的机理[J].植物学报,2020,55 (1):49-61. CAO D D,CHEN S Y,QIN Y B,et al.Regulatory mechanism of salicylic acid on seed germination under salt stress in kale [J]. Bull Bot, 2020, 55 (1): 49-61.DOI: 10.11983/CBB19047.
[17]苏宗明,李先琨.广西岩溶植被类型及其分类系统[J].广西植物,2003,23(4):289-293.SU Z M,LI X K.The types of natural vegetation in Karst region of Guangxi and its classified system[J].Guihaia, 2003, 23(4): 289-293.DOI: 10.3969/j.issn.1000-3142.2003.04.001.
[18]HUANG Y Q,ZHAO P,ZHANG Z F,et al.Transpiration ofCyclobalanopsisglauca(syn.Quercusglauca) stand measured by sap-flow method in a Karst rocky terrain during dry season[J].Ecol Res, 2009,24(4):791-801.DOI: 10.1007/s11284-008-0553-6.
[19]程彩芳,陆爱云,李正才,等.不同林龄木荷-青冈栎混交林幼林碳储量[J].生态学杂志,2015,34(10):2705-2710.CHENG C F,LU A Y,LI Z C,et al.Carbon storage in mixedSchimasuperbaGardn.et Champ.-Cyclobalanpsisglauca(Thunb.) Oerst.young plantations at different stand ages[J].Chin J Ecol, 2015,34(10): 2705-2710. DOI: 10.13292/j.1000-4890.2015.0249.
[20]程彩芳,李正才,周君刚,等.树种组成对北亚热带11年生常绿阔叶人工林碳储量的影响[J].西北植物学报,2015,35(5):1037-1043.CHENG C F,LI Z C,ZHOU J G,et al.Effects of tree species composition on carbon storage of 11 years old evergreen broad-leaved plantations in north subtropical areas of China[J].Acta Bot Boreali-Occidentalia Sin, 2015, 35(5): 1037-1043.DOI: 10.7606/j.issn.1000-4025.2015.05.1037.
[21]吴敏,邓平,赵英,等.喀斯特干旱环境对青冈栎叶片生长及叶绿素荧光动力学参数的影响[J].应用生态学报,2019,30(12):4071-4081.WU M,DENG P,ZHAO Y,et al.Effects of drought on leaf growth and chlorophyll fluorescence kinetics parameters inCyclobalanopsisglaucaseedlings of Karst areas[J].Chin J Appl Ecol,2019,30(12): 4071-4081. DOI: 10.13287 /j.1001-9332.201912.001.
[22]邓平,吴敏,赵英,等.干旱胁迫下外源钙对桂西北喀斯特地区青冈栎种子萌发的影响[J].西北农林科技大学学报(自然科学版),2020,48(2):69-79.DENG P,WU M,ZHAO Y,et al.Effects of exogenous calcium on seed germination ofCyclobalanopsisglaucain Karst area of Northwestern Guangxi under draught stress[J].J Northwest A&F Univ (Nat Sci Ed), 2020, 48(2): 69-79.DOI: 10.13207/J.cnkj.jnwafu.2020.02.009.
[23]吴敏,张文辉,马闯,等.干旱胁迫对栓皮栎种子萌发能力的影响[J].西北农林科技大学学报(自然科学版),2017,45(5):91-100.WU M,ZHANG W H,MA C,et al.Effect of drought stress on seed germination ability ofQuercusvariabilisBL.[J].J Northwest A&F Univ (Nat Sci Ed), 2017, 45(5): 91-100.DOI: 10.13207/j.cnki.jnwafu.2017.05.013.
[24]BOSCAGLI A,SETTE B.Seed germination enhancement inSaturejamontanaL. ssp. Montana [J]. Seed Sci Technol, 2001, 29(2): 347-355.
[25]DEBEZ A,BEN HAMED K,GRIGNON C,et al.Salinity effects on germination,growth,and seed production of the halophyteCakilemaritima[J].Plant Soil, 2004, 262(1/2): 179-189.DOI: 10.1023/B:PLSO.0000037034.47247.67.
[26]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.LI H S. Plant physiology and biochemistry experimental principles and techniques[M].Beijing: Higher Education Press,2000.
[27]TALEI D,VALDIANI A,YUSOP M K,et al.Estimation of salt to-lerance inAndrographispaniculataaccessions using multiple regression model[J].Euphytica, 2013, 189(1): 147-160.DOI: 10.1007/s10681-012-0782-1.
[28]BELKHADI A,HEDIJI H,ABBES Z,et al.Effects of exogenous salicylic acid pre-treatment on cadmium toxicity and leaf lipid content inLinumusitatissimumL.[J].Ecotoxicol Environ Saf, 2010,73(5): 1004-1011.DOI: 10.1016/j.ecoenv.2010.03.009.
[29]李志萍,张文辉,崔豫川.NaCl和Na2CO3胁迫对栓皮栎种子萌发及幼苗生长的影响[J].生态学报,2015,35(3):742-751.LI Z P,ZHANG W H,CUI Y C.Effects of NaCl and Na2CO3stresses on seed germination and seedling growth ofQuercusvariabilis[J].Acta Ecol Sin, 2015, 35(3): 742-751.DOI: 10.5846/stxb201304190747.
[30]王国华,郭文婷,缑倩倩.钠盐胁迫对河西走廊荒漠绿洲过渡带典型一年生草本植物种子萌发的影响[J].应用生态学报,2020,31(6):1941-1947.WANG G H,GUO W T,GOU Q Q.Effects of sodium salt stress on seed germination of typical annuals in a desert-oasis ecotone of Hexi Corridor,China[J].Chin J Appl Ecol,2020,31(6): 1941-1947.DOI: 10.13287/j.1001-9332.202006.006.
[31]郑燕,张鸿翎,刘嘉伟,等.NaCl胁迫对黑果枸杞种子萌发特性的影响[J].内蒙古农业大学学报(自然科学版),2019,40(3):24-32.ZHENG Y,ZHANG H L,LIU J W,et al.Effects of NaCL salt tolerance on seeds germination for wildLyciumruthenicumMurr[J].J Inn Mong Agric Univ (Nat Sci Ed), 2019,40(3): 24-32.DOI: 10.16853/j.cnki.1009-3575.2019.03.005.
[32]王俊娟,王德龙,樊伟莉,等.陆地棉萌发至三叶期不同生育阶段耐盐特性[J].生态学报,2011,31(13):3720-3727.WANG J J,WANG D L,FAN W L,et al.The characters of salt-tolerance at different growth stages in cotton[J].Acta Ecol Sin, 2011, 31(13): 3720-3727.
[33]李玉梅,冯颖,姜云天,等.混合盐胁迫对东北薄荷种子萌发及幼苗生长的影响[J].西北农林科技大学学报(自然科学版),2019,47(10):52-62. LI Y M,FENG Y,JIANG Y T,et al.Effects of mixed salt stress on seed germination and seeding growth ofMentiasachalinensis(Briq.) Kudo[J].J Northwest AF Univ (Nat Sci Ed),2019,47(10): 52-62.DOI: 10.13207/j.cnki.jnwafu.2019.10.007.
[34]JAYAKANNAN M,BOSE J,BABOURINA O,et al.Salicylic acid improves salinity tolerance inArabidopsisby restoring membrane potential and preventing salt-induced K+loss via a GORK channel[J].J Exp Bot, 2013, 64(8):2255-2268.DOI:10.1093/jxb/ert085.
[35]MA X,ZHENG J,ZHANG X,et al.Salicylic acid alleviates the adverse effects of salt stress onDianthussuperbus(Caryophylla-ceae) by activating photosynthesis, protecting morphological structure, and enhancing the antioxidant system[J]. Front Plant Sci, 2017, 8: 600.DOI: 10.3389/fpls.2017.00600.
[37]NAZAR R,IQBAL N,SYEED S,et al.Salicylic acid alleviates decreases in photosynthesis under salt stress by enhancing nitrogen and sulfur assimilation and antioxidant metabolism differentially in two mungbean cultivars[J].J Plant Physiol, 2011, 168(8): 807-815.DOI: 10.1016/j.jplph.2010.11.001.
[38]BANINASAB B,BAGHBANHA M R.Influence of salicylic acid pre-treatment on emergence and early seedling growth of cucumber (Cucumissativus) under salt stress [J].Int J Plant Prod,2013,7(2):187-206.DOI: 10.1016/j.eja.2012.12.004.
[39]彭宇,张春兰,沈其荣,等.盐胁迫下两种外源酚酸对黄瓜种子萌发及幼苗体内某些酶活性的效应[J].南京农业大学学报,2003,26(1):33-36.PENG Y,ZHANG C L,SHEN Q R,et al.Effects of two phenolic acids on seed germination and activities of some emzymes in cucumber seedlings under salt stress[J].J Nanjing Agric Univ,2003,26(1):33-36.DOI: 10.3321/j.issn:1000-2030.2003.01.008.

