桑树MaPP2C8基因克隆及其干旱胁迫下的表达
黄仁维,祁伟亮,曾 睿,任迎虹
(成都师范学院 化学与生命科学学院,特色园艺生物资源开发与利用四川省高校重点实验室,成都 611130)
桑树(MorusalbaL.)属桑科(Moraceae)桑属(MorusLinn.)植物,由于其良好的适应性而广泛分布于世界各地,在中国已有5000多年的种植历史[1]。桑树的果实桑葚味道鲜美,营养丰富,深受消费者的喜爱[2]。桑叶作为家蚕(Bombyx)唯一的营养来源具有重要的生态学意义,对养蚕业具有极其重要的作用[3]。桑树具有一定程度的耐旱性,适应性较强,被誉为生态经济两用型树种[4]。但由于地理位置的不同,尤其在中国的北方地区,年降雨量少,严重的干旱极大地影响桑树的种植,且不同品种桑树的耐旱性差异大,同样严重制约了不同桑树品种的推广[5-6]。植物抗性基因产生响应是植物应对外界各种胁迫的关键环节,因此克隆桑树抗性相关基因,解析其胁迫响应和抗性机制有利于桑树的抗性育种。
植物对外界胁迫的响应受多种基因的调控。植物蛋白磷酸酶(protein phosphatases, PPs)在植物中参与多种信号传导途径,在可逆的磷酸化反应中用于抵消激酶的作用,其中,2C型PPs(PP2Cs)是植物PPs的主要类群[7]。近年来研究发现,PP2Cs参与多种与脱落酸(ABA)相关的信号传导通路,使得PP2Cs被认为处于植物逆境响应和发育主要信号通路的中心位置[8]。截止目前,研究人员已在多个物种中鉴定出PP2C家族成员,对PP2C基因家族成员的分子、生化、遗传及功能研究均表明,PP2Cs参与调控植物生理的多个方面[9-11]。在对多种模式植物,如,拟南芥、玉米、水稻等的PP2Cs表达水平分析发现,PP2Cs基因受ABA及多种非生物胁迫的诱导,如干旱胁迫、渗透性胁迫、盐胁迫及低温胁迫等[11-13]。He等[14]发现,玉米多个PP2C基因家族成员的表达受多种胁迫及ABA的诱导,表明这些基因可能在玉米抵御胁迫过程中扮演着重要的角色。综上可知,PP2Cs基因家族在植物响应外界胁迫中具有重要调控作用,克隆并解析桑树MaPP2C家族基因的功能对桑树抗性育种具有重要的作用。
目前针对PP2Cs家族基因的相关研究主要集中在一些模式植物上,对木本植物PP2Cs基因家族相关基因的研究还严重不足,有关桑树MaPP2Cs家族相关基因的研究还鲜有报道。本团队对前期的桑树转录组数据进行分析,发现MaPP2C8基因的表达受干旱胁迫强烈诱导。因此,本研究对桑树MaPP2C8基因及其启动子进行了克隆并分析,并对干旱胁迫处理下MaPP2C8基因的表达水平进行分析,为进一步研究MaPP2C8基因在干旱胁迫响应中的功能奠定基础,以期为桑树抗旱基因工程和遗传改良提供基因资源。
1 材料和方法
1.1 供试材料及处理
供试材料为桑树品种‘德果1号’,由四川省德昌县桑树种质资源圃提供,该品种为德昌县桑树种植主推品种,其果实品质好,果叶兼用具有极高的经济价值。
干旱胁迫处理:将桑树种子播种于含营养土的10 L种植盆中,每盆种植4株,于25 ℃、相对湿度20%~30%温室自然光下培养。待桑苗长至株高约45 cm左右时,挑选长势一致的幼苗进行干旱处理。依据土壤含水量的差异共设置4个处理组,分别为:轻度干旱胁迫(相对含水量为65%~75%)、中度干旱胁迫(相对含水量为50%~65%)、重度干旱胁迫(相对含水量为35%~40%)及重度干旱胁迫后复水组,每个处理组设置3个生物重复,每个重复3盆桑苗。具体操作为:将盆栽苗浇透水后进行自然干旱,每天傍晚取距盆表土10~15 cm处的土样,采用烘干称重法测定土壤含水量,土壤含水量达到胁迫处理要求后,于次日早晨8点取植株相同部位幼嫩叶片,用于干旱胁迫下的基因表达分析。复水组于重度干旱取材后立即给予充足水分,2 d后取样用于后续试验。
试验所用的高保真DNA聚合酶TopTaqDNA Polymerase、大肠杆菌感受态细胞购自北京全式金生物有限公司,琼脂糖凝胶回收试剂盒购自北京天根生物公司,反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047A)、T载pMD19-T购自TaKaRa生物公司。RNA提取试剂盒RNAprep Pure Plant Kit(DP441)购自北京天根生物公司,引物合成和测序由生工生物工程(上海)股份有限公司完成,SsoFastTMEvaGreen Supermix购自伯乐生命医学产品(上海)有限公司。
1.2 方 法
1.2.1 基因克隆桑树叶片总RNA的提取按照RNAprep Pure Plant Kit说明书进行,cDNA第一链合成按照PrimeScriptTMRT reagent Kit说明书进行。根据桑树转录组数据库中的序列信息,设计引物(表1),以桑树cDNA为模板,对MaPP2C8基因的cDNA序列进行扩增。PCR反应体系为:cDNA模板2 μL, 上、下游引物(10 μmol·L-1)各1 μL,10×TopTaq缓冲液2.5 μL,dNTPs 1.5 μL,TopTaq酶0.2 μL,最后使用ddH2O补足至终体积25 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,26个循环;72 ℃延伸10 min。利用琼脂糖凝胶回收试剂盒纯化PCR产物,将纯化后的产物连接至PMD19-T载体,转化大肠杆菌,经菌液PCR鉴定后送生工测序。
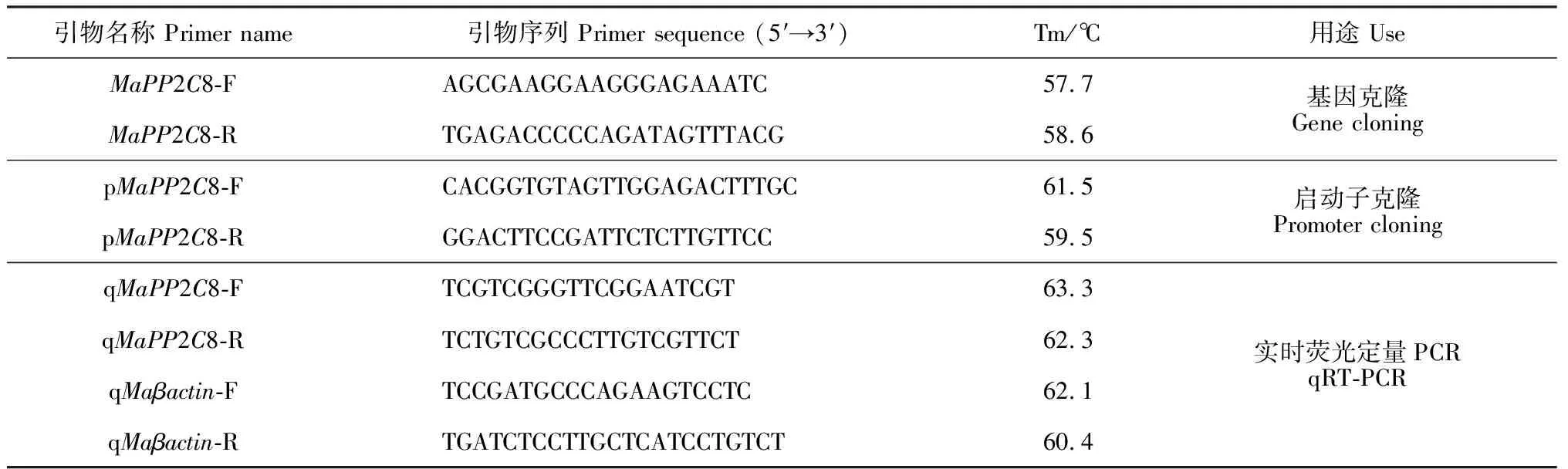
表1 实验所用引物及用途
1.2.2 启动子克隆桑树基因组DNA的提取采用改良CTAB法进行[15]。以NCBI数据库中报道的桑树基因组序列中MaPP2C8启动子序列为参考序列设计引物(表1),以‘德果1号’基因组DNA为模板,进行PCR扩增。扩增体系及程序采用1.2中所介绍的体系及程序,扩增程序依据引物的退火温度和扩增片段的长度略作改动。
1.2.3 生物信息学分析利用OFR Finder在线分析工具分析MaPP2C8 cDNA序列的开放阅读框,利用BioEdit 7.2分析MaPP2C8 CDS序列所编码蛋白质的理化性质,采用Mega7.0构建MaPP2C8的系统进化树;使用WoLF PSORT(https://wolfpsort.hgc.jp/)及SoftBerry ProtComp9.0(http://linux1.softberry.com/ berry.phtml)对MaPPCC-8进行亚细胞定位预测[16-17];使用SignalP 4.1(http://www.cbs.dtu.dk/cgi-bin/ webface2. fcgi? jobid=600E2532000021E01EC0E49B& wait=20)对MaPP2C8蛋白的信号肽进行预测。采用在线分析软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对MaPP2C8启动子顺势作用元件进行分析。
1.2.4 实时荧光定量PCR分析利用实时荧光定量PCR技术分析桑树MaPP2C8在干旱胁迫处理下的表达特性。以桑树MaPP2C8 cDNA序列为基础,设计1对MaPP2C8定量PCR引物,以桑树Maβ-actin为内参基因(表1)。qRT-PCR反应在伯乐BioRad CFX96Touch实时荧光定量PCR仪上进行,所有qRT-PCR反应均设置3个生物学重复,每个生物学重复设置3个技术重复。qRT-PCR反应总体系为10 μL:SsoFastTMEvaGreen®Supermix 5 μL,上、下游引物(10 μmol·L-1)各0.5 μL,cDNA 0.5 μL,无RNA酶水H2O 3.5 μL。qRT-PCR反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火5 s,40个循环。利用Bio-Rad ManagerTMSoftware (Version 1.1)软件对试验数据进行分析,用2-ΔΔCT法计算MaPP2C8的相对表达量。
2 结果与分析
2.1 MaPP2C8基因的克隆及序列分析
从‘德果1号’cDNA中克隆获得一段约1 300 bp的条带,对其进行回收、TA克隆、PCR鉴定及测序后发现,该条带全长为1 309 bp。将该序列与转录组测序获得的MaPP2C8参考序列进行比对后发现,该序列为MaPP2C8的cDNA序列。其编码的氨基酸与核苷酸序列对应关系如图1所示。MaPP2C8 CDS序列中A+T含量为44.25%,G+C含量为55.75%,共编码350个氨基酸,蛋白质相对分子质量为37.96 kD,等电点为5.099。其氨基酸残基中共含有48个带正电氨基酸,57个带负电氨基酸,116个疏水氨基酸,69个极性氨基酸。采用SignalP 4.1 Server对MaPP2C8蛋白信号肽进行预测后发现,该蛋白无信号肽序列,为非分泌蛋白。

图1 MaPP2C8核苷酸序列及其氨基酸序列Fig.1 Nucleotide and amino acid sequences of MaPP2C8
2.2 MaPP2C8进化树分析
采用Mega7.0构建桑树MaPP2C8及NCBI中已报道的19个PP2C蛋白的系统进化树(图2),结果表明,桑树MaPP2C8与大麻、番木瓜的亲缘关系较近,其中与同属于桑科的大麻亲缘关系最近,这进一步明确了MaPP2C8属于桑树PP2C基因家族成员。

图2 MaPP2C8与其他植物PP2C家族成员的系统进化树Fig.2 Phylogenetic tree analysis between MaPP2C8 and PP2C family members of other plants
2.3 MaPP2C8在PP2Cs基因家族中分支分析
在NCBI中进一步查询拟南芥中已报道的拟南芥AtPP2Cs家族成员,采用Mega7.0对MaPP2C8在PP2Cs基因家族中的归属分支进行分析,结果显示,MaPP2C8与其他拟南芥PP2C蛋白分为12个亚族(A-L),MaPP2C8与A亚族成员聚为一类(图3),这进一步为将来研究MaPP2C8基因的功能提供了参考。
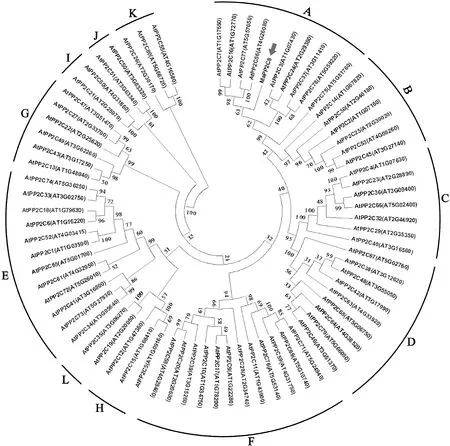
图3 MaPP2C8蛋白与拟南芥(At)PP2C蛋白的进化树分析Fig.3 Phylogenetic tree of MaPP2C8 with PP2C proteins from Arabidopsis(At)
2.4 MaPP2C8亚细胞定位预测
采用SoftBerry ProtComp9.0(Plant)对MaPP2C8蛋白的亚细胞定位预测后发现,MaPP2C8蛋白可能存在于细胞中的多个位置,如细胞质、细胞核、细胞膜,表明MaPP2C8在细胞中的作用范围广泛,对各种胁迫的响应速度快。采用WoLFPSORT进一步对MaPP2C8蛋白的亚细胞定位进行分析后发现,MaPP2C8同样定位于细胞中的多个位置。结合相关文献[18-19],推测MaPP2C8可能分布于细胞中的多个位置,如细胞质、细胞核及细胞膜等。
2.5 MaPP2C8启动子克隆及序列分析
依据NCBI中报道的桑树基因组序列为参考序列设计MaPP2C8启动子克隆引物,以‘德果1号’基因组DNA为模板,克隆获得MaPP2C8起始密码子上游一段大小为1 612 bp的序列,采用Plant-CARE在线软件对MaPP2C8启动子序列中的顺式作用元件进行预测发现,MaPP2C8启动子序列中含有激素响应元件、光响应元件及防御与胁迫响应元件(表2)。激素响应元件包括脱落酸响应元件ABRE、茉莉酸响应元件(CGTCA-motif和TGA-CG-motif)及水杨酸响应元件(TCA-element);光响应元件包括Box 4、G-Box、Gap-box、MRE、Sp1、TCCC-motif;防御与胁迫响应元件包括TC-rich repeats。以上结果表明MaPP2C8 基因的表达可能受到这些因素诱导。
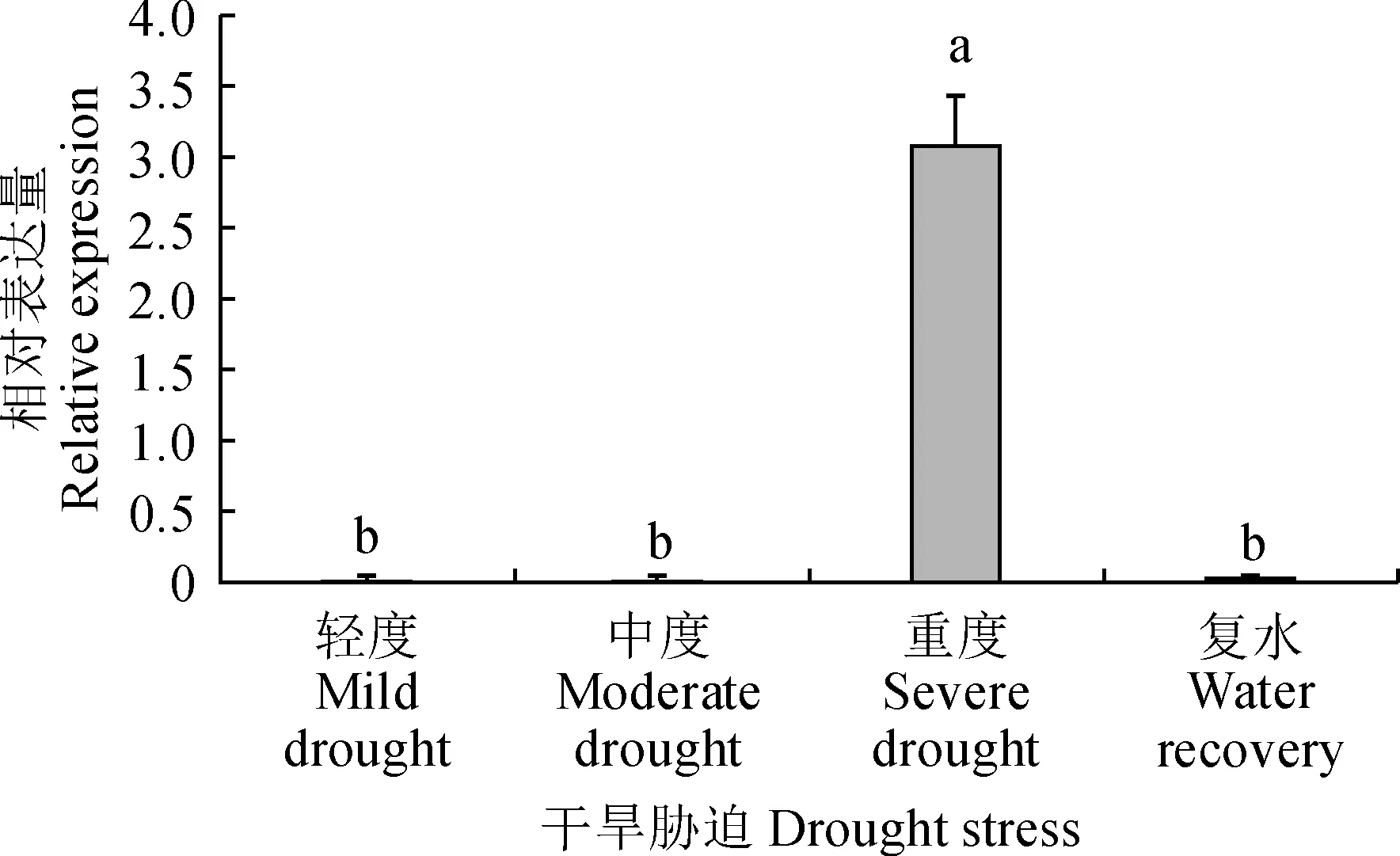
不同小写字母表示0.05水平上存在差异显著图4 MaPP2C8在干旱胁迫处理下的表达分析Different lowercase letters mean significant differences at 0.05 levelFig.4 The expression analysis of MaPP2C8 gene under drought stress

表2 MaPP2C8启动子顺式作用元件
2.6 MaPP2C8对干旱胁迫的响应
采用qRT-PCR技术检测桑树MaPP2C8在干旱胁迫下的表达特性。结果(图4)显示,MaPP2C8基因的表达受干旱胁迫强诱导,重度干旱时,MaPP2C8表达量达到最高水平。在重度干旱胁迫后,给予复水处理,并对MaPP2C8的表达水平进行分析,结果显示,MaPP2C8的表达量显著下降。以上结果表明,MaPP2C8可能参与了桑树对干旱胁迫的响应。
3 讨 论
桑树虽具有强的适应性,但在中国干旱给桑树产业所带来的损失仅次于病虫害[20]。干旱胁迫下,对不同抗性桑树品种的生理生化特性研究发现,抗性高的品种,其SOD、POD、CAT等酶的活性显著高于低抗性品种,而造成这一现象的根本原因是基因调控层面[21]。植物PP2Cs基因家族含有多个成员,参与植物生长发育过程的多个环节,如根系发育、叶片衰老、气孔发育、种子萌发、花粉萌发等,且在植物应答生物与非生物胁迫中发挥着重要作用[22]。Shazadee等[23]采用qRT-PCR技术对棉花30个GhPP2Cs基因进行分析后发现,这些基因在棉花响应高温、低温、干旱、盐等胁迫时起到重要的作用。在模式植物拟南芥中,已鉴定出80个PP2Cs成员,研究人员依据PP2Cs蛋白结构的不同,将其分为12个亚群(A-L)[11, 24]。Yu等[25]对小麦A亚族基因PP2C-a10进行研究,发现拟南芥中异源表达小麦PP2C-a10显著提高了转基因拟南芥种子的萌发率,降低了转基因拟南芥对干旱胁迫的抗性。He等[14]对玉米A亚族基因ZmPP2C-A2和ZmPP2C-A6在多种非生物胁迫下的表达模式进行分析,并在拟南芥中对其功能进行研究,结果显示,ZmPP2C-A2和ZmPP2C-A6在干旱、盐、ABA等胁迫条件下表达量显著增加,过表达ZmPP2C-A2和ZmPP2C-A6基因降低了拟南芥对干旱的抗性。以上均表明,PP2Cs基因家族成员在植物胁迫响应中具有重要调控作用。为此,本研究克隆了桑树MaPP2Cs家族成员MaPP2C8基因,以期为桑树的抗性育种提供基因资源。在对桑树MaPP2C8的分支归属进行分析发现,MaPP2C8归属于PP2Cs基因家族中的A亚族。此外,在对干旱胁迫下MaPP2C8基因的表达模式进行分析发现,MaPP2C8受干旱胁迫的强诱导,并且有趣的是,复水处理后MaPP2C8的表达量又显著降低,这些结果暗示着桑树MaPP2C8基因可能和其他A亚族基因一样参与了对干旱胁迫的响应。然而,这种响应机制还有待通过过表达MaPP2C8基因等实验来进一步研究。
植物激素ABA在提高植物对干旱等非生物胁迫的耐受水平方面发挥重要作用[26]。研究表明,多数PP2Cs基因在植物ABA信号通路中起重要调节作用,ABA与其受体(PYR、PYL、RCAR等)结合,抑制PP2Cs活性,使得SnRK2得到释放,释放的SnRK2激活ABF、AREB及ABI5等转录因子,从而调节ABA响应基因的表达水平,调节植物生长,响应外界胁迫[8, 27-28]。启动子在基因表达调控过程中起重要的作用[29]。为探讨MaPP2C8基因表达与ABA之间的调控关系,本研究对MaPP2C8基因的启动子进行了克隆,对启动子序列进行预测发现,MaPP2C8启动子中含有3个与ABA相关的元件ABRE,这暗示MaPP2C8的表达可能受ABA的诱导,因此,推测ABA可能通过诱导MaPP2C8的表达水平,进而对下游基因的表达进行调节,然而有关MaPP2C8的作用机制有待进一步研究。
综上所述,本研究克隆获得了桑树MaPP2C8基因及其启动子序列,并对其进行生物信息学分析和干旱胁迫应答分析,本研究结果为进一步研究MaPP2C8基因的功能及利用MaPP2C8基因进行桑树抗旱育种奠定了基础。

