纤枝短月藓LEA5基因表达及耐盐性分析
李雪宝,周 璇,鄢 波
(西南林业大学 园林园艺学院, 昆明 650224)
纤枝短月藓(Brachymeniumexile)属于真藓科短月藓属[1],能在裸露的岩壁和极端干旱的环境中生存,具有较强的耐旱能力。研究植物抗旱基因,培育耐旱植物,对改善生态环境具有重要意义。
由于非生物胁迫严重限制了植物的生长发育,一系列防御机制已经进化,以提高植物的抗逆性,包括组织结构、化学物质和表达蛋白的反应[2-3]。其中,晚期胚胎发生丰富蛋白(LEA)是一种高度亲水性的蛋白质,最早是在棉花胚胎发育后期的子叶中发现的[4],随后在小麦、甘蓝型油菜、番茄、印度芥菜等植物中也发现LEA蛋白的存在[5-8],LEA蛋白在植物界具有广泛的分布。但它并不是植物界所特有的,在细菌、真菌和一些无脊椎动物中也存在LEA蛋白[9-11]。
根据蛋白质氨基酸基序和保守结构特点,LEA蛋白家族的分类存在差异,按照Pfam domain分类法[12],本研究所用的LEA5蛋白属于LEA5族(对应以往分类法中的D19[13]和group 1[14]),该LEA蛋白一般由80~153个富含甘氨酸的序列组成,其最显著的特征是含有高度保守的20个氨基酸基元序列[15]。
此外,研究表明大部分的LEA蛋白对干旱、高渗性等各种非生物胁迫具有响应机制。例如,小麦TaEm蛋白(LEA5族)可以提高酿酒酵母对高盐的耐受能力[16];大麦HVA1蛋白(LEA3族)的过度表达显著提高了转基因小麦和水稻对干旱胁迫的耐受性[17];AtLEA4-1d蛋白在芥菜中的过度表达可以显著增强转基因植物对干旱和盐胁迫的适应性[8];OsLEA3-2蛋白的过表达可以改善转基因拟南芥和水稻在盐胁迫和干旱条件下的生长[18]。因此,LEA蛋白在植物非生物胁迫反应中的生物学功能越来越受到重视。
目前,有关苔藓植物LEA5基因的研究较少。本研究对纤枝短月藓LEA5基因序列及其启动子元件进行分析,并对LEA5基因的表达及耐盐性进行了探究,为进一步探讨LEA5基因结构及其耐盐性之间的关系提供依据,也为进一步研究LEA5基因的耐盐保护机制奠定基础,为提高植物耐盐性的分子育种提供了潜在的应用前景。
1 材料和方法
1.1 植物材料
纤枝短月藓采于西南林业大学,选取该苔藓植株的不同发育时期及不同组织(孢子体部分及配子体部分),立即用液氮速冻后保存于-80 ℃。
1.2 方 法
1.2.1 纤枝短月藓LEA5基因ORF的克隆采用OMEGA公司的总RNA提取试剂盒提取纤枝短月藓的总RNA,利用逆转录试剂盒(全式金),将提取的RNA逆转录为cDNA。
根据本课题组已有的转录组测序结果,结合载体序列设计同源臂引物LEA5-PF(GATGACGATGACAAGATGGCTTCCCGGGAGGAG)和LEA5-PR(AATTCGAAGATCTCGTCACTCGTTTGTAA-ACTTAGAC)。以纤枝短月藓cDNA第一链为模板,进行PCR扩增。PCR扩增程序:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火 30 s,72 ℃延伸 90 s,35个循环;72 ℃延伸10 min;4 ℃保存。
1.2.2 纤枝短月藓LEA5基因启动子的扩增取新鲜的纤枝短月藓置于预冷的研钵中,加入适量的液氮充分研磨,具体操作参照北京天根公司的小量植物(叶)DNA抽提试剂盒说明书。
以纤枝短月藓DNA为模板,结合LEA5基因序列设计启动子引物LEA5-1R(GTACCTTCTGCGAGGTGCTCTTGGGC)、LEA5-2R(ACGATGGACTCCAGTCCGGCCGAAGCCATTCTCGTT-GTGCTC)和LEA5-3R(GATGATCAGAAGATA-AGCAAGTGTAGG),分别作为第一轮、第二轮、第三轮特异引物, LAD1-1、LAD1-2、LAD1-3、LAD1-4、AC1引物序列及HiTail-PCR扩增程序参照Liu等的研究[19],第三轮PCR产物经1%琼脂糖凝胶电泳检测,选择约1 000 bp条带进行PCR产物回收,PCR产物回收后连接到克隆载体pMD18-T中,送生工生物工程股份有限公司进行测序。
1.2.3LEA5基因的荧光定量分析选择LEA5基因进行荧光定量PCR分析,根据获得的LEA5基因序列,设计荧光定量引物LEA5-QF(CTCGCAGAAGGACGTAGCAAG)和LEA5-QR(CTCATCAATGTCGATGTTCTGC)。以Actin基因为内参基因,设计引物A-F(CTGTACGGCAACATCGTGCTG)和A-R(CCAGACACTGTACTTCCTCTC),以cDNA为模板,按照TB Green®Premix Ex TaqTM Ⅱ说明书,采用2-ΔΔCt法。
1.2.4 纤枝短月藓LEA5基因原核表达分析用KpnⅠ和SacⅠ(TaKaRa公司)对pThioHis A载体进行双酶切。将纯化的酶切产物与目的基因进行重组,具体操作参照Vazyme公司的Clon ExpressⅡOne step Cloning Kit的操作说明书,获得重组质粒,将重组质粒送生工生物工程股份有限公司进行测序。
将构建成功的重组表达质粒以及空载体分别转化至表达菌株E.coliBL 21 (DE 3)中。诱导表达后进行SDS-PAGE电泳分析。
1.2.5 重组菌耐盐性分析将重组菌株与对照菌株接种到LB(100 μg/mL Amp)液体培养基中,于37 ℃,220 r/min 过夜培养。次日按照1∶100比例扩大培养至OD600为0.5时,加入终浓度为1 mmol/L IPTG进行诱导表达至OD600为0.8,做10倍梯度稀释(1∶10;1∶100;1∶1000)。从各稀释度的菌液取10 μL,点到添加300、500、700 mmol/L NaCl和500、700、900 mmol/L KCl胁迫培养基上,37 ℃倒置培养2 d,每个实验重复3次,观察菌斑生长情况,并拍照保存。
1.2.6 生物信息学分析利用ExPASy-ProtParam分析氨基酸的理化性质;利用NetPhos 3.1 Server软件预测磷酸化位点[20];利用NetOGlyc 1.1 Server软件预测O-糖基化位点;利用NetNGlyc 1.0 Server 预测N-糖基化位点;利用SOPMA软件进行二级结构预测及分析;利用Swiss-Model通过同源建模建立三级模型。
2 结果与分析
2.1 纤枝短月藓LEA5基因序列及蛋白的结构分析
转录组序列分析表明,该基因包含189 bp 5′-UTR和285 bp 3′-UTR,其开放阅读框为267 bp,编码88个氨基酸(图1)。Pfam分析得出,LEA5蛋白在2~61氨基酸位点含有LEA5族结构域。分析表明该蛋白属于LEA5族。

图1 纤枝短月藓LEA5基因的核苷酸序列及其编码的氨基酸序列Fig.1 Nucleotide acids and deduced amino acids sequences of LEA5 gene from B. exile
利用protparam预测LEA5基因所编码的蛋白质相对分子质量为9 157.81 Da,理论等电点4.72,分子式C377H608N120O142S2,LEA5基因所编码蛋白的氨基酸组成中,Gly含量最高,占总氨基酸的15.9%;其次为Ala和Glu,均占总氨基酸的13.6%。脂肪系数为51.25,平均亲水性为-1.011,为亲水蛋白;不稳定指数为35.77,属稳定性蛋白。
预测发现LEA5蛋白发生磷酸化修饰的位点共有6个。其中,丝氨酸的磷酸化位点最多,为4个;而苏氨酸的磷酸化位点和酪氨酸的磷酸化位点各1个。LEA5蛋白没有发生N-糖基化的位点,可能发生O-糖基化的修饰位点有5个。
使用SOPMA软件预测LEA5蛋白的二级结构。结果表明,该蛋白主要由α螺旋(alpha helix)、β转角(beta turn)、无规则卷曲(random coil)和延伸链(extended strand)构成,其中α螺旋和无规则卷曲最多,分别占氨基酸序列的44.32%和38.64%,其次为β转角(12.50%),延伸链最少(4.55%)。通过Swiss-Model对LEA5蛋白的三级结构进行同源建模,预测的LEA5蛋白三级结构中有2个α螺旋和3个β折叠。
2.2 纤枝短月藓LEA5基因启动子的扩增与分析
以纤枝短月藓DNA为模板,通过HiTail-PCR扩增LEA5基因启动子序列,选择第4泳道约为1 000 bp条带进行回收(图2),最终获得了LEA5基因启动子序列1 053 bp。

M. Marker;1-4. 分别与引物LAD1-1、LAD1-2、LAD1-3、LAD1-4结合的HiTail-PCR扩增产物图2 纤枝短月藓LEA5基因启动子HiTail-PCR扩增M. Marker; 1-4. HiTail-PCR production combined with LAD1-1, LAD1-2, LAD1-3 and LAD1-4, respectivelyFig.2 HiTail-PCR production of LEA5 gene promoter from B. exile
启动子元件分析结果显示,LEA5基因启动子具有典型的CAAT box元件。在LEA5基因启动子区含大量非生物胁迫响应顺式作用元件,主要包括脱落酸响应元件(abscisic acid responsive element,ABRE)、茉莉酸甲酯响应元件(methyl jasmonate response element,CGTCA-motif)、赤霉素响应元件(gibberellin re-sponse element,GARE-motif)以及MYB结合位点(MYB binding site,MBS),且含有多个MYB和MYC元件,这2类元件都属于转录因子作用元件,与干旱或ABA诱导的表达调控有关,此外,还含有G-box、Wbox、TCCC-motif、TCT-motif、TGACG-motif 等元件。
2.3 纤枝短月藓LEA5基因荧光定量分析
荧光定量结果显示,在正常情况下,LEA5基因在纤枝短月藓的不同时期及不同部位中皆有表达,在纤枝短月藓无性世代的孢子体中表达量最高,有性世代的配子体次之,无性世代的配子体最低,不同组织的F检验非常显著(P<0.05),说明正常情况下不同组织的表达量不同。Tukey检验可以得出,无性世代的孢子体和无性世代的配子体间表达量差异显著,有性世代的配子体与其他2个组织间差异不显著(图3)。

1.无性世代的孢子体;2.无性世代的配子体;3.有性世代的配子体。不同字母表示组织间差异显著图3 纤枝短月藓不同组织中LEA5基因的表达分析1. Sporophyte of the asexual generation; 2. Gametophyte of the asexual generation; 3. Gametophyte of the sexual generation. Different letters indicate significant difference in different tissues Fig.3 Expression analysis of LEA5 gene in different tissues of B. exile
2.4 纤枝短月藓LEA5基因原核表达分析
将对照菌(BL21/pThiohis A)和重组菌(BL21/LEA5)在37 ℃培养至OD600为0.5,加入终浓度为1 mmol/L的IPTG进行诱导,其中对照菌诱导6 h,重组菌分别诱导1、2、4和6 h。SDS-PAGE结果显示:与对照菌相比,经IPTG诱导的重组菌在约22 kD处有一条目标蛋白表达条带,并且随着诱导时间的延长表达量增加,而仅含有空载体的对照菌则在约16 kD处有一条较小的硫氧还蛋白(为pThiohis A载体中的蛋白)表达条带 (图4)。
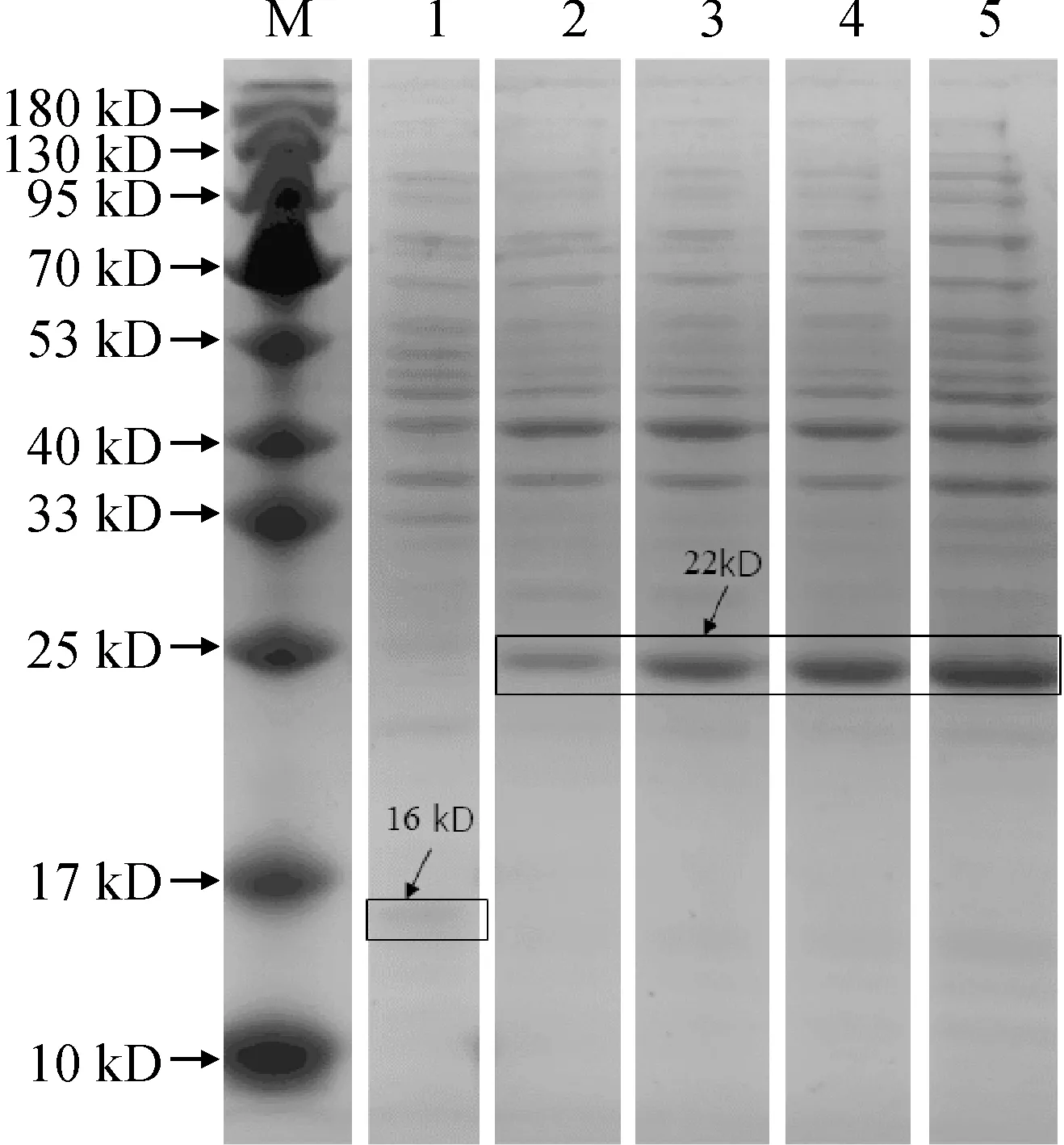
M. Marker;1.诱导6 h的BL21/pThiohis A;2-5为分别诱导1、2、4、6 h的BL21/LEA5图4 BL21/pThiohis A和BL21/LEA5的原核表达M. Marker; 1. BL21/pThiohis A induced for 6 h; 2-5. BL21/LEA5 induced for 1, 2, 4 and 6 h, respectivelyFig.4 Prokaryotic expression of BL21/pThiohis A and BL21/LEA5
2.5 重组菌耐盐性分析
为检验LEA5蛋白的重组菌对高盐的耐受性,首先确定合适的盐(NaCl或KCl)胁迫浓度。将空载体对照菌(BL21/pThiohis A)和重组菌(BL21/LEA5)进行IPTG诱导。再将等份的相同细胞密度的菌液分别涂布在添加外源NaCl(300、500和700 mmol/L)和KCl(500、700和900 mmol/L)的培养基上。结果显示,当稀释1 000倍时,BL21/pThiohis A和BL21/LEA5在300 mmol/L NaCl培养基平皿上菌斑数目超过1 000,二者的生长情况无明显差别;在500 mmol/L NaCl培养基上,BL21/pThiohis A和BL21/LEA5的菌斑数目为10~600,二者的生长情况差别较小;在700 mmol/L NaCl培养基上,BL21/pThiohis A和BL21/LEA5菌斑数目为0~150,BL21/LEA5菌斑数目明显多于BL21/pThiohis A。在700 mmol/L KCl胁迫下,BL21/pThiohis A和BL21/LEA5表现出与500 mmol/L NaCl相似的生长情况(表1)。因此,选择500 mmol/L NaCl和700 mmol/L KCl作为胁迫培养基的盐浓度。
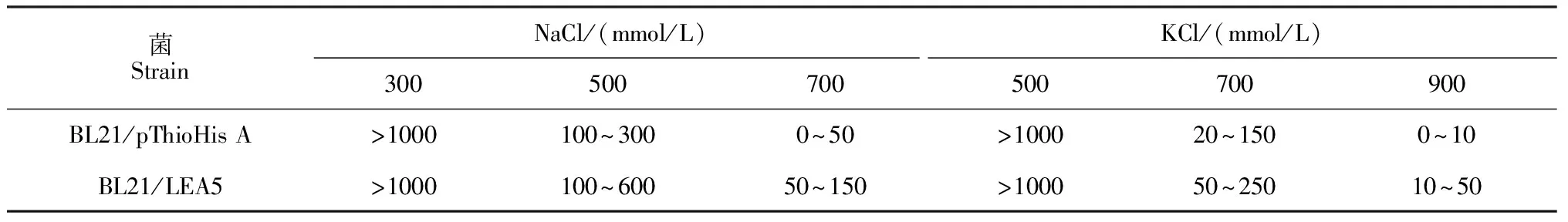
表1 BL21/pThioHis A和BL21/LEA5在盐胁迫条件下的菌斑数目
将BL21/pThiohis A和BL21/LEA5进行IPTG诱导,按0、10、100和1 000倍进行稀释,将等份的菌液分别点在普通培养基和盐胁迫(500 mmol/L NaCl和700 mmol/L KCl)培养基上,2 d后观察平板上菌斑生长情况。结果显示,在普通培养基上,不同稀释倍数的BL21/pThiohis A和BL21/LEA5的菌斑数相近。在含500 mmol/L NaCl的培养基上,未稀释和稀释10倍的BL21/pThiohis A和BL21/LEA5菌斑数目较多,二者生长情况无明显差别;在菌液稀释100倍和1 000倍时,BL21/pThiohis A和BL21/LEA5菌斑数目差异较大, BL21/LEA5菌斑数目明显多BL21/pThiohis A。在700 mmol/L KCl的培养基上,BL21/pThiohis A和BL21/LEA5表现出与500 mmol/L NaCl类似的生长情况。由此可知,LEA5蛋白的表达使大肠杆菌获得了对高盐(500 mmol/L NaCl和700 mmol/L KCl)的耐受能力(图5)。

图5 BL21/LEA5和BL21/pThioHis A在普通和盐胁迫下的生长情况Fig.5 Growth situation of BL21/LEA5 and BL21/pThiohis A under normal and salt stress
3 讨 论
顺式作用元件是重要的分子开关,有助于了解基因表达调控信息。研究表明多数LEA家族基因启动子具有大量与非生物胁迫的调控有关的元件[21]。ABA在植物逆境胁迫响应过程中发挥着信号分子的作用,ABRE元件是响应ABA的主要顺式作用元件,MYC和MYB与ABA诱导基因的表达调控有关[22-23]。本研究中LEA5基因启动子含有ABRE、MYC和 MYB等顺式作用元件,表明LEA5基因在植物逆境胁迫中发挥重要作用。同时,LEA5启动子区还含有茉莉酸甲酯响应元件(CGTCA-motif),推测LEA5基因可能对茉莉酸甲酯具有响应机制。此外,LEA5基因启动子含有MYB结合位点(MYB binding site,MBS)、TGACG-motif、W-box等元件,W-box是WRKY转录因子的结合元件,而WRKY是植物参与各种生物与非生物胁迫应答的主要转录因子[24]。这些都表明,LEA5基因在纤枝短月藓的抗逆性中起着非常重要的作用,有深入研究的价值。
荧光定量结果显示,LEA5基因在不同时期及不同部位中皆有表达,且在无性世代的孢子体中表达量最高,有性世代的配子体次之,无性世代的配子体最低,揭示LEA5基因可能在无性世代孢子体的生长发育过程中起重要作用,其具体的机制还需进一步探究。
高盐胁迫引起细胞脱水,损伤细胞内的蛋白和细胞膜。大量研究表明LEA基因的表达能够提高植物的耐盐性,有研究者将大豆的PM11、PM30、PM2基因分别转化至大肠杆菌中,重组菌在高盐胁迫下的存活率均明显提高[25-26];还有研究表明SmLEA、SmLEA2基因的过表达提高了大肠杆菌对盐胁迫的耐受性[27-28]。本研究结果显示,重组菌(BL21/LEA5)的耐盐性高于对照菌(BL21/pThioHis A),说明LEA5基因提高了大肠杆菌的耐盐功能,这与前人的研究结果一致。
综上所述,纤枝短月藓LEA5基因启动子区域含有与非生物胁迫的调控有关的顺式作用元件,且在纤枝短月藓不同时期及不同部位均有表达,LEA5基因的异源表达提高了大肠杆菌的耐盐性,可见LEA5基因在纤枝短月藓抗逆性中发挥重要功能。LEA5基因作为一个普遍存在于植物中的抗逆基因,与植物的抗逆性密不可分,将外源LEA5基因转入常见的植物中,培育具有抗旱、耐盐碱等逆境的植物新品种,这对实际的生产具有重要意义。

