酿酒原料及白酒中赭曲霉毒素A和玉米赤霉烯酮的测定方法优化
任 璐,燕玲娟,罗冠龙,桑 涛,刘丽丽
(陕西西凤酒股份有限公司,陕西宝鸡 721400)
真菌毒素是产毒真菌在一定环境条件下产生的次级代谢产物,广泛污染农作物、食品及饲料等植物源性产品[1]。可引起人类和动物急性或慢性中毒,部分已被证实具有致癌、致畸、致细胞突变的“三致”作用。赭曲霉毒素A(Ochratoxin A,OA 或OTA)是一种强力的肝脏毒素和肾脏毒素,并有导致畸形、突变和致癌作用,为此国际癌症研究机构IARC 将其定为ⅡB 类致癌物[2]。玉米赤霉烯酮(Zearalenone 或ZON)是一种特殊毒性的生物毒素,具有类雌激素样作用,能引起动物流产、死胎、返情等生殖机能异常,还可以导致生长下降、免疫抑制、不育、畸形等[3]。为此,严格控制食物及制品中这两种真菌毒素物质的含量,对保障消费者身心安全十分重要。
对于谷物及酒类中赭曲霉毒素A 和玉米赤霉烯酮的检测方法多为采用免疫亲和柱层析净化手段,进行荧光光度法和高效液相色谱法[4-5]、酶联免疫吸附法[6]、液相色谱-质谱法[7-8]。目前采用液相色谱-质谱法已是检测趋势,因为该方法检测限低、精密度高,本研究采用高效液相色谱-质谱联用技术进一步优化,使得方法检测限更低,更有利于酿酒原料及白酒品质的把控,保障白酒安全。
1 材料与方法
1.1 材料、试剂与仪器
样品:原料(高粱、大麦、小麦)、成品酒取自于陕西西凤酒股份有限公司。
试剂:甲酸、乙腈、甲醇、乙酸铵(分析纯)、超纯水、氯化钠、氯化钾、十二水合磷酸氢二钠、磷酸二氢钾、浓盐酸、TritonX-100。
仪器设备:高效液相色谱串联质谱仪(岛津公司HPLC-20A 高效液相色谱仪串联LCMS-8045 质谱仪),万分之一天平(梅特勒-托利多公司),氮吹仪(天津奥特赛恩斯),OTA 免疫亲和柱和ZON 免疫亲和柱(德国拜发),高速均质器(德国IKA)。
标准品:赭曲霉毒素A(OTA 纯度≥98%,Pribo公司),玉米赤霉烯酮(ZON 纯度≥98 %,Pribo 公司)。
1.2 试验方法
1.2.1 样品提取
原粮:准确称取粉碎后的酿酒原粮5 g于50 mL离心管中,加入20 mL提取液a涡旋混匀,静置30 min后高速均质3 min,5000 r/min 条件下离心15 min。准确移取上清液6 mL,加入稀释溶液b X mL,混匀后过玻璃纤维滤纸。收集滤液c,待净化。
白酒:准确吸取6 mL 白酒试样,加入稀释溶液b X mL,混匀后过玻璃纤维滤纸,收集滤液c,待净化。OTA和ZON提取区别见表1。
1.2.2 样品净化
原粮:待免疫亲和柱保护液流净后,取待净化滤液c Y mL,以自然重力流速通过免疫亲和柱,流完后加10 mL 淋洗液d 过疫亲和柱,再用5 mL 超纯水淋洗,自然重力流干后挤干小柱。准确加入1.5 mL 纯有机试剂e 洗脱,再加入1.5 mL 超纯水洗脱,挤干小柱,收集两次洗脱液于同一试管中,待上机。白酒净化条件同原粮一样,具体净化参数见表1。

表1 OTA和ZON的提取、净化参数
1.2.3 标准储备液和工作液
标准储备液:分别称取OTA 和ZON 各1.0 mg,OTA 用甲醇-乙腈(1+1)溶解并定容至10 mL,ZON用乙腈定容至10 mL,分别得到0.1 mg/mL 的OTA和ZON标准储备液,-18 ℃下避光保存。
OTA系列标准工作液:移取赭曲霉毒素A标准储备液0.1 mL 至100 mL 容量瓶中,用甲醇-乙腈(1+1)定容,配成100 ng/mL 的OTA 中间标准液。再分别移取OTA 中间标准液5 mL、2 mL、1 mL、0.5 mL、0.1 mL、0.05 mL 至10 mL 容量瓶中,用提取液定容,分别配成浓度为50 ng/mL、20 ng/mL、10 ng/mL、5.0 ng/mL、1.0 ng/mL、0.5 ng/mL 的系列标准工作液,4 ℃下避光保存。
ZON 系列标准工作液:准确移取玉米赤霉烯酮标准储备液1 mL 至100 mL 容量瓶中,用乙腈定容,配成1 μg/mL 的玉米赤霉烯酮中间标准液。再分别移取中间标准液2 mL、1 mL、0.5 mL、0.1 mL、0.05 mL、0.01 mL、0.005 mL至10 mL容量瓶中,用提取液定容,分别配成浓度为200 ng/mL、100 ng/mL、50 ng/mL、10 ng/mL、5 ng/mL、1 ng/mL、0.5 ng/mL的系列标准工作液,4 ℃下避光保存。
1.2.4 仪器参数条件
液相条件:色谱柱为Shin-pack XR-ODSIII C18(2.0 mm I.D *150 mm L.,3.0 μm);OTA 的流动相A为0.1 %甲酸-5 mmol/L 乙酸铵,B 为乙腈;ZON 的流动相A 为超纯水,B 为乙腈;进样量都为10 μL;柱温OTA 和ZON 分别为30 ℃、40 ℃;流速分别为0.2 mL/min、0.3 mL/min,洗脱方式:梯度洗脱,分别见表2、表3。
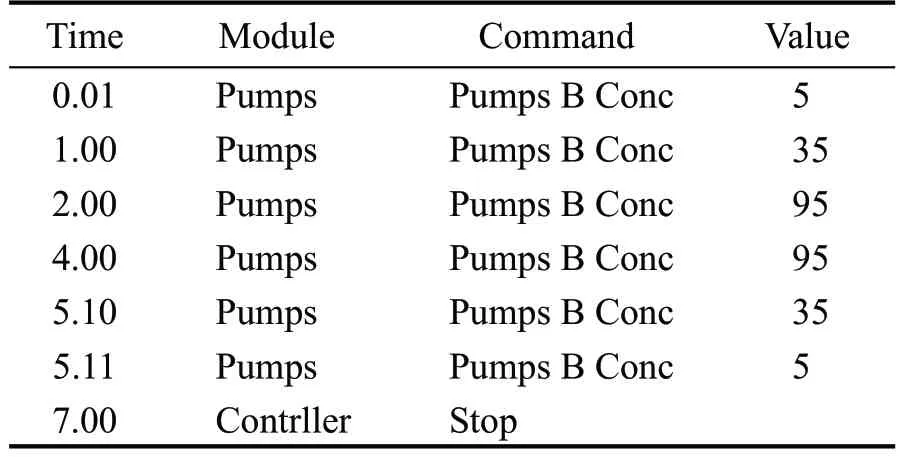
表2 OTA洗脱梯度
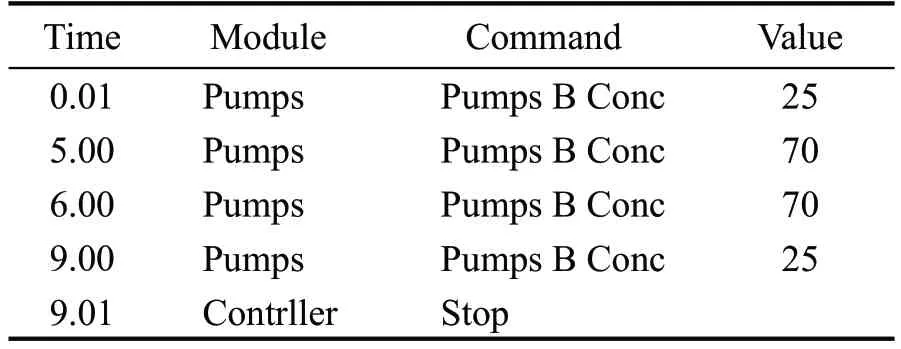
表3 ZON洗脱梯度
质谱条件:两种物质质谱检测条件基本一致,检测方式都为多级反应监测(MRM)扫描;离子源:ESI,负离子扫描模式;OTA 和ZON 检测加热块温度分别为:400 ℃、350 ℃;DL 温度:250 ℃;雾化气流速:3.0 L/min;干燥气流速:10 L/min;驻留时间:100 ms。
2 结果与讨论
2.1 液相、质谱条件的选择和优化
流动相不仅运载样品,而且对于物质的分离、响应至关重要。经过试验最终选择ZON 流动相为乙腈和超纯水,OTA 流动相为乙腈、0.1 %甲酸-5 mmol/L 乙酸铵。这两种物质都采用ESI 负离子的多级检测模式,OTA 和ZON 的定量离子对分别为:402.10>358.10、317.20>175.05,其所得的MRM 色谱图和相对应的质谱图分别如图1、图2所示。
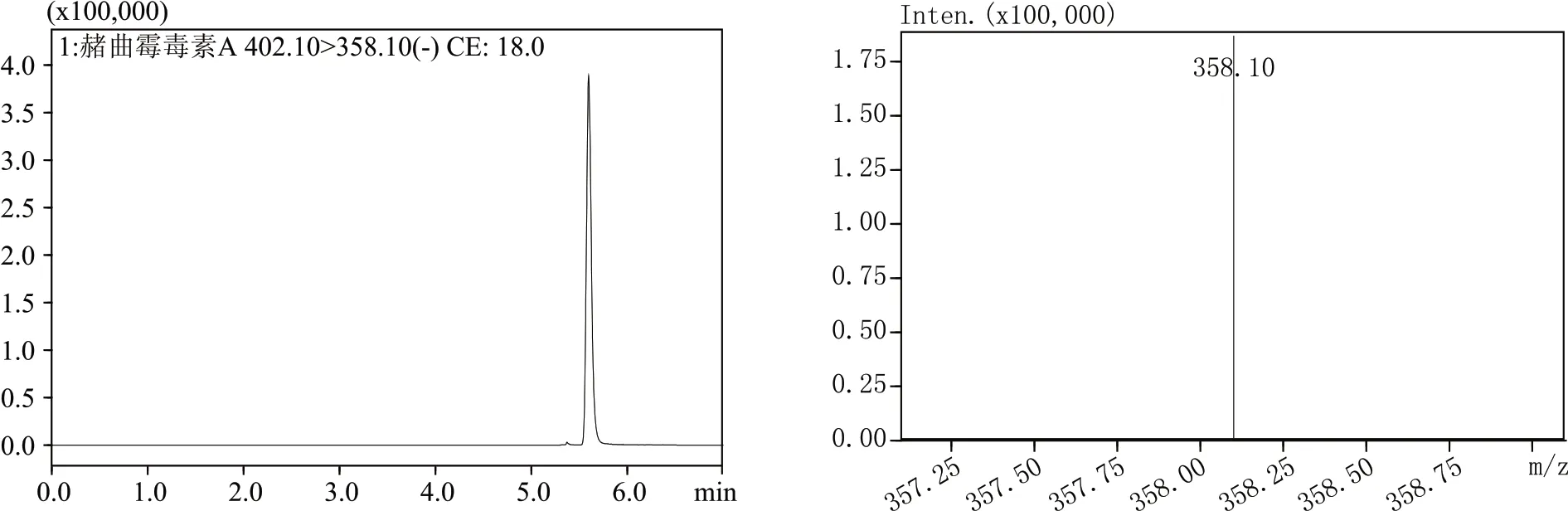
图1 OTA的MRM色谱图和相对应的质谱图
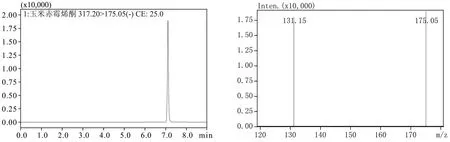
图2 ZON的MRM色谱图和相对应的质谱图
2.2 线性范围
将OTA 和ZON 系列标准工作液按照1.3 分析条件进行测定,外标法定量。以峰面积为纵坐标,浓度为横坐标,绘制校准曲线,如图3、图4 所示。OTA 曲线方程为Y=28038.5X+178.601,相关系数r=0.9999,线性关系良好,方法检出限<0.1 ng/mL。ZON曲线方程为Y=55726.9X+1919.47,相关系数r=0.9999,线性关系良好;方法定量限为0.05 ng/mL,检出限<0.01 ng/mL,低于国标检测方法。
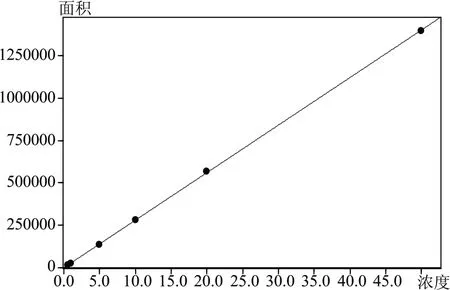
图3 OTA标准曲线
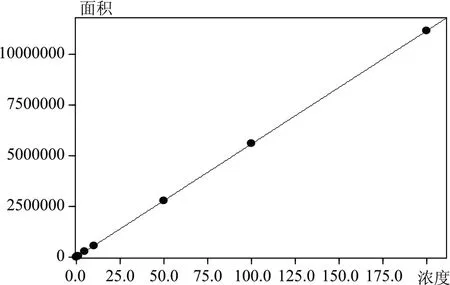
图4 ZON标准曲线
2.3 精密度试验
对不同浓度的标准工作液,分别连续测定6次,考察仪器的精密度,检测浓度重复性结果如表4。结果显示,不同浓度的OTA 和ZON 标准品相对标准偏差(RSD%)在0.67 %~1.68 %之间,仪器精密度良好。
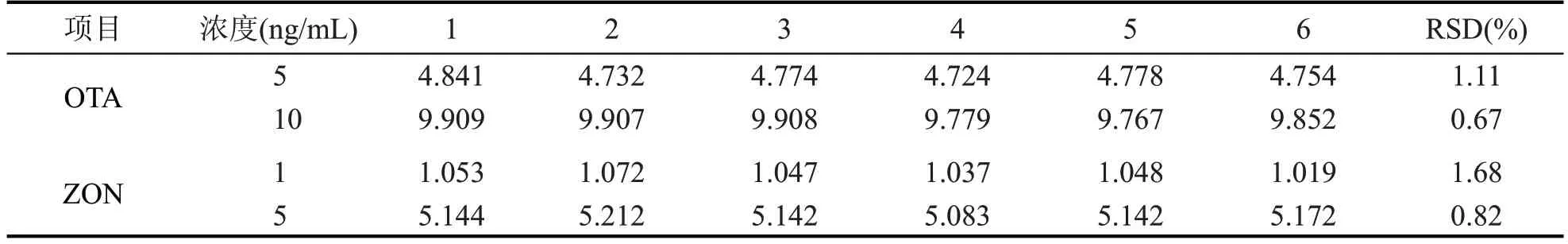
表4 浓度重复性结果(n=6)
2.4 回收率试验
在酿酒原粮及白酒中分别加入一定量的OTA和ZON 中间标准液,得到不同浓度的样品,再根据1.4 的方法进行样品处理,测定其回收率,样品回收率的计算为:(3×检测值-本底值)/加标值,检测结果如表5。在酿酒原粮(高粱、大麦、小麦)及白酒中,OTA 的回收率都在83.76 %~110.04 %之间,完全符合检测要求;在高粱中ZON 的回收率稍大于120%,这与高粱自身的基质有关系,采用质谱检测器,存在基质增强效应;在小麦、大麦、白酒中,ZON的回收率均≤110.04%,符合检测要求。
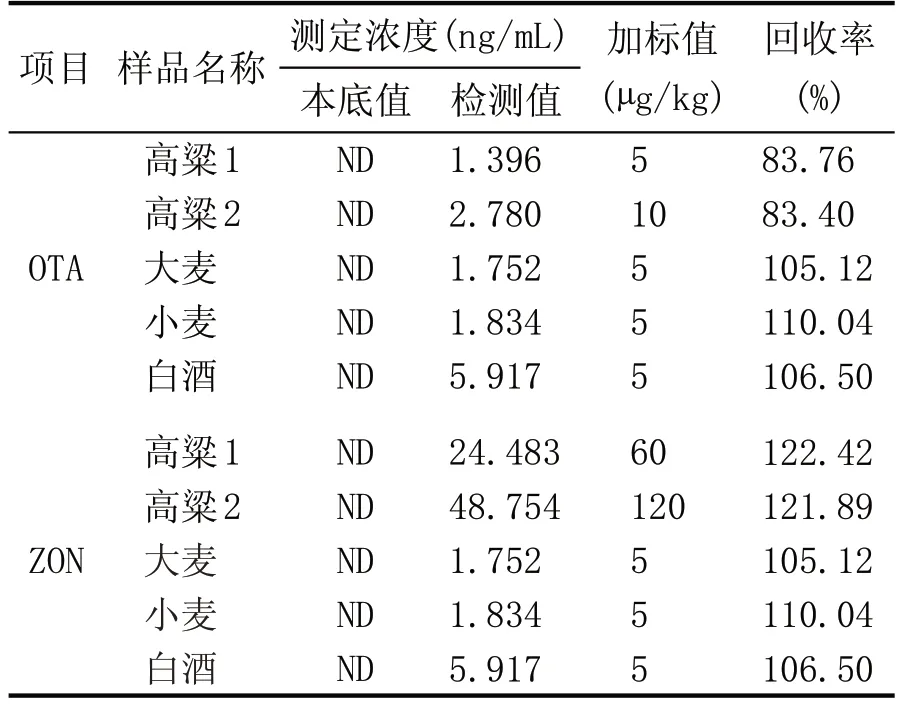
表5 回收率试验结果
3 结论
本研究采用三重四级杆液质联用仪建立了酿酒原料及白酒中赭曲霉毒素A 和玉米赤霉烯酮的检测方法。样品经提取液提取后过免疫亲和柱净化,收集净化液上机检测。结果表明,OTA 和ZON在一定范围内线性关系均良好,r>0.9999,方法检出限均较低(<0.1 ng/mL),在原粮与白酒中回收率主要集中在83.76 %~110.04 %之间,ZON 在高粱中的回收率为122%左右,这主要是高粱基质对MS 检测器的增强效应所致。此方法操作相对简便、快捷,完全符合企业准确检测的需要。

