青稞酒大曲微生物的分离鉴定及可培养微生物变化规律分析
陈占秀,喇录忠,黄和强,车富红,祁万军,孔令武,李善文
(青海互助青稞酒股份有限公司,青海 互助 810500)
酒曲中含有多种微生物及其产生的复杂酶系,是中国白酒酿造必不可少的糖化剂、发酵剂和生香剂[1],由于大曲中微生物种类和数量关系的不同,在白酒生产发酵过程中的代谢产物也不同,加上地域、气候、环境等条件上的差异,各白酒生产企业所用大曲中微生物种类及数量存在较大差异,因而形成了风格风味迥异的白酒产品[2]。由于大曲中微生物的多样性,在大曲培养过程中有霉菌、细菌、酵母菌、放线菌等微生物,丰富的菌系影响着大曲的质量,并进一步影响白酒品质。
青稞香型大曲白酒采用传统工艺制成的“白霜满天星”和“槐瓤曲”作为糖化发酵剂,精选青稞和豌豆以一定比例混合制曲,更适合酿酒微生物对营养的需求,为微生物的生长繁殖创造了良好的条件,独特的制曲原料和工艺也造就了独特的产品风格。青稞酒大曲制作和贮存过程中,微生物随着时间的变化,呈不同的变化趋势,通过研究青稞酒大曲培养过程中微生物数量变化规律,可为分析白酒风格风味提供重要理论依据。目前,对大曲中微生物的研究主要分为表型特征鉴定法和基因型鉴定法。表型特征鉴定法是与微生物分离相结合的,这种方法工作量大,准确率低,但是能得到活的菌株,利于后续研究[6]。如Wang 等[16]通过表型特征鉴定法对茅台大曲中的微生物进行了系统的分离鉴定。基因型鉴定法多是对样品进行总DNA 的提取之后,通过对微生物通用保守序列的比对,从而可以分析鉴定出样品中可培养以及不可培养的微生物,具有快速准确等优点,但是多数得不到活的菌株,不利于后续深入研究。本文结合两种方法,研究了大曲培养过程中细菌、酵母菌、霉菌及菌落总数的变化规律,并对青稞酒制曲和储存期的微生物进行分离和鉴定,为进一步研究青稞酒大曲微生物奠定了基础。
1 材料与方法
1.1 材料、试剂及仪器
样品:青稞酒制曲期和储存期大曲,其中对生产过程中0、1 d、2 d、3 d、4 d、5 d、8 d、12 d、15 d、21 d 和26 d(出房)样品进行采集。大曲贮存期样品:同批大曲入库后每7 d 取样1 次,跟踪取样6 个月。每次4 块大曲,粉碎混合后为1 个样品。在形态学观察的基础上,挑取了22 株细菌进行16S rDNA 序列测序与比对,50 株真菌进行ITS1/ITS2 测序比对。
试剂:无水葡萄糖、蛋白胨、琼脂粉、营养琼脂、孟加拉红琼脂培养基、MRS、冰乙酸,国药(集团)上海化学试剂有限公司;营养琼脂培养基,北京奥博星生物技术有限责任公司;真菌基因组快速提取试剂盒、细菌基因组快速提取试剂盒、酵母提取物、引物27f、1492r、Tris、Taq DNA 聚合酶、DNA 分子量标准Marker、dNTP Mixture,10mM、4S Green 核酸染色剂、EDTA 溶液,pH 8.0、琼脂糖,生工生物工程股份有限公司。
仪器设备:洁净工作台,苏净集团安泰公司;HYG-B 全温摇瓶柜,苏州培英实验设备有限公司;恒温恒湿培养箱,泰斯特仪器有限公司;高压灭菌锅,上海申安医疗器械厂;厌氧工作站、高速冷冻离心机、梯度PCR 仪、蛋白核酸测定分光光度计,美国赛默飞科技公司;凝胶成像系统、电泳仪,北京六一等。
1.2 实验方法
操作流程:取样→粉碎混合→菌悬液→倾倒平皿→稀释涂布平板→培养→平板计数→计算菌落总数→菌种分离纯化→核酸的提取和PCR 扩增测序。
1.2.1 可培养微生物检测与菌种分离纯化[3]
样品预处理:称取5 g 大曲样品,放入100 mL灭菌后的0.9%生理盐水中,30 ℃摇床200 r/min 振荡10 min。
可培养微生物检测:吸取振荡后的菌悬液100 μL,用0.9%的生理盐水稀释到10-1~10-5等不同梯度,分别吸取100 μL 稀释后的各菌悬液在不同培养基上进行涂布培养,培养条件:湿度60%,真菌培养基温度为30 ℃,细菌培养基温度为37 ℃,培养48~72 h,厌氧培养操作在厌氧工作站进行,菌落计数以出现30~300 CFU 细菌和酵母菌菌落数的稀释度的平板为计数标准,丝状真菌为10~150 CFU 之间、无蔓延菌落生长的平板计数[7]。观察记录菌落信息,挑取平板上形态特征不同的单菌落,通过划线纯化,并接种于斜面(4 ℃)保藏和甘油冷冻(-80 ℃)保藏。
1.2.2 核酸提取方法[4]
分离纯化的菌株分别进行液态培养,酵母菌用YPD 液态培养基、细菌用LB 培养基、厌氧菌用PYG 液态培养基,取2 mL 菌液,加入灭菌后的离心管中,12000 r/min 下以4 ℃、2 min 离心弃上清液收集菌体,用基因组快速提取试剂盒进行核酸提取;质量检测:向离心管中加入30 μL 超纯水,溶解核酸;用核酸浓度仪测定核酸浓度和A260/A280 值(1.8~2.0)。
1.2.3 PCR扩增及琼脂糖电泳检测
对所提取的细菌基因组DNA 进行16S rRNA基因片段扩增,采用细菌16S rRNA 基因的通用引物:正向引物F27(AGAGTTTGATCCTGGCTCA),反向引物R1492(GGTTACCTTGTTACGACTT);真菌基因片段扩增选择通用引物:NL1(GCATATCAATAAGCGGAGGAAAAG)NL4(GGTCCGTGTTTCAAGACGG);PCR 采用50 μL 体系,扩增反应条件如表1,反应完成后,取3 μL PCR 产物进行1%琼脂糖凝胶电泳检测,确认PCR扩增片段。
12月4日,上海证券交易所官网公布了一份《西安高新控股有限公司关于修订公司章程及董事长、董事、总经理发生变动的公告》,披露了该公司高层变动的信息。

表1 PCR扩增反应程序
2 结果与分析
2.1 大曲微生物的分离和纯化
将分离到的菌株菌落,通过多次划线纯化挑取,并接种于平板培养基中。经过菌落形态特征排重,从青稞酒大曲中总共分离到37 株酵母菌,13 株霉菌及22株细菌。
2.2 青稞酒大曲微生物的鉴定
2.2.1 青稞酒大曲细菌的鉴定
在对分离的22 株细菌的16S rRNA 基因区序列进行了PCR 扩增并测序,并将细菌的16S rRNA基因区序列在GenBank 数据库中进行同源序列搜索(BLAST)后,将相似度大于99 %鉴定为同一种,98 %~99 %的鉴定为同一属,小于98 %的初步鉴定为新种[6]。对15株细菌进行了鉴定,其中有12株细菌鉴定到种,分属于Staphylococcus succinus,Bacillus atrophaeus,Staphylococcus xylosus,Alcaligenes faecalis,Bacillus subtilis,Klebsiella oxytoca,Pantoea agglomerans,Bacterium strain,Staphylococcus vitulinus,Staphylococcus sciuri,Ochrobactrum pseudintermedium11 个种,2 株鉴定到属,为Bacillus sp、Oceanobacillus sp,另外1 株为Cellulosimicrobium funkei。
2.2.2 青稞酒大曲酵母菌的鉴定
选用通用引物,对分离的37株酵母菌的ITS 基因区序列进行了PCR 扩增并测序,用NCBI Blast 程序将拼接后的37 株酵母菌序列文件与NCBI 核酸数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息,通过比对,相似度大于99%的有10 株共4 种,为Saccharomyces cerevisiae、Meyerozyma guilliermondii、Trichosporon asahii、Wicker-hamomyces anomalus,其余25 株鉴定到属,分属于Millerozyma farinosa,Hyphopichia burtonii,Candida fermentati,Saccharomycopsis fibuligera,Pichia fermentans,Issatchenkia orientalis,Cutaneotrichosporon mucoides,Pichia guilliermondii,Exophiala dermatitidis,Kazachstania unispora,Candida anglica,另外有2 株比对后的相似度只有97 %,初步认为是新种。
2.2.3 青稞酒大曲霉菌的鉴定
选用通用引物,对分离的13株霉菌的ITS 基因区序列进行了PCR 扩增并测序,并将13 株霉菌序列文件与NCBI 核酸数据库中的数据进行比对,1株鉴定到种,为Penicillium granulatum,其余10 株鉴定到属,分属于Penicillium griseofulvum,Aspergillus flavus,Fusarium oxysporum,Aspergillus fumigatus,Aspergillus oryzae,Circinella muscae,Lichtheimia corymbifera,Rhizopus,另外两株相似度为97%,初步认为是新种。
2.3 青稞酒大曲制曲期微生物消长规律
青稞酒大曲中细菌数量最高,其次为酵母菌,霉菌数量最少,如图1 所示。微生物数量前期变化较大,曲心温度最高时,细菌和酵母菌数量略有降低,除此之外,整体微生物数量呈上升趋势,5 d左右达到最高后基本趋于稳定,出房时细菌略有下降。
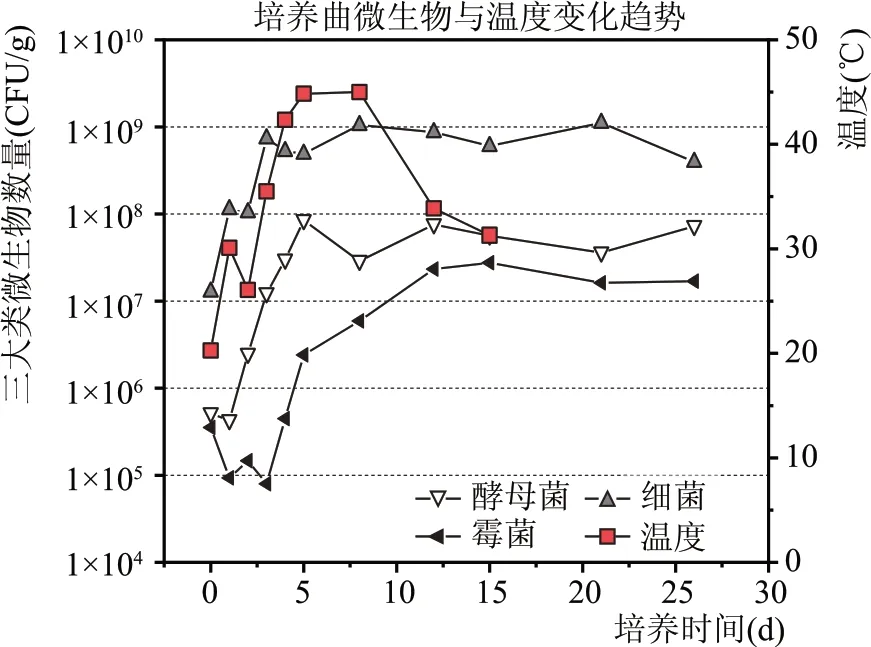
图1 青稞酒大曲制曲期微生物数量变化规律
2.3.1 细菌数量消长规律(图2)
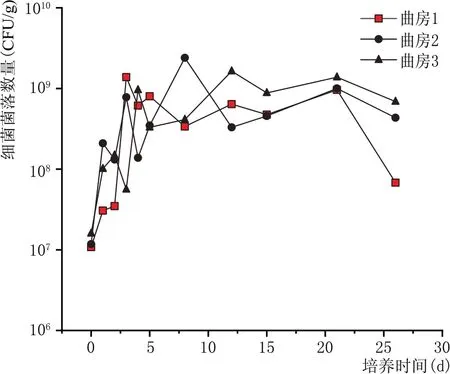
图2 青稞酒大曲制曲期细菌数量变化规律
由图2 所示,在一个培养周期内,由于大曲培养方式的开放性,各曲房曲存在一定差异,细菌数量也存在一定差异,总体规律表明,细菌数量在培养初期快速增加,4~5 d 达到最大值,后期基本保持平衡,培养结束时略有下降,以均值计,细菌总数为5.5×108个/g 曲坯,细菌中Pantoea和Staphylococcus占有很高的优势,从培养2 d 至培养结束,Pantoea比例为细菌总数的50 %~65 %,Staphylococcus为10%~25%。
2.3.2 酵母数量消长规律(图3)
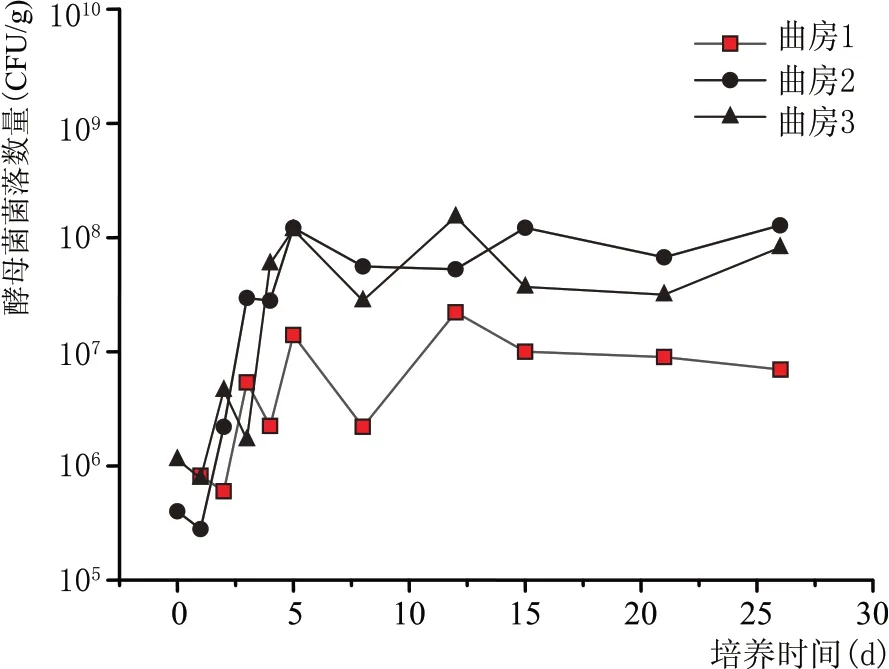
图3 青稞酒大曲制曲期酵母菌数量变化规律
因各曲房制曲存在一定差异,酵母菌数量也存在一定差异,尤其酵母菌受温度和水分影响大,因此酵母菌差异较大,如图3 所示,随着曲房温度升高,酵母菌在2~5 d内快速增长,后随着曲房降温,酵母菌数量略有降低,在10~15 d 又有增加并达到最大值,后期基本保持平衡。以均值计,酵母菌总数为3.6×107个/g 曲坯,从第3 天开始一直到出房,Saccharomycopsis占有很高的优势,从2 d时的20%到5 d 时快速增加到70%~80%,到培养结束时仍占酵母菌总数的80%,同时Pichia、Wickerhamomyces也有一定的优势性。
2.3.3 霉菌数量消长规律(图4)
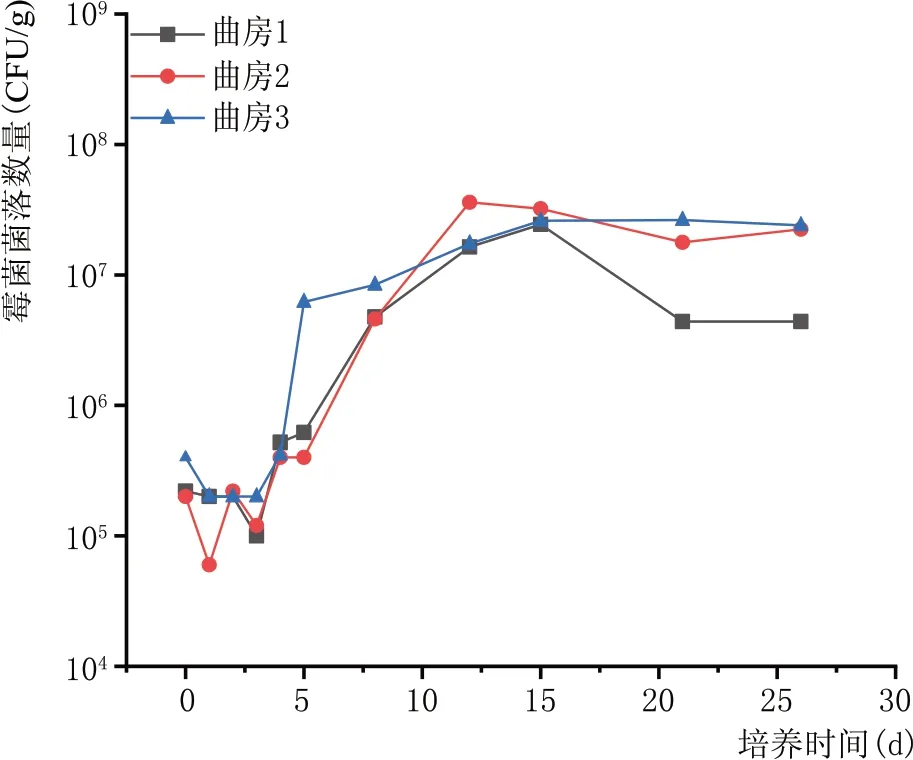
图4 青稞酒大曲制曲期霉菌数量变化规律
由于大曲培养方式的开放性,各曲房曲存在一定差异,如图4 所示,总体规律表明,霉菌数量在培养过程中先基本不变,5 d 后开始大量繁殖,15 d 左右数量达到最高,后期略有降低。这主要由于前期升温快不利于霉菌繁殖,细菌和酵母菌数量急速增加,后期温度上升减缓,大曲水分适宜霉菌生长繁殖,培养到15 d 时大曲水分已降到15%以下,不利于霉菌的生长,霉菌数量略微下降,以均值计,霉菌总数为8.5×106个/g 曲坯,主要优势菌为根毛霉属(Rhizomucor)。
2.4 青稞酒大曲贮存期微生物消长规律
青稞酒大曲在培养结束后,经过水分、酸度、糖化力、液化力等理化指标检测,以及曲香、表面挂霉程度、断面齐整度、菌丝情况、曲皮等感官指标检验,符合成曲要求的按不同等级贮存3 个月以上再进行酿酒实验,贮存环境要求低温干燥。随着贮存时间延长,微生物多样性也在发生变化,杜海等[11]通过对不同贮存时期大曲的微生物群落结构的分析,发现3 种大曲相对丰度靠前的优势菌属主要为乳酸菌属、芽孢杆菌属、明串珠菌属、魏斯氏菌属、链霉菌属、短杆菌属等。随着贮存时间的延长,3种大曲的物种多样性都处于上升趋势。
对青稞酒大曲贮存期微生物进行了可培养检测,由图5 可看出,大曲储存期内霉菌数量持续降低,细菌略多于酵母菌,在储存后期缓慢降低,酵母菌保持稳定,因酵母菌中优势菌为Saccharomycopsis fibuligera,青稞酒酿造车间、大曲车间、曲库的环境中大量存在该菌种;霉菌方面贮存第一个月Lichtheimia corymbifera比例占5 %~10 %,后期缓慢减少;细菌可培养优势菌贮存前期为Oceanobacillus sp,Pantoe,Staphylococcus等,占细菌总数60%左右,后期减少到20%~25%。
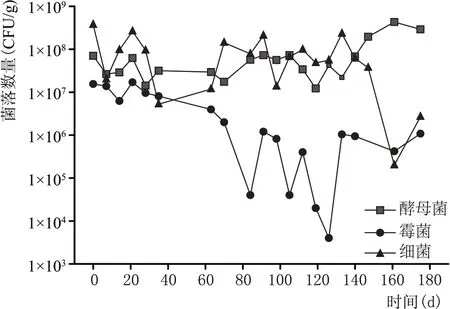
图5 青稞酒大曲贮存期微生物数量变化规律
3 结论
大曲中细菌、霉菌和酵母菌三者数量占据绝对优势,青稞酒大曲也不例外。本研究利用传统分离方法结合PCR 测序技术,从三大类微生物方面入手,系统分析了青稞酒大曲微生物的群落组成及多样性。结果表明,大曲培养期中细菌数量最多,第0~5 d 是大曲的培菌期,这个时期微生物大量增长,导致温度不断上升,环境越来越不适宜微生物的繁殖,3 d 后酵母菌中适宜表面生长的菌种Saccharomycopsis快速增加到70 %~80 %,到培养结束时仍占酵母菌总数的80%,同时Wickerhamomyces也有一定的优势。在整个大曲培养过程中Pantoea(泛菌属)占到绝对的优势,从2 d 开始增加到50 %,培养结束时达到70 %,Staphylococcus(葡萄球菌属)也具有很高的优势。
本次通过纯培养方法分离青稞酒大曲微生物,分离到22 株细菌,37 株酵母菌,13 株霉菌。通过分子生物学鉴定,其中有15 株细菌主要为球菌属(Staphylococcus)4 株,杆菌属(Bacillus)3 株,产碱菌属(Alcaligenes)2 株,克雷伯氏菌属(Klebsiella)2株,泛菌属(Pantoea)1 株,海洋杆菌属(Oceanobacillus)1 株;霉菌主要有青霉属(Penicillium)2 株,曲酶属(Aspergillus)3 株,镰刀菌属(Fusarium)1 株,卷霉属(Circinella)1 株,横梗霉属(Lichtheimia)1 株,毛霉属(Mucor)1 株,根毛霉属(Rhizomucor)1 株,根霉属(Rhizopus)1 株;37 株酵母菌有异常维克汉姆酵母属(Wickerhamomyces)7 株,季也蒙酵母属(Meyerozyma)1 株,假丝酵母属(Candida)2 株,有孢圆酵母属(Torulaspora)1 株,毕赤酵母属(Pichia)5 株,粉酵母属(Millerozyma)3 株,丝孢毕赤氏酵母属(Hyphopichia)4 株,伊萨酵母属(Issatchenkia)3 株,酿酒酵母属(Saccharomyces)5 株,覆膜孢酵母属(Saccharomycopsis)1 株,以及4 株Exophiala dermatitidis,1株Kazachstania unispora。
因技术方法的限制,以往对大曲微生物群落多样性的认识仅依赖于传统的形态特征、生理生化特性的分类和鉴定[10]。高通量测序的应用可一次性对106~108数量级的DNA分子进行序列测定,目前在食品发酵领域被广泛采用[14]。乔晓梅等[15]扩增清香大曲真菌18S V4 区和ITS 区后,对扩增产物进行高通量测序,发现米根霉Rhizopusoryzae、伞枝犁头霉Lichtheimia corymbifera、库德毕赤酵母Pichia kudriavzevii和库德毕赤酵母Saccharomycopsisfibuligera等为优势种群[13]。青稞酒大曲也利用高通量测序解析了大曲中微生物群落结构和组分,统计发现,真菌群落中从第3天开始一直到出房,Saccharomycopsis占有很高的优势,同时Pichia、Wickerhamomyces也有一定的优势性。整个过程中Pantoea(泛菌属)占到绝对的优势,Staphylococcus也具有很高的优势,初步判定青稞酒大曲中优势菌:细菌为Pantoea、Staphylococcus,真菌包括Pichia、Saccharomycopsis,除此之外青稞酒大曲中还有Lactobacillus、Leuconostoc、Pediococcus、Aureobasidium、Acinetobacter、Olivibacter等(数据未发表),与可培养微生物规律和优势菌种结论基本一致。
大曲本身作为一种选择性培养基质,对各类酿造环境微生物进行富集筛选,形成了独特的大曲菌群结构,随着现代分子生物学技术的发展,菌种分析手段正向着新老技术联用的方向快速发展,在弥补方法缺陷的同时,拓展大曲微生物的研究范围[12]。在青稞酒酿酒微生物研究中结合新老技术,如用高通量测序等方法对青稞酒不同季节大曲中的菌群结构及多样性进行更为全面、实时、精确的分析,并结合代谢组、蛋白组等的研究,分析青稞酒大曲中不同功能菌对制曲和酿酒的影响,结合传统微生物分离技术,筛选更多青稞酒酿造微生物,为今后功能菌的筛选及强化大曲提供科学依据。

