数字乳腺三维断层摄影与MRI对致密型乳腺中乳腺癌的诊断性能对比分析
敬文波,肖兰,汪湍,刘艳
2018年全球新发乳腺癌208万例,占所有癌症的11.6%,位列女性癌症首位。乳腺癌发病率自30岁开始随年龄逐年增长,40岁后增长迅速,55岁达高峰,5年总体生存率约73%,是严重威胁我国女性同胞健康的主要疾病之一[1]。当前公认的乳腺癌检出黄金标准是三联评估:临床检查;乳腺X线检查和/或超声检查;细针穿刺细胞学检查。研究显示乳腺X线筛查总体敏感度为81%,但因为X线摄影片为重叠影像,病灶容易被致密的纤维腺体组织遮蔽,对乳腺致密人群的敏感度则较低,为74%甚至更低[2]。鉴于以上不足,近年来很多研究者致力于评估其他检查方式在乳腺癌筛查中应用的可行性,旨在进一步提高乳腺癌早期检出率。本研究以致密乳腺人群作为研究对象,对比分析数字乳腺三维断层摄影(digital breast tomosynthesis,DBT)及MRI的诊断效能。
材料与方法
1.一般资料
回顾性分析2018年8月-2019年7月在新疆医科大学附属肿瘤医院行DBT及MRI检查的486例致密乳腺(不均匀致密类+极度致密类)患者的病例资料,年龄25~69岁,平均(48.0±8.0)岁。均有术后病理资料,且所有检查均在穿刺、手术等有创操作前完成。排除标准:①检查间隔时间超过2周;②既往有乳腺手术史或胸部放疗病史;③确诊患者治疗后复查;④图像质量达不到质控要求。
2.检查方法
DBT检查方法:采用美国Hologic Selenia Dimensions数字化乳腺三维断层摄影系统,取头尾位(craniocaudal,CC)和内外侧斜位(mediolateral oblique,MLO),压力15~25 lbs,combo模式自动曝光,同一压迫体位同时获得二维及三维断层图像,重建的断层图像层厚1 mm。45~60 mm厚乳房的单视图平均腺体剂量(ASD)为1.4~1.8 mGy。MRI检查方法:采用Siemens(Magnetom Verio Tim,3.0T)MR仪及乳腺专用线圈,扫描序列与参数:平扫横轴面FSE T1WI、T2Tirm序列;患侧矢状面FSE脂肪抑制T2WI序列;横轴面扩散加权成像(diffusion weighted imaging,DWI),b=800 s/mm2。动态增强MRI采用T1压脂的横轴面3D-FLASH序列,对比剂采用钆喷酸葡胺0.2 mL/kg,2.5 mL/s高压静脉团注,后采用20 mL生理盐水以相同流率冲管。对比剂注射前扫一期蒙片,待观察脂肪抑制图像质量满意后,注药与扫描同时启动,连续7期,每期时长约1 min。
3.图像分析
经计算机处理后的数字化图像分别由2名5年以上主治医师在不知道病理结果的前提下使用PACS系统在Barco5M双屏显示器盲法独立评估,若意见不同,通过讨论取得共识。ADC值测量在Siemens Syngo MRI 17图像处理工作站进行。DBT主要观察指标:①乳腺构成;②肿块(形态、边缘、密度、最大径、左/右乳及象限);③钙化(良性钙化,可疑恶性钙化及形态、分布、部位);④有无结构扭曲、非对称致密;⑤有无皮肤增厚、乳头凹陷,腋窝淋巴结肿大等。MRI主要观察指标:①纤维腺体组织量;②背景实质强化水平;③病灶定位及最大径;④形态学表现(灶状强化,肿块形态、边缘、内部强化特征,是否有非肿块样强化及其分布、内部强化特征);⑤动态增强后血流动力学表现(早期强化率,时间信号曲线:递增型、平台型、流出型);⑥DWI信号特点;⑦其他伴随征象(皮肤增厚、乳头凹陷、乳腺水肿、腋窝淋巴结肿大、胸肌受累等)。并按照第5版X线乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)及第2版乳腺MRI BI-RADS给出最终评估分类,1~3类代表良性,4~5类代表恶性。以组织病理结果为金标准。
4.统计学方法
采用Excel 2003整理和统计数据,采用IBM SPSS Statistics 25进行统计学分析,连续资料采用均数±标准差描述,DBT与MRI诊断评价对比采用McNemar检验进行统计分析。采用绘制受试者操作特征(receiver operator characteristic,ROC)曲线分析评估两种检查方法的诊断效能,曲线下面积(areas under curve,AUC)组间比较用Z检验分析。以P<0.05为差异具有统计学意义。
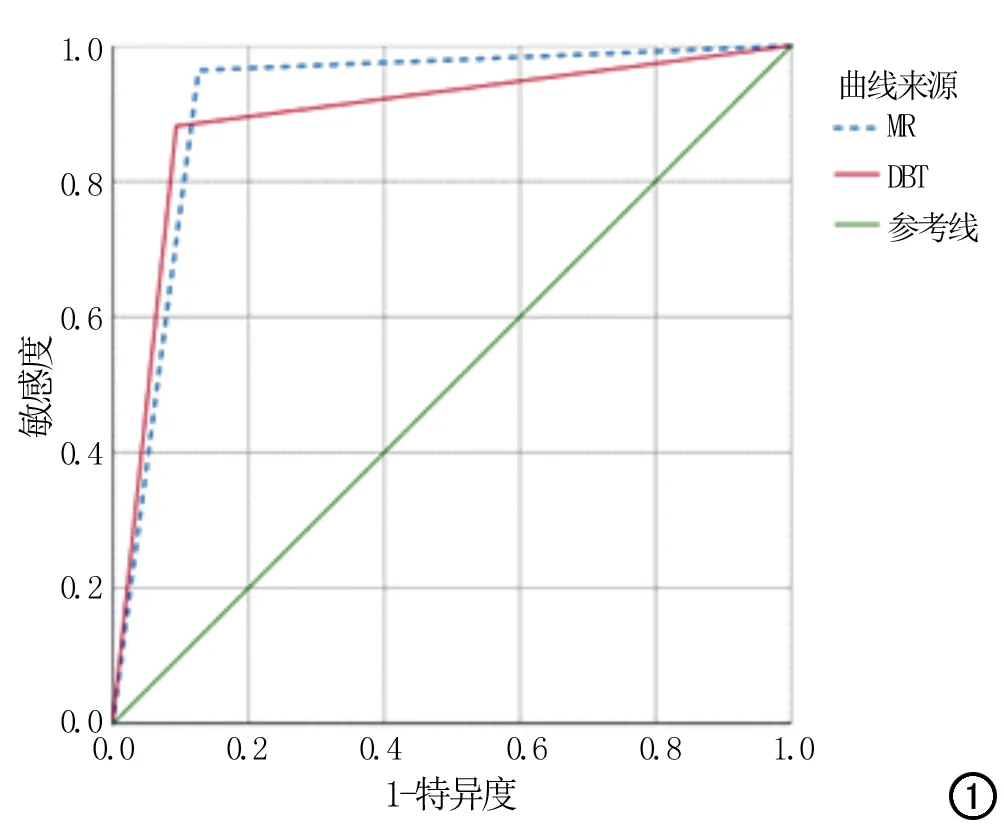
图1 DBT、MRI对致密型乳腺中乳腺癌诊断的ROC曲线。

表1 DBT、MRI对486个病灶的诊断价值分析
结 果
486例致密型乳腺中,入组病例年龄最小的31岁,最大的69岁,平均(48.0±8.0)岁。乳腺纤维腺体组织分类为不均匀致密c类者477例,极度致密类d类者9例。
病理结果显示乳腺癌占62.6%(304/486),其中浸润性导管癌86.2%(262/304),浸润性小叶癌1.0%(3/304),导管原位癌7.9%(24/304),小叶原位癌0.3%(1/304),粘液癌1.3%(4/304),其他恶性肿瘤2.3%(7/304)。良性病灶占37.4%(182/486),其中纤维腺瘤占44.5%(81/182),导管内乳头状瘤18.7%(34/182),脂肪瘤1.1%(2/182),脂肪坏死1.1%(2/182),良性叶状肿瘤1.1%(2/182),炎性病变9.3%(17/182),腺病伴或不伴导管扩张17.6%(32/182),导管扩张6.6%(12/182)。
1.DBT、MRI对致密乳腺中乳腺癌的诊断价值对比
DBT、MRI的总体诊断敏感度、特异度、符合率、阳性预测值、阴性预测值及95%置信区间(CI)见表1。对比分析,DBT对致密乳腺的诊断敏感度、阴性预测值均低于MRI,两者差异有统计学意义(P均<0.001)。其余各组差异无统计学差异(P>0.05)。
DBT、MRI对致密型乳腺中乳腺癌诊断的ROC曲线见图1。二者的AUC值(95%CI)见表2,分别为0.894(0.862~0.926)、0.919(0.888~0.950),差异无统计学意义(P=0.269)。

表2 DBT、MRI在致密型乳腺诊断的ROC曲线下面积AUC比较
2.DBT、MRI对不同年龄组致密乳腺的诊断价值对比
486例致密乳腺中,≤40岁组共81例,乳腺癌占42.0%(34/81),其中浸润性导管癌33例(97%),乳头状癌1例(3%);良性病变占58.0%(47/81)。41~50岁组共245例,乳腺癌占59.2%(145/245),其中浸润性导管癌123例(85%),导管原位癌14例,小叶原位癌1例,浸润性小叶癌1例,导管内乳头状癌2例,粘液癌1例,其他恶性肿瘤2例;良性病灶占40.8%(100/245)。>50岁组共160例,乳腺癌占78.1%(125/160),其中浸润性导管癌105例(84%),导管原位癌10例,浸润性小叶癌2例,导管内乳头状癌1例,粘液癌3例,其他恶性肿瘤4例;良性病灶占21.9%(35/160)。
年龄≤40岁组浸润性导管癌占比最高(97%),影像学多表现为不规则肿块伴或不伴可疑钙化,DBT、MRI特征性图像见图2。该年龄组乳腺癌的诊断中,DBT、MRI与病理金标准诊断一致性Kappa值分别为0.823、0.825,均具有很好的诊断价值;DBT与MRI对该组恶性病灶诊断的敏感度、特异度、AUC差异均无统计学意义(P均>0.05)。在41~50岁致密乳腺中,MRI诊断敏感度较DBT提升13.8%,差异有统计学意义(P<0.001);二者间特异度及AUC差异无统计学意义。在大于50岁年龄组的致密乳腺中,DBT、MRI诊断敏感度、特异度及AUC组间差异均无统计学意义(P均>0.05,表3)。
3.DBT、MRI对致密乳腺中不同大小病灶的诊断价值对比分析
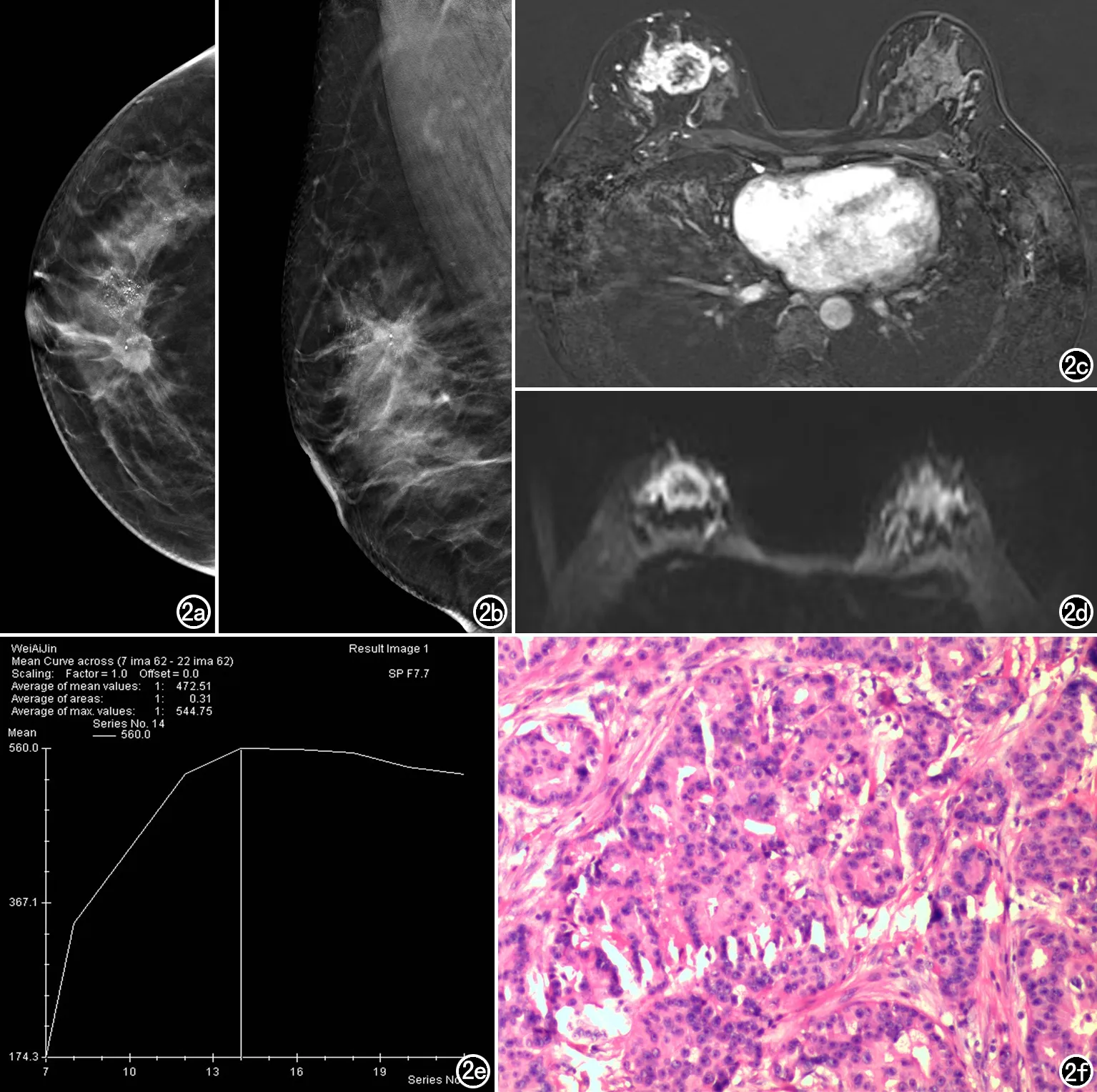
图2 女,36岁。a) DBT示右乳头后方偏内侧不规则形稍高密度肿块,见毛刺,其外侧见成簇分布细小多形性钙化; b) DBT示肿块位于内上象限,边缘浸润; c) MRI增强示右乳内上象限肿块环状明显强化; d) DWI示病灶呈环状高信号; e) TIC曲线呈“流出”型; f) 病理为浸润性导管癌伴中级别导管原位癌。

表3 不同年龄组DBT、MRI诊断价值对比分析
入组病例中,≤2 cm病灶共有276例,病理结果显示良性者21.0%(58/276),乳腺癌占79.0%(218/276),其中浸润性导管癌87.6%(191/218),浸润性小叶癌0.9%(2/218),导管原位癌6.9%(15/218),小叶原位癌0.5%(1/218),粘液癌1.4%(3/218),导管内乳头状癌1.4%(3/218),其他恶性肿瘤1.3%(3/486)。入组病例中,>2 cm病灶共144例,其中乳腺癌占59.7%(86/144),良性病灶40.3%(58/144)。
DBT、MRI对≤2 cm病灶的诊断敏感度、特异度及AUC见表4,在该组病例中,MRI诊断敏感度较DBT提升10%,二者差异有统计学意义(P<0.001),其余各组间差异无统计学意义。DBT、MRI对>2 cm病灶的诊断敏感度、特异度及AUC差异均无统计学意义(P均>0.05)。
讨 论
影像学对乳腺癌的应用价值主要包括未病筛查、疾病诊断、术前浸润范围评估、术前术中定位及治疗后(或术后)随访等。目前乳腺癌影像学筛查主要通过全数字化乳腺X线摄影(full field digital mammography,FFDM)和/或超声检查,但FFDM对致密型乳腺诊断敏感度明显降低,超声对致密乳腺相对较好,但结果受操作者手法等因素影响,主观性较强。因而临床上迫切需要其它可行且便捷的客观检查手段作为致密乳腺诊断及评估的补充。
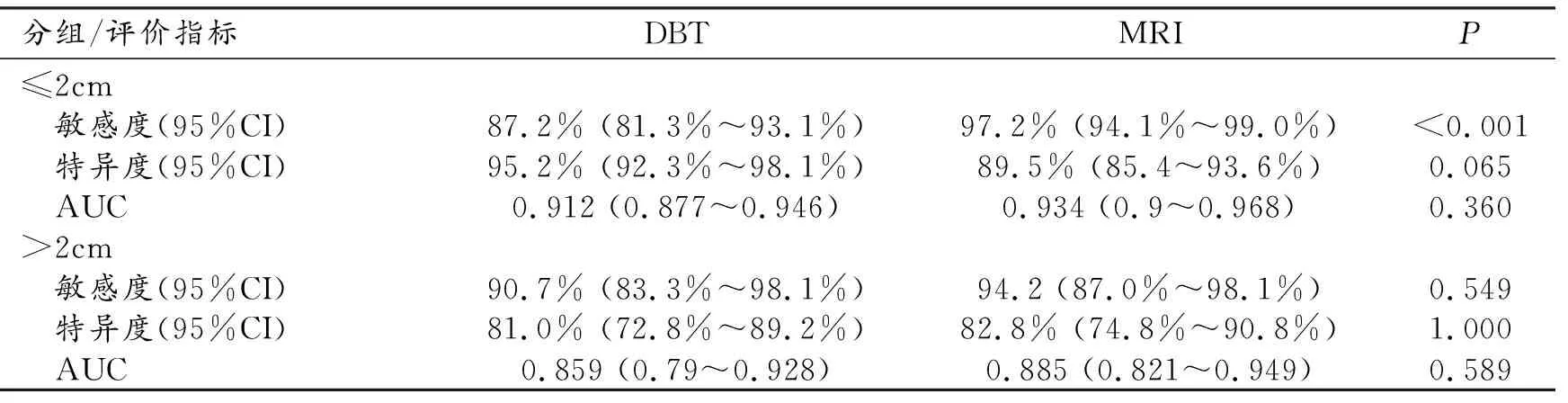
表4 DBT、MRI对不同病灶大小分组的诊断价值对比分析
1.DBT与MRI对致密乳腺中乳腺癌诊断价值对比分析
基于FFDM发展而来的DBT,具有X线对微钙化的敏感度优势,同时还能最大限度减少前后重叠腺体对病灶显示的影响。近年国内外大量学者进行了DBT与FFDM的诊断效能对比,均表明DBT在致密型乳腺中肿块的检出率、敏感度相比FFDM显著提高,同时能更好地显示肿块边缘、病变周围结构及病变范围等[3],为临床治疗提供更多的参考。MRI是一种无创性检查方法,能获得轴、矢、冠多角度断层图像,避免了正常腺体对病灶的遮蔽,结合动态增强后血流动力学表现及DWI信号特点,能获得更丰富的影像学信息。能较好区分致密纤维腺体乳腺组织和乳腺恶性肿瘤,特别是年轻绝经前妇女及有较高密度乳腺组织的女性受益。研究显示MRI对致密乳房中乳腺癌检出的敏感度和准确度相比非致密乳房并没有明显减低[4]。最新的研究数据表明,术前乳腺MRI最有可能检出以下三类常规影像学检查容易漏诊的病灶:①生物学特性为浸润性小叶癌或高侵袭性乳腺癌(如三阴性乳腺癌);②患者乳腺组织致密或年龄偏小,特别是年龄<60岁;③临床高度疑似而超声或FFDM阴性或腋窝淋巴结阳性而未发现乳腺病变者[5]。该研究486例致密乳腺样本中,DBT敏感度为88.2%(268/304),MRI为96.4%(293/304),与阳君等[6]报道MRI对乳腺癌诊断敏感度98.35%相近。Förnvik等[7]研究表明DBT在脂肪性乳房女性的诊断性能与MRI相当,但在致密型乳腺人群中,MRI具有更高的诊断效能,同时动态增强MRI在术前肿瘤大小评估上也更具优势。文献报道两位医师采用MRI诊断的AUC为0.88/0.89,采用乳腺X线摄影诊断的AUC为0.64/0.69[8];本研究MRI、DBT的AUC分别为0.919、0.894,与范文文等[9]等研究DBT与MRI诊断乳腺癌AUC结果相似。二者AUC采用Z检验显示差异无统计学意义,总体诊断效能相当,考虑与MRI敏感度较高,但特异度较DBT略低有关。
2.DBT及MRI对不同年龄层乳腺癌诊断价值对比分析
在不同年龄组病灶中,≤40岁组乳腺癌占比最低(42%),41~50岁致密乳腺组乳腺癌59.2%,>50岁组乳腺癌占比最高(78.1%),与我国乳腺癌40岁以上明显上升,55岁左右达高峰的发病趋势一致。对年龄≤40岁组致密乳腺的诊断中,DBT、MRI与病理金标准诊断一致率Kappa值分别为0.823、0.825,均具有很好的诊断价值。该年龄组恶性病灶诊断敏感度MRI高于DBT,特异度MRI低于DBT,但差异均无统计学意义。考虑与该年龄组癌灶多为浸润性导管癌,且多以不规则肿块伴或不伴可疑钙化为特征性影像学表现有关。与张莹莹等[10]报道青年女性乳腺癌多为肿块型一致。在41~50岁组致密乳腺中,DBT对乳腺癌诊断敏感度为84.1%(122/145),MRI诊断敏感度为97.9%(142/145),MRI较DBT敏感度明显提高,差异具有统计学意义。在>50岁组的致密乳腺中,MRI诊断敏感度较DBT略高,但差异无统计学意义。该研究将致密乳腺人群按不同年龄分层分析,MRI诊断优势更多体现在41~50岁区间。既往文献多报道MRI与FFDM或MRI与超声对乳腺癌诊断价值分年龄对比分析。Chiarelli等[11]认为MRI加做FFDM筛查40~49岁女性,相比仅做MRI进行筛查乳腺癌的敏感度在明显提高,对50~69岁年龄段的女性MRI加做FFDM筛查乳腺癌的敏感度更高。考虑年龄越大,乳腺癌合并钙化比例越高有关,乳腺X线微钙化高度敏感,与MRI优势互补。
3.DBT及MRI对不同大小乳腺癌诊断价值对比分析
根据乳腺癌的pTNM分期,原发肿瘤最大径≤2 cm为pT1期。多数学者认为病灶最大径≤2 cm的乳腺癌称小乳癌[12],属于早期乳腺癌。此次研究的304例乳腺癌中,小乳癌占71.7%(218/304)。小乳腺癌的肿块形态、边缘、密度表现往往不典型,且小肿块更容易被致密腺体重叠遮挡,因此FFDM容易漏诊。既往研究显示DBT在小乳腺癌的诊断符合率较FFDM明显提升[13]。有研究表明MRI是检测早期乳腺癌(肿瘤分期为0~Ⅱ期、病灶<2 cm、原位癌等)检出率、诊断符合度均高于常规FFDM及DBT[14];本研究中MRI诊断敏感度(97.2%)明显高于DBT(87.2%),与前述结果相仿。MRI对小乳癌诊断敏感度与钟琦等[15]报道的96.5%基本一致;MRI拥有高软组织分辨力,除了通过对肿块边缘情况的判定,还能结合DWI信号特点、内部强化特征及时间信号曲线等多信息的补充,相比DBT对小乳癌更具优势。本研究致密乳腺中癌灶>2 cm时DBT诊断敏感度较MRI略低,但差异无统计学意义。因此,小乳腺癌人群行MRI检查受益最大。
本研究的不足之处:未考虑MRI检查预约等候及检查时间、检查费用等医疗成本和治疗获益等前提假设,也未考虑DBT相对辐射剂量影响,而对MRI与DBT敏感度和特异度等赋予了相同的权重。实际上,每种检测方法的诊断评价对于疾病而言肯定是具有不同的意义,因而赋予权重也应该不同,这时候就需要计算加权约登指数,本研究未涉及。

