慢性阻塞性肺疾病合并糖尿病患者临床特点及相关因素分析
哈斯棍
内蒙古包头市蒙医中医医院呼吸内科,内蒙古包头 014040
在呼吸系统疾病中,慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的病死率、发病率均较高,且会导致社会经济负担严重加重[1]。近几年COPD患病率不断增高,且大部分地区约有20%左右老年患病率,特别是合并糖尿病 (diabetes mellitus,DM)的COPD患者不断增多,严重影响到了患者的精神和生活健康[2]。对于COPD合并DM患者,临床治疗费用较高,导致多数患者治疗不及时,进一步加重了病情[3]。因此该文以2019年1月—2020年10月为时限,以接受治疗的COPD合并DM者100例为研究组,以同期单纯COPD者100例为参照组,即分析了COPD合并DM患者的相关因素及临床特点,现报道如下。
1 资料与方法
1.1 一般资料
该次研究以接受治疗的COPD合并DM者100例为研究组,以同期单纯COPD者100例为参照组。总结分析患者基础信息:研究组52例男性、48例女性;年龄最大78岁、最小30岁,平均(48.9±6.5)岁。参照组53例男性、47例女性;年龄最大79岁、最小31岁,平均(48.7±6.2)岁。经统计软件处理各组相关数据,两组一般资料差异无统计学意义(P>0.05),具有可比性。
纳入标准:均满足2013年修订版COPD诊治指南[4];研究组还满足美国糖尿病学会相关诊疗指南标准[5](2014年);研究组无其他除DM以外病史;均知晓该次试验,且签订同意书。排除标准:妊娠期女性;合并重要器官心肝肾等功能障碍;精神疾病等;严重心律失常;肺结核;肺性脑病;肺炎;胸腔积液;心力衰竭;肺栓塞;支气管哮喘;气胸等[6]。该研究满足伦理委员要求和标准。
1.2 方法
收集分析参照组和研究组相关临床资料,包括激素及抗生素治疗时间、并发症(肺源性心脏病、呼吸衰竭类型)、性别、年龄等;测试肺功能,仪器为德国耶格公司提供的肺功能仪(Master ScreenPFT型),包括FEV1(第一秒用力呼气容积)/FVC(用力肺活量)、FVC/预计值、FEV1/预计值等指标;测定炎症因子,仪器为瑞士罗氏公司提供的电化学发光仪(roche modula E170型)、美国贝克曼公司提供的速率散射比浊仪(bechman immage 800型),包括IL-6(白介素-6)、CRP(C反应蛋白);开展痰培养,观察致病菌种类。
1.3 统计方法
应用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以[n(%)]表示,组间比较采用χ2检验;分析COPD合并DM的相关因素,方法为多因素Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 参照组和研究组临床特点对比
参照组和研究组对比激素、抗生素等治疗时间、肺源性心脏病、Ⅱ型呼吸衰竭、≥2种致病菌、IL-6、CRP、FEV1/FVC、FVC/预计值、FEV1/预计值等水平的数据,差异有统计学意义(P<0.05),见表1。
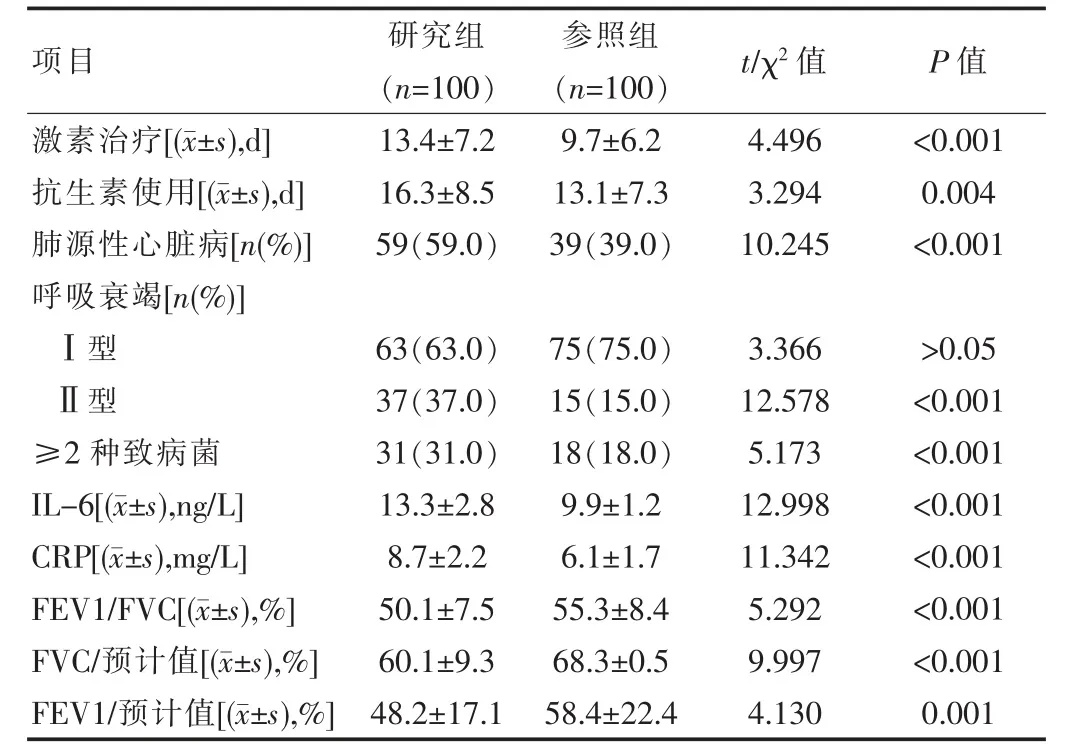
表1 参照组和研究组临床特点对比
2.2 参照组和研究组营养状况对比
参照组和研究组对比三酰甘油、高密度脂蛋白、血红蛋白、白蛋白、总蛋白等水平的数据,差异有统计学意义(P<0.05),见表2。
表2 参照组和研究组营养状况对比(±s)

表2 参照组和研究组营养状况对比(±s)
?
2.3 Logistic多因素回归分析
Logistic多因素回归分析表明:COPD合并DM的影响因素包括激素和抗生素治疗时间、肺源性心脏病、Ⅱ型呼吸衰竭、致病菌、炎症水平、肺功能异常(P<0.05),见表3。
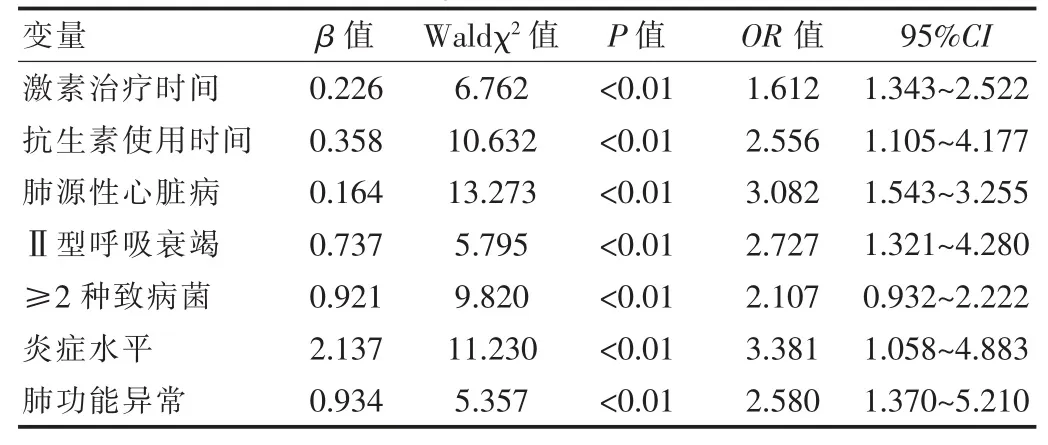
表3 Logistic多因素回归分析
3 讨论
在临床上,COPD发生后主要特征为气流不完全可逆受限,且大多临床实践证明[7],肺功能降低与COPD合并DM具有明显相关性。在DM发病后,肺部为主要受累器官之一,且疾病的进展主要受到其功能变化的影响[8]。该文结果显示,参照组和研究组对比FEV1/FVC、FVC/预计值、FEV1/预计值等水平的数据表明研究组明显较低(P<0.05)。临床目前通过检测FEV1水平以测定COPD肺功能,通常该指标越大,则其代表呼吸改善越好,且在支气管舒张试验中可获得良好反应[9]。但部分患者可能治疗中存在相反现象,因此提升诊断准确性尤为重要。COPD发病后,患者的肺功能降低且不可逆,而其严重程度可通过FEV1加以反映[10]。在监测肺功能时,FEV1/FVC、FEV1等均属于相关指标,二者降低则患者存在异常肺功能降低,后者可提示患者DM患病风险增加[11-12]。作为一种临床诊断指标,FEV1的优势在于诊断值准确、可重复性、操作简单[13]。该文显示,参照组和研究组对比≥2种致病菌、IL-6、CRP水平的数据表明研究组明显较高(P<0.05)。分析原因,COPD患者因合并DM,则其血糖处于持续较高水平,此种情况可严重降低粒细胞吞噬功能,所以机体产生抗体的数量降低,进一步增加了炎症因子水平,造成免疫力下降[14-15]。同时高血糖状态长时间存在还可引起血管功能异常,并为细菌繁殖、滋生提供良好条件,从而降低免疫力,增加细菌感染率[16]。该文还显示,参照组和研究组对比激素和抗生素治疗时间、肺源性心脏病、Ⅱ型呼吸衰竭的数据表明研究组更高(P<0.05)。这表明患者采用糖皮质激素长期治疗可导致葡萄糖分解速度降低,可降低其利用率,进而引发机体血糖异常而造成DM[17]。针对COPD合并DM而言,二者相互影响,且存在恶性循环,因此是一种特殊的合并症,在防治过程中需注意兼顾。首先需对患者的血糖水平予以积极控制,对于降糖药口服治疗无效或糖尿病中重度患者而言,需采用胰岛素及早治疗,以防后续治疗中抗感染失效,且会造成无法缓解咳喘的情况。同时还需避免血糖过高,以防感染加重或自身糖尿病加重。目前可采用速效抗胆碱能药物如异丙托溴胺联合速效β2受体激动剂如硫酸特布他林进行雾化吸入治疗,若患者病情危重且治疗无效,则需全身使用糖皮质激素,以便短期内降低病死率,改善肺功能。可采用氢化可的松、甲强龙、泼尼松等半衰期较短的药物进行治疗,防止使用地塞米松这类半衰期较长的药物,以防进一步增高血糖,从而无法有效控制血糖。而在使用抗感染药物时,还需注意患者因病情严重、年龄偏大且抗菌素反复使用、机械通气、激素治疗等影响,所以其发生真菌、革兰氏阴性菌(包括铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌)等耐药菌感染的概率较高,因此初期治疗过程中可选择三、四代头孢菌素、β-内酰胺类(含酶抑制剂)、环丙沙星等药物进行治疗,可联合应用抗菌药物,以氨基糖苷类为主,若患者治疗无效应则可进行真菌培养检查,一旦结果呈阳性,则可立即给予抗真菌药物卡泊芬净、伏立康唑等治疗。该文还显示,研究组三酰甘油、高密度脂蛋白、血红蛋白、白蛋白、总蛋白等水平低于参照组(P<0.05)。这表明COPD合并DM患者普遍存在较为严重的营养不良情况。分析原因为患者药物不良反应、心功能不全、胃肠道瘀血、缺氧等影响,造成吸收、消化等障碍,或者摄入不足,加之焦虑、感染等促使机体处于负氮平衡状态,而呼吸机做功、呼吸困难、气促等又会增加能耗,所以其营养普遍较差。因此临床还需结合患者实际情况加强饮食治疗和管理,合理提供营养物质,控制总热量,注意低盐饮食,高纤维素、高维生素、低碳水化合物、高蛋白等比例适当,以改善机体营养状况。对于无法进食的患者,则可采用静脉高营养或者经胃肠对要素饮食加以补充,积极维持酸碱平衡和水电解质平衡,注意对低蛋白血症予以有效纠正,同时需注意增强患者耐力和呼吸肌力,提升免疫力,以控制感染,减少并发症,预防肺功能降低,从而保障疗效。另外该文还显示Logistic多因素回归分析表明:COPD合并DM的影响因素包括激素和抗生素治疗时间、肺源性心脏病、Ⅱ型呼吸衰竭、致病菌、炎症水平、肺功能异常(P<0.05)。这表明,在COPD合并DM患者发病过程中存在多种因素影响,临床治疗时需结合相关因素制定治疗和预防措施,并积极进行干预,以改善患者的预后恢复[18]。
综上所述,在COPD合并DM患者治疗中需对其激素和抗生素治疗时间、致病菌感染情况、炎症反应、肺功能状况、营养状况等予以重点关注。

