1H-MRS联合3D-ASL分析在颅脑肿瘤研究中的临床应用价值
何沛芝
(广元市第一人民医院放射科 四川 广元 628017)
目前常见的颅内肿瘤临床检查方法一般为MRI常规扫描序列,主要以形态学成像为主,不能反映组织功能代谢,对于形态相似的肿瘤难以进行判断[1]。不同种类及不同级别的脑肿瘤异质性不同,使得治疗方案出现一定的差异,包括手术、放疗、化疗,治疗方式与时间均存在一定差异[2]。因此临床需要在术前准确判断患者肿瘤的级别与恶性程度,对手术方案的制定及预后情况较为重要。1H-MRS是临床唯一能够侵入机体组织器官能量代谢的诊断方式,并对生物化学变化进行观察,有效弥补了常规MRI在诊断中的不足[3]。本文将我院2018年3月—2020年4月收治的50例颅脑肿瘤患者作为研究对象,分析1H-MRS的主要代谢物比值及联合3D-ASL提高准确率的情况,内容如下。
1 资料与方法
1.1 临床资料
选取2018年3月—2020年4月在本院进行治疗的50例颅脑肿瘤患者进行研究,并选择对侧正常部位21处作为对照。纳入标准:①病理证实为胶质瘤、脑膜瘤、转移瘤、淋巴瘤;②均选择为单发病灶;③均知晓本文研究且愿意参加。排除标准:①检查前有放化疗病史;②有颅脑外伤及手术史;③图像不符合诊断的。其中胶质瘤20例(分为低级别组9例;高级别组11例),其中女性15例,男性5例,年龄为35~74岁,平均年龄为(46.85±7.04)岁。脑膜瘤14例,其中女性7例,男性7例,年龄为33~71岁,平均年龄为(45.11±6.11)岁。转移瘤10例,其中女性4例,男性6例,年龄为36~72岁,平均年龄为(46.05±6.89)岁。淋巴瘤6例,其中女性2例,男性4例,年龄为35~73岁,平均年龄为(46.34±5.20)岁。患者基本资料,无统计学差异(P>0.05),可进行研究。
1.2 方法
采用本院GE1.5T MR机,常规MR T1WI T2WI FLAIR序列,增强后观察T1WI横、矢、冠状位图像。1H-MRS采用多体素扫描,多体素采用点分辨波谱分析(PRESS)序列,TR 1 000 ms,TE 144 ms,层厚10 mm,自动扫描水抑制及匀场。3D-ASL脑功能灌注成像扫描参数:TR/TE=4 750/10,层厚4 mm,标记后延迟1 646 ms。
1.3 观察指标
观察不同肿瘤的3D-ASL表现及MRS与参照区的代谢物比值。
1.4 统计学处理
采用SPSS 23.0统计软件进行计算,其中χ2用于检验计数资料,使用率(%)进行表达,组间比较使用t检验计量资料,采取均数±标准差(±s)表达,根据P的大小决定数据是否存在差异,其中P<0.05表示数据存在统计学差异。
2 结果
2.1 常规MRI表现
20例胶质瘤患者,低级别呈稍长T1、T2号,增强呈无或轻度强化,高级别呈混杂T1、T2信号,增强呈斑片状、线条状、花环状或结节样强化,内伴坏死及出血,灶周常有重度水肿。14例脑膜瘤患者平扫呈等、低T1及高、等、低T2信号,增强大部分明显均匀强化,高级别呈不均匀强化,部分见脑膜尾征。10例转移瘤患者中,平扫出现长T1、T2信号,增强后呈环状强化,灶周伴大片指压样水肿信号。6例淋巴瘤患者中,平时呈长T1长T2信号,明显强化,部分伴坏死,瘤周水肿明显。
2.2 1H-MRS表现
各肿瘤实质区乙酰天门冬氨酸(NAA)明显降低或缺失,胆碱(Cho)含量明显升高;胶质瘤NAA下降,Cho升高,Cho/NAA升高,肿瘤级别越高,恶性程度越大,Cho/NAA比值越高。脑膜瘤NAA几乎消失,Cr降低,Cho峰显著升高,Cho/Cr升高,出现ALa峰。转移瘤Cho峰升高,NAA和Cr峰出现部分或完全缺失。淋巴瘤患者Cho峰升高,Cr降低,NAA降低,Lip高耸,Lip对淋巴瘤有高度特异性。
2.3 不同类型脑肿瘤及参照区代谢物比值
病灶区MRS与参照区对比,高低级别胶质瘤及淋巴瘤NAA/Cho、NAA/Cr均出现明显降低的情况,其比值与胶质瘤级别呈高度负相关,Cho/Cr明显升高,其比值与分级呈高度正相关;脑膜瘤在NAA/Cho、NAA/Cr值为所有组间最低,转移瘤的Cho/Cr值为组间最高,均差异显著(P<0.05),见表1。
表1 不同类型脑肿瘤及参照区代谢物比值(± s)
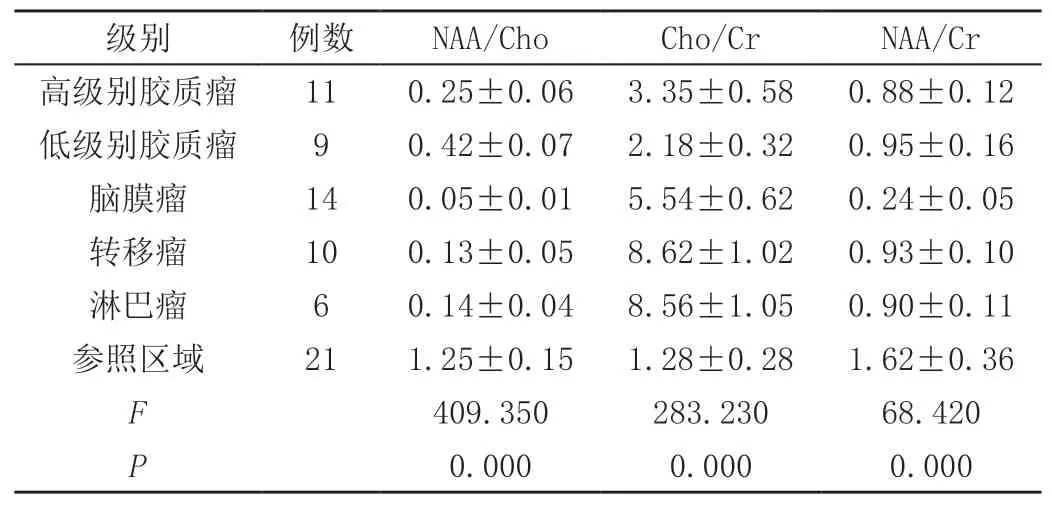
表1 不同类型脑肿瘤及参照区代谢物比值(± s)
?
2.4 1H-MRS联合3D-ASL对研究组患者诊断准确率
1H-MRS联合3D-ASL在诊断准确率上,与单一1H-MRS诊断无显著差异(P>0.05),见表2。
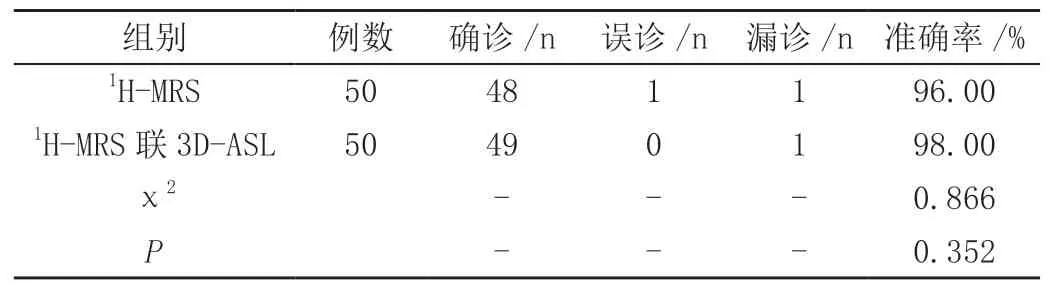
表2 1H-MRS联合3D-ASL对研究组患者诊断准确率
3 讨论
目前在我国由于神经系统脑肿瘤导致死亡的患者数量不断攀升,因其会侵犯患者正常的脑组织,使得放疗与化疗治疗无效果,致患者病死率不断提高[4]。目前颅脑肿瘤治疗方式仍以手术为主,同时配合放化疗,术前的准确诊断,对脑功能的详细功能制图,并实施个体化的手术方案,才能够最大限度地切除肿瘤,延长患者生存时间[5]。
本文将1H-MRS检查纳入研究,结果显示病灶区MRS与参照区对比,高低级别胶质瘤及淋巴瘤NAA/Cho、NAA/Cr均出现明显降低的情况,其比值与胶质瘤级别呈高度负相关,Cho/Cr明显升高,其比值与分级呈高度正相关;脑膜瘤在NAA/Cho、NAA/Cr值为所有组间最低,转移瘤的Cho/Cr值为组间最高,均差异显著(P<0.05)。1H-MRS联合3D-ASL在诊断准确率上,与单一1H-MRS诊断无显著差异(P>0.05)。1H-MRS的Cho峰与细胞膜磷脂代谢有关,能直接参与细胞膜的合成与分解[6],是评价肿瘤的重要共振峰之一,胶质瘤表现为NAA峰降低[7],在肿瘤的中心实体部分较周边明显,坏死囊变区几乎检测不到NAA,高级别的胶质瘤比低级别的NAA减少得多,NAA/Cho下降得越低,神经元损伤得越厉害;Cho明显升高,说明细胞增殖加快,肿瘤边缘部增加比中心高,实性大于囊性,高级别大于低级别,肿瘤中心及坏死区Cho减少;Cho/NAA、Cho/Cr其比值随恶性程度的增加而增高,Cho/NAA在低级别中比值上升最高约1.3,间变型上升较高,最少2.5,胶质母细胞瘤更高;3D-ASL呈明显高灌注,周围水肿亦呈高灌注。脑膜瘤为非神经元的脑肿瘤,故应不显示NAA,但病例中大多数都能显示较低峰的NAA,可能为部分容积效应所致或混有其他化合物的波峰所致,脑膜瘤分为良性脑膜瘤和非良性脑膜瘤,表现为Cho峰增高,NAA峰消失或明显降低,Cr峰、MI峰明显降低,良性脑膜瘤Cho/Cr比值低于非良性脑膜瘤,40%~79%出现Ala峰,水肿区不见Cho增高提示无肿瘤细胞浸润,非良性脑膜瘤Cho峰更高,出现较高Lip峰,可比正常部分Cr峰高2倍以上,可出现瘤周浸润,不易与高级别胶质瘤鉴别,可结合Cho/Cr、Lac、Lip来鉴别。转移瘤也属脑外肿瘤,实质区主要表现为Cho明显增高,NAA降低,Cho/NAA升高,Cho/Cr稍增高,转移瘤实质区与胶质瘤的鉴别点不大,而转移瘤的水肿区Cho不升高,胶质瘤的水肿区Cho明显升高,代表有肿瘤的浸润,且ASL呈高灌注,转移瘤水肿区呈低灌注,故瘤周水肿可鉴别两者。淋巴瘤表现基本同转移瘤,两者鉴别相对困难,但转移瘤Cho/Cr高于淋巴瘤,淋巴瘤NAA/Cr低于转移瘤,且淋巴瘤易出现高大的Lip及Lac峰。传统的MRI仅可通过形态学、间接征象评价颅内肿瘤,但难以观察到肿瘤的生长活性,1H-MRS联合3D-ASL可从分子水平观察肿瘤的代谢,有利于临床诊断、评估。
综上所述,对于颅内肿瘤患者可采取1H-MRS、3D-ASL联合运用进行鉴别诊断,比单独运用其中一种方法诊断率更高,为临床后期治疗提供可靠依据,并观察其代谢信息,值得应用。

