天然冰片对6-OHDA诱导的PC12细胞损伤的保护作用
孙志军,吴 丹,张俊婷,郑 琴,张群林*
(1. 安徽医科大学 药学院,安徽 合肥 230032;2. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004)
冰片包括天然冰片和合成冰片,天然冰片由樟科植物樟Cinnamomum camphora(L.) presl的新鲜枝、叶经提取加工制成。冰片在古籍中多以“龙脑香”“龙脑”为正名。宋代《本草衍义》记载:“此物大通,利关膈热塞,其清香为百药之先”。明代《本草纲目》记载:“龙脑香,释名片香、羯婆罗香。辛、苦,微寒,无毒。疗脑痛,通诸窍,散郁火”。研究表明冰片可通过镇痛[1]、抗炎[2]、抗氧化[3]和抗癫痫[4]等机制发挥神经保护作用,从而改善局灶性脑缺血[5]、阿尔茨海默症[6]等神经系统疾病导致的神经功能损伤。PC12细胞是一种可显示多种神经元特性的神经细胞株,已被广泛应用于神经系统疾病的体外研究[7-9]。6-OHDA是一种常见的用于实验模拟黑质变性的神经毒素[10]。本实验将建立6-OHDA诱导的PC12细胞损伤模型,用于研究天然冰片是否对PC12细胞具有保护作用,分别利用MTT法、倒置显微镜和流式细胞仪来检测细胞存活率、观察细胞形态以及检测细胞凋亡情况。
1 材料与方法
1.1 试药与仪器
天然冰片(批号:20170112)购于吉安市聚鹏天然香料油有限公司;6-OHDA(批号:18834)购于美国MCE生物科技公司;Annexin V-FITC/PI试剂盒购于上海贝博生物科技有限公司;DMEM高糖培养基购于上海源培生物科技股份有限公司;胎牛血清、青霉素-链霉素溶液(100 ×)、胰酶购于中国碧云天生物有限公司;噻唑蓝(MTT)购于西格玛奥德里奇贸易有限公司;二甲基亚砜(DMSO)购于国药化学试剂有限公司;TH4-200型倒置显微镜(日本奥林巴斯株式会社);FACSVerse型流式细胞仪(美国碧迪公司);Synergy HTX型酶标仪(美国伯腾仪器有限公司)。
1.2 方法
1.2.1天然冰片溶液的配制 精密称取天然冰片粉末适量,用DMSO溶解配成浓度为200 mg/mL的储备液,4°C保存,使用时用细胞培养液稀释至所需浓度。
1.2.2细胞培养 PC12细胞培养于含10%胎牛血清中,青霉素100 U/mL,链霉素100 U/mL的DMEM高糖培养液,37℃,5% CO2。取对数生长期细胞传代,用胰酶消化,倒置显微镜下观察,计数并进行后续实验。
1.2.3天然冰片对正常PC12细胞毒性实验 将PC12细胞分为对照组和天然冰片浓度分别为20、40、60、80、100、120、140、160、180、200 μg/mL的实验组。首先,将PC12细胞接种到96孔板中培养24 h。然后,对照组加入100 μL细胞培养液;实验组加入100 μL不同浓度的天然冰片溶液。每个浓度设置4个复孔,置培养箱中培养48 h后弃去孔内培养液,用PBS冲洗3次。接着,在每孔中加入20 μL MTT(5 mg/mL),继续培养4 h后弃去孔内培养液,每孔加入150 μL DMSO溶液。最后,将96孔板置于37℃摇床上震荡10 min至颗粒充分溶解,在酶标仪上测定490 nm处的吸光度值,计算细胞存活率。
1.2.4细胞存活率实验 将PC12细胞分为对照组、模型组和天然冰片浓度分别为7.5、15、30、60、120 μg/mL的实验组。首先,将PC12细胞接种到96孔板中培养24 h。然后,对照组加入100 μL细胞培养液;模型组加入100 μL 100 μmol/L的6-OHDA溶液;实验组提前24 h加入100 μL不同浓度天然冰片溶液培养,培养24 h后弃去孔内天然冰片溶液,PBS冲洗3次,加入100 μL 100 μmol/L的6-OHDA溶液。6-OHDA作用24 h后用MTT法检测细胞存活率。(MTT实验方法同“1.2.3”)
1.2.5细胞形态学实验 将PC12细胞分为对照组、模型组和天然冰片浓度分别为7.5、15、30 μg/mL的实验组。首先,将PC12细胞接种到6孔板中培养24 h;然后,对照组加入2 mL细胞培养液;模型组加入2 mL 100 μmol/L的6-OHDA溶液;实验组提前24 h加入2 mL不同浓度天然冰片溶液培养,培养24 h后弃去孔内天然冰片溶液,PBS冲洗3次,加入2 mL 100 μmol/L的6-OHDA溶液。6-OHDA作用24 h后置倒置显微镜下观察并拍照。
1.2.6细胞凋亡率实验 PC12细胞分组及给药方法同“1.2.5”。按照Annexin V-FITC/PI试剂盒操作说明,胰酶消化并收集各组细胞于15 mL离心管中,在4℃、1 500 r/min条件下离心5 min,弃上清;用PBS冲洗2次后再次离心5 min,弃上清,收集细胞,用400 μL Annexin V结合液重悬细胞,转至流式管中,在细胞悬液中加入Annexin V-FITC染色液5 μL,轻轻混匀后,置于冰上避光孵育15 min,然后加入10 μL PI染色液,轻轻混匀后于冰上避光孵育5 min后即可用流式细胞仪检测,检测波长为488 nm。
1.2.7统计学方法 用SPSS 22.0软件进行数据分析。计量资料用均数 ± 标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P< 0.05为差异具有统计学意义。
2 结果与分析
2.1 天然冰片对正常PC12细胞毒性实验结果
实验结果显示,天然冰片浓度在0 ~ 200 μg/mL范围内时,PC12细胞存活率大于85%;当天然冰片浓度低于140 μg/mL时,PC12细胞存活率高于对照组细胞存活率,差异具有统计学意义(P<0.01),说明该浓度范围的天然冰片对正常PC12细胞具有增殖作用;当天然冰片浓度高于160 μg/mL时,PC12细胞存活率低于对照组细胞存活率,差异具有统计学意义(P<0.05),说明该浓度范围的天然冰片对正常PC12细胞有一定的毒性作用,结果见表1。
表1 天然冰片对正常PC12细胞存活率的影响(±s, n = 6)Tab. 1 Effect of natural borneol on the cell viability of normal PC12 cells(±s, n = 6)
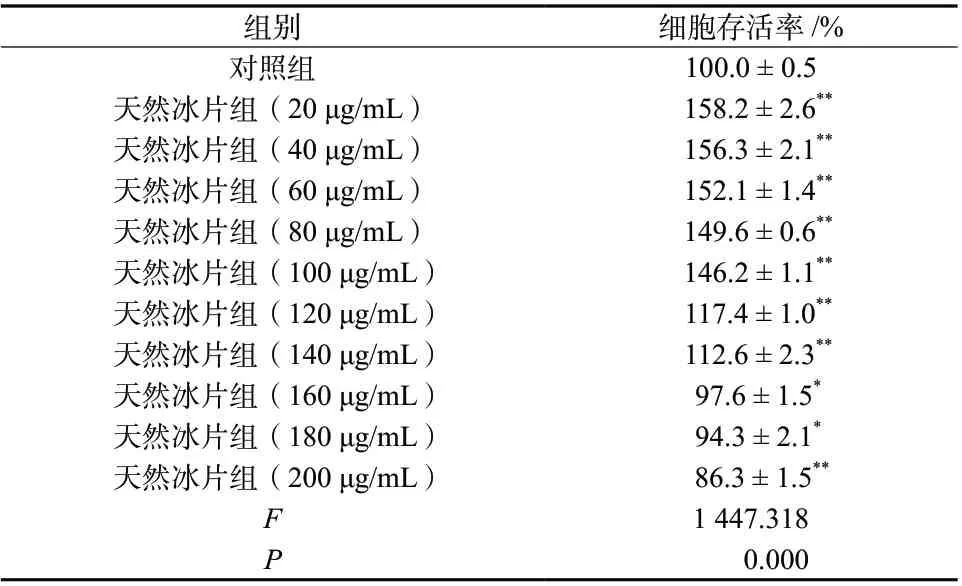
表1 天然冰片对正常PC12细胞存活率的影响(±s, n = 6)Tab. 1 Effect of natural borneol on the cell viability of normal PC12 cells(±s, n = 6)
注:与对照组比较,*P<0.05,**P<0.01
组别 细胞存活率/%对照组 100.0 ± 0.5天然冰片组(20 μg/mL) 158.2 ± 2.6**天然冰片组(40 μg/mL) 156.3 ± 2.1**天然冰片组(60 μg/mL) 152.1 ± 1.4**天然冰片组(80 μg/mL) 149.6 ± 0.6**天然冰片组(100 μg/mL) 146.2 ± 1.1**天然冰片组(120 μg/mL) 117.4 ± 1.0**天然冰片组(140 μg/mL) 112.6 ± 2.3**天然冰片组(160 μg/mL) 97.6 ± 1.5*天然冰片组(180 μg/mL) 94.3 ± 2.1*天然冰片组(200 μg/mL) 86.3 ± 1.5**F 1 447.318 P 0.000
2.2 天然冰片对6-OHDA诱导损伤的PC12细胞存活率的影响
实验结果显示,对照组细胞存活率为(100 ±1.2)%,模型组细胞存活率为(71.5 ± 2.3)%,模型组细胞存活率低于对照组细胞存活率,差异具有统计学意义(P<0.01),该结果表明6-OHDA对PC12细胞具有损伤作用,提示建模成功;实验组细胞存活率高于模型组细胞存活率,差异具有统计学意义(P<0.05),天然冰片浓度为15 μg/mL时,PC12细胞存活率最高,为(96.7 ± 2.6)%,结果见表2。以上结果表明,天然冰片可提高6-OHDA诱导损伤的PC12细胞的存活率。
表2 天然冰片对6-OHDA诱导损伤的PC12细胞存活率的影响 (±s, n = 6)Tab. 2 Effect of natural borneol on the cell viability of PC12 cells injured by 6-OHDA (±s, n = 6)

表2 天然冰片对6-OHDA诱导损伤的PC12细胞存活率的影响 (±s, n = 6)Tab. 2 Effect of natural borneol on the cell viability of PC12 cells injured by 6-OHDA (±s, n = 6)
注:与对照组比较,**P<0.01;与模型组比,#P<0.05,##P<0.01
组别 细胞存活率/%对照组 100.0 ± 1.2模型组 71.5 ± 2.3**天然冰片组(7.5 μg/mL) 83.5 ± 1.9##天然冰片组(15 μg/mL) 96.7 ± 2.6##天然冰片组(30 μg/mL) 87.4 ± 3.9##天然冰片组(60 μg/mL) 80.7 ± 4.5##天然冰片组(120 μg/mL) 77.6 ± 5.1#F 47.167 P 0.000
2.3 天然冰片对6-OHDA诱导损伤的PC12细胞形态学的影响
倒置显微镜下观察各组细胞形态,可见对照组PC12细胞呈梭形,胞体饱满,密度大,折光性较强(图1A);与对照组相比,模型组PC12细胞体型变小,部分细胞损伤成圆形,密度减小,折光性减弱(图1B);与模型组相比,实验组PC12细胞体型变大,密度增大,折光性增强,天然冰片浓度为15 μg/mL时效果最好(图1C、D、E)。以上结果表明,天然冰片对6-OHDA诱导损伤的PC12细胞有形态保护作用。

图1 天然冰片对6-OHDA诱导损伤的PC12细胞形态学的影响Fig.1 Effect of natural borneol on the cell morphology of PC12 cells injured by 6-OHDA
2.4 天然冰片对6-OHDA诱导损伤的PC12细胞凋亡的影响
实验结果显示,6-OHDA主要诱导PC12细胞早期凋亡,见图2。对照组细胞凋亡率为 (0.6 ± 0.02) %,模型组细胞凋亡率为(28.7 ± 0.6)%,模型组细胞凋亡率高于对照组细胞凋亡率,差异具有统计学意义(P<0.01),该结果表明6-OHDA对PC12细胞具有损伤作用,提示建模成功。实验组细胞凋亡率低于模型组细胞凋亡率,差异具有统计学意义(P<0.01),天然冰片浓度为15 μg/mL时,PC12细胞凋亡率最低,为(7.3 ± 0.4)%,结果见表3。以上结果表明,天然冰片对6-OHDA诱导损伤的PC12细胞凋亡有抑制作用。

图2 天然冰片对6-OHDA诱导损伤的PC12细胞凋亡的影响 (±s, n = 6)Fig.2 Effect of natural borneol on the apoptosis of PC12 cells injured by 6-OHDA (±s, n = 6)
表3 天然冰片对6-OHDA诱导损伤的PC12细胞凋亡率的影响(±s, n = 6)Tab. 3 Effect of natural borneol on the apoptotic rate of PC12 cells injured by 6-OHDA (±s, n = 6)

表3 天然冰片对6-OHDA诱导损伤的PC12细胞凋亡率的影响(±s, n = 6)Tab. 3 Effect of natural borneol on the apoptotic rate of PC12 cells injured by 6-OHDA (±s, n = 6)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别 细胞凋亡率/%对照组 0.6 ± 0.02模型组 28.7 ± 0.6**天然冰片组(7.5 μg/mL) 20.4 ± 0.4##天然冰片组(15 μg/mL) 7.3 ± 0.4##天然冰片组(30 μg/mL) 11.7 ± 0.4##F 2 019.042 P 0.000
3 讨论
有文献报道芳香开窍药对神经细胞有很好的保护作用,苏合香挥发油可保护大鼠皮层神经细胞免受糖氧剥夺/再复氧(OGD/R)的损伤[11];麝香可保护局灶性脑缺血大鼠神经元[12]。但这类中药大部分成分复杂,药效成分不明确,生物靶点多,这就导致其发挥神经保护作用的药效成分很难确定。天然冰片为小分子化合物,2020年版《中国药典》规定天然冰片含右旋龙脑不得少于96.0%,其具有药效成分单一、明确、纯度高的优点。本研究以6-OHDA诱导损伤的PC12细胞为实验对象,对天然冰片的神经保护作用进行了研究。结果显示,天然冰片可以保护PC12细胞免受神经毒素6-OHDA的损伤,但天然冰片保护PC12细胞的机制尚不明确。芳香开窍药石菖蒲的药效成分β-细辛醚可通过抑制TNF-α、IL-1β的分泌,下调水通道蛋白4(AQP4)的表达来保护星形胶质细胞,发挥神经保护作用[13],天然冰片可能通过相似的机制发挥对PC12细胞的保护作用,课题组后期将对其机制进行研究。
有文献报道天然冰片可通过抑制脑海马体CA1、CA3区中瞬时受体电位锚蛋白1(TRPA1)和瞬时感受器电位香草酸受体Ⅰ型蛋白(TRPV1)的表达以及增加神经递质γ-氨基丁酸(GABA)的释放,对癫痫持续状态模型小鼠发挥抗惊厥作用[14];天然冰片可通过增加B淋巴细胞瘤-2(Bcl-2)基因表达量,降低Bcl-2相关蛋白的表达来实现对阿尔兹海默症的治疗作用[6]。已有研究表明天然冰片对神经损伤有治疗作用。本研究不足之处在于未对天然冰片对6-OHDA诱导损伤的PC12细胞的治疗作用进行研究,后期将进行考察。
4 结论
本研究表明芳香开窍药天然冰片可以保护6-OHDA诱导损伤的PC12细胞,具有神经保护作用。但天然冰片发挥神经保护作用具体的机制有待进一步研究。本研究为芳香开窍药天然冰片的神经保护作用提供了理论依据和实验支持,为天然冰片应用到神经系统疾病的治疗提供了理论基础。

