黄芪对2 型糖尿病大鼠碱性磷酸酶与炎症反应的影响
王语聪,谢智鑫,张学艳,杨秋萍,韩建春,
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028;3.东北农业大学医院,黑龙江哈尔滨 150030)
在我国2 型糖尿病(Type 2 Diabetes Mellitus,T2DM)发病率呈现逐年递增趋势[1],目前糖尿病的治疗方法主要包括口服抗糖尿病药物和胰岛素。然而,连续使用这些药物会导致胰岛素抵抗和副作用,对糖尿病患者有效、无毒和价格友好的药物的需求迫切。近年研究表明,糖尿病特征之一就是炎性反应,这与脂多糖(Lipopolysaccharides,LPS)增多有关。大量LPS进入血液循环后诱发炎症因子释放,进而引起炎症失衡,导致胰岛素抵抗(Insulin Resistance,IR)和最终诱发2 型糖尿病,现已证明此作用为“代谢性内毒素血症”[2]。肠道碱性磷酸酶(Intestinal alkaline phosphatase,IAP)可以通过对LPS进行去磷酸化作用来保护细胞[3],从而降低炎症发生。此外,Bates等[4]探究LPS和IAP之间控制肠道炎症水平的动态平衡反馈机制,研究表明LPS通过激活两条不同的途径诱导炎症(即NFkB和LPS依赖的TNF-a释放,后者通过TNF受体起作用)上调IAP基因转录的表达,IAP使LPS去磷酸化。去磷酸化的LPS不再能够触发TLR4 刺激,甚至可能阻断该受体的结合。当刺激加大后炎症相关基因的上调导致炎症和细菌跨粘膜通道的增加,细胞内IAP可阻止NFkB途径的两个关键蛋白磷酸化。总之,IAP通过在两个水平下调NFkB途径来控制炎症:通过减少LPS对TLR4 的刺激和通过阻止NFkB转位到细胞核。因此,IAP与LPS呈负相关且对炎症反应具有控制作用。
黄芪(Astragalus)作为药食同源植物,被广泛应用于临床领域。黄芪属于豆科草本植物类,含有丰富生物活性物质[5],如黄酮类、苷类、糖类等。研究表明,黄芪在糖尿病中主要作用是使体内蛋白质合成增多、减少蛋白流出和加快胰岛素分泌[6]。例如,Liu等[7]研究通过提取名为AERP的新型黄芪多糖,通过对db/db糖尿病模型小鼠研究表明能够降低体内血糖的作用,进而证明黄芪能够降低糖尿病血糖。翁孝刚等[8]在研究中表明脂联素是与胰岛素敏感有一定相关性的指标,0.1 g/L黄芪对3T3-L1 脂肪细胞脂联素及mRNA表达水平影响最为显著,说明黄芪对其有促进作用,推测黄芪可以影响胰岛素抵抗。此外,费煜畅等[9]研究发现,黄芪多糖能够通过影响THP-1 衍生巨噬细胞中产生炎症因子[肿瘤坏死因子-α(TNF-α)、白介素-12(IL-12)和白介素-10(IL-10)],从而调控炎症因子表达水平,最终增强细胞免疫作用,抑制肿瘤生长。
上述研究已指出黄芪具有降低血压、血糖和抗炎等活性,但黄芪作为一种药食同源的植物,直接食用能否促进IAP活性及在糖尿病模型中IAP、LPS和炎症反应三者之间的关系至今仍不清楚。因此,本实验以T2DM大鼠为模型,通过灌胃黄芪,检测大鼠体质量变化和血糖浓度变化、粪便中IAP活力和LPS浓度,以及采用MSD多因子检测手段来探究血清中炎症因子水平[白介素-6(IL-6)、TNF-α、γ干扰素(IFN-γ)、白细胞介素-1(IL-1β)、生长调节致癌基因α(KC/GRO)、白介素-4(IL-4)、白介素-5(IL-5)、白介素-10(IL-10)、白介素-13(IL-13)]的变化,探究黄芪对糖尿病大鼠粪便中IAP和LPS的变化和血清中炎症反应的影响,为黄芪在功能性食品开发利用提供依据。
1 材料和方法
1.1 材料与仪器
SPF级别SD雄性大鼠(150±20 )g(合格证:No.1103241911038497)北京斯贝福生物有限公司;黄芪颗粒 南京同仁堂药业采用清水煎煮,制成浓缩液,进行灌胃用药;链脲佐菌素(STZ)美国Sigma公司;碱性磷酸酶试剂盒型号P0321 碧云天生物技术有限责任公司;内毒素检测试剂盒型号EC80545S厦门试剂生物科技责任有限公司;Proinflammatory Panel 2(rat)Kits型号K15059DMeso Scale Diagnostics LLC公司;AIN-93M标准饲料(NMF,总热能3601 kCal/kg,10%的能量为脂肪和14.1%的能量为蛋白质)中国营养动物饲料高科技有限公司;高糖高脂饲料(1.5%胆固醇、0.25%胆酸钠、10%猪油、5%蔗糖、83.25%标准饲料)中国营养动物饲料高科技有限公司
HERAEUS Multifuge X3R离心机 赛默飞世尔科技(中国)有限公司;1300 MESO® QuickPlex SQ 120 Meso Scale Diagnostics型MULTI‐ARRAY、MULTI‐SPOT®微孔板、MSD读板机 LLC公司;I14698I血糖测定仪 强生医疗器械有限公司
1.2 实验方法
1.2.1 实验动物分组及干预 将大鼠饲养于动物笼中,并保持50%±15%湿度,(22±2)℃温度和昼夜12 h条件下单笼饲养。所有的试验步骤遵循试验动物护理以及动物协议,由西安交通大学动物伦理委员会批准[10]。在适应性喂养后,开始建立2 型糖尿病大鼠模型。除正常对照组外,其余组均高糖高脂饲料喂养4 周。将模型组和黄芪剂量组给予30 mg/kg STZ腹腔注射(禁食12 h),继续喂养高糖高脂饲料;注射后第3 d和第7 d(禁食12 h),检测空腹血糖值,选取空腹血糖值≥11.1 mmol/L的大鼠为造模成功的大鼠[11−12]。在对STZ粉剂进行计算时,以30 mg/kg为计量标准,溶解于新鲜的柠檬酸钠缓冲液中(0.1 mol/L柠檬酸钠缓冲液,pH4.3)。为保证其特性,应现用现配,并避光保存。
将大鼠分成4 组(n=10)并投喂标准饮食及高糖高脂饲料。第1 组正常对照组:未经处理,每日给予标准饲料饲喂并灌胃20 mL/kg超纯水;第2 组模型组:建模成功后喂饲高糖高脂饲料并灌胃20 mL/kg超纯水;第3 组黄芪低剂量组:建模成功后喂饲高糖高脂饲料并每天灌胃20 mL/kg黄芪剂量为0.25 g/kg溶剂;第4 组黄芪高剂量组:建模成功后喂饲高糖高脂饲料并每天灌胃20 mL/kg黄芪剂量为0.5 g/kg溶剂。依据文献报道[13],选择此黄芪低、高剂量。试验期间小鼠自由采食和饮水,每天早上八点定时灌胃,在建模成功后第4 周处死并进行炎症因子指标检测。
试验开始后采取2 粒大鼠粪便于EP管中放在−20 ℃储存。用于检测粪便中碱性磷酸酶和细菌内毒素含量。
1.2.3 大鼠体重和血糖值检测 开始条件喂养后,每周进行尾静脉采血用血糖仪测定空腹血糖(Fasting blood glucose,FBG),并称量体重。
1.2.4 细菌内毒素(脂多糖LPS)测定 取少量粪便,加入一定比例细菌内毒素检验用水(1:10 g/mL),迅速离心1 min(3000×g)收集上清液,利用试管定量显色基质法检测细菌内毒素浓度[14]。
1.2.5 碱性磷酸酶测定 取少量新鲜粪便,以1 mg粪便中加入50 μL PBS溶液比例进行稀释。用旋涡法制备粪便匀浆悬液,通过离心(20 min,10000×g)收集含IAP上清液,并根据碱性磷酸酶试剂盒说明书测定IAP活性。
1.2.6 MSD多因子检测 炎症因子含量利用MSD电化学发光(ECLA)检测技术,以SULFO‐TAGTM标记物,在MULTI‐ARRAY和MULTI‐SPOT®微孔板电极表面通电后,电化学作用激发SULFO‐TAGTM标记物发出强光,检测炎症因子含量[15]。
1.3 数据分析
本研究通过Excel、Origin 2017、IBM SPSS Statistics 20 对数据进行整理分析。试验数据均表示为平均值±标准误差(Mean±SEM),采用t检验进行统计分析,P<0.05 认为差异具有统计学意义,即差异显著,P<0.01 即极显著差异。
2 结果与分析
2.1 大鼠血糖变化
如表1 所示,建模前血糖无显著差异(P>0.05),建模成功后的7 和14 d时,与正常对照组相比,模型组血糖有极显著升高(P<0.01);与模型组相比,黄芪剂量组均无显著差异(P>0.05)。在21 d时,与正常对照组相比,模型组有极显著差异(P<0.01);与模型组相比,黄芪低剂量组无显著差异(P>0.05),高剂量组显著降低(P<0.05)。在28 d时,与正常对照组相比,模型组极显著上升(P<0.01);与模型组相比,黄芪剂量组均显著降低(P<0.05)。
表1 黄芪对2 型糖尿病大鼠空腹血糖的影响(,n=10)Table 1 Effect of Astragalus powder on fasting blood glucose in type 2 diabetic rats (,n=10)
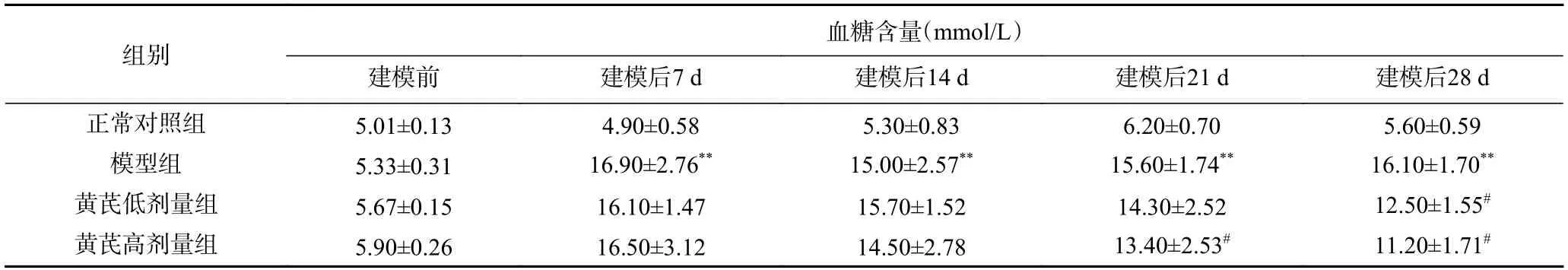
表1 黄芪对2 型糖尿病大鼠空腹血糖的影响(,n=10)Table 1 Effect of Astragalus powder on fasting blood glucose in type 2 diabetic rats (,n=10)
注:*表示与正常对照组相比,差异显著P<0.05;**表示与正常对照组相比,差异极显著P<0.01;#表示与模型对照组相比,差异显著P<0.05:##表示与模型对照组相比,差异极显著P<0.01;表2,图2~图4同。
血糖是诊断T2DM最重要标准,血糖高低标志着T2DM病情改善情况。有研究表明,黄芪主要通过加强胰岛素敏感性,并改善IR状况方式降低血糖,其中黄芪中多种活性成分包括多糖、甲苷等有降糖作用[16]。本实验研究结果表明,黄芪使T2DM大鼠降糖效果明显,与模型组相比差异显著(P<0.05)。说明黄芪对T2DM大鼠有辅助降糖作用,高剂量组降糖效果更好,原因可能是黄芪中活性物质的表面结构中羟基和氨基能够形成络合物,这种络合物对STZ致高血糖小鼠模型有降糖作用[17],因而能够有效抑制T2DM。
2.2 大鼠体质量变化
如图1 所示,建模完成后第4 周,与正常对照组相比,模型组体质量显著下降(P<0.05);与模型组相比,黄芪剂量组差异不显著(P>0.05)。
Sensory evaluation of foreign high-end branded creams 7 20
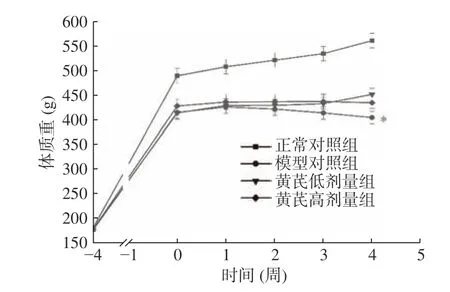
图1 各组大鼠体质量随干预时间变化(,n=10)Fig.1 Changes in body mass of rats in each group with intervention time(,n=10)
整个实验过程中,正常对照组活动正常,精神状态良好,色泽光亮;模型组不活泼、精神状态差,被毛无光泽。黄芪组精神好转,反应敏感度加大,颓废状态有所改善,活动增多,说明黄芪可以缓解T2DM带给大鼠的不良影响。结果表明,建模成功后,正常对照组体重有所增加,而模型组和黄芪剂量组喂饲高糖高脂饲料后,体重出现下降趋势,原因可能是高剂量STZ与高热量饮食联合[18],导致胰岛β细胞发生坏死,并致胰岛素分泌发生不足,进而使体内糖代谢絮乱,发生胰岛素抵抗,大鼠为体内脂肪和蛋白质提供能量[19]。
2.3 粪便中IAP活性和LPS浓度变化
如表2 所示,与正常对照组相比,模型组LPS浓度显著上升(P<0.05);与模型组相比,黄芪剂量组LPS显著降低(P<0.05)。在IAP方面,与正常对照组比,模型组极显著降低(P<0.01);与模型组相比,黄芪剂量组均极显著升高(P<0.01)。
表2 黄芪对2 型糖尿病大鼠粪便中IAP和LPS影响(,n=10)Table 2 Effect of Astragalus on IAP and LPS in fecal of type 2 diabetic rats(,n=10)

表2 黄芪对2 型糖尿病大鼠粪便中IAP和LPS影响(,n=10)Table 2 Effect of Astragalus on IAP and LPS in fecal of type 2 diabetic rats(,n=10)
IAP是一种肠道刷状边界酶,其仅在近端小肠绒毛相关肠细胞中表达,可以作为肠道粘膜防御因子,维持肠道内环境稳定,保护宿主免受肠道炎症损伤。IAP可以降解LPS,降低其毒性,其原因为IAP使LPS脱磷酸,失去破坏性,从而解毒[20]。有研究表明正常人粪便IAP活性要比T2DM患者活性高,粪便中IAP每降低25 μ/g,糖尿病风险增加35%[21]。LPS是革兰氏阴性菌的组成部分,当肠道中LPS浓度过高时,诱发肠道炎症发生。有证据表明,T2DM有利于内毒素(特别是脂多糖(LPS))在肠屏障中易位,导致血液中内毒素浓度轻微升高[22]。Poelstra等[23]首次发现LPS是IAP的作用底物,因此提出IAP可以降解LPS的假说。Bates等[24]研究结果表明,肠道中IAP和LPS存在负相关关系,当肠腔中IAP浓度增加时,对LPS作用增加,LPS所带毒性就得到减少,降低肠道炎症。实验结果表明,黄芪增加T2DM大鼠粪便IAP活性和降低LPS浓度。说明黄芪能够改善糖尿病大鼠肠道中IAP活性并降低LPS的浓度。
2.4 血清中炎症因子含量测定
2.4.1 促炎因子含量变化 如图2 所示,与正常对照组相比,模型组IL-6 浓度、IL-1β浓度、TNF-α浓度和IFN-γ浓度均显著升高(P<0.05 或P<0.01);与模型组相比,黄芪剂量组IL-6、IL-1β、TNF-α和IFNγ均显著降低(P<0.05 或P<0.01)。
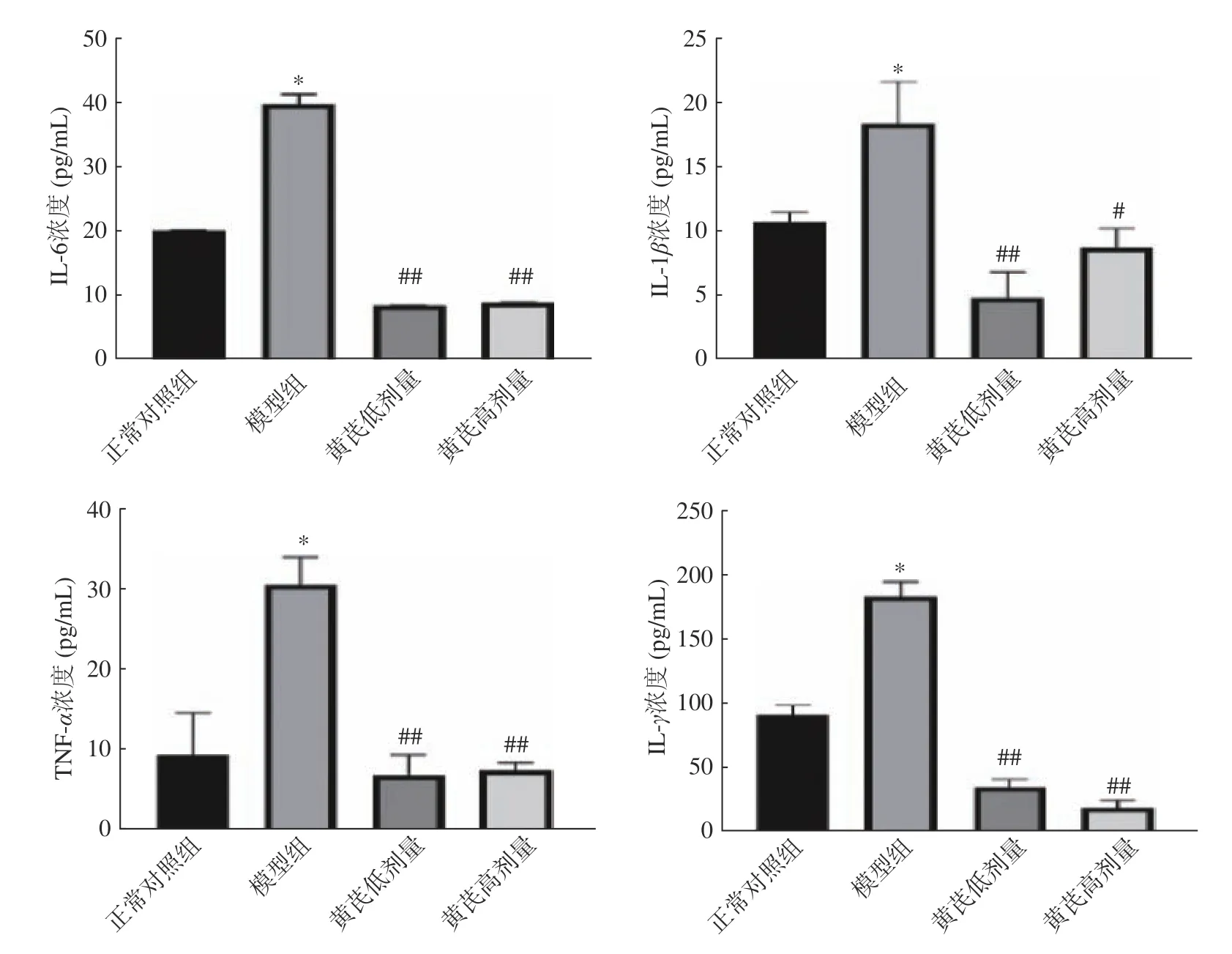
图2 黄芪对小鼠血清IL-6、IL-1β、TNF-α 和IFN-γ 浓度(,n=10)Fig.2 Effect of Astragalus on the concentration of IL-6,IL-1β,TNF-α and IFN-γ in mouse serum(,n=10)
T2DM主要体现胰岛素抵抗及胰岛素分泌不足,已有研究表明,肠道慢性炎症在T2DM发生和发展中发挥重要作用,肠道粘膜免疫发生絮乱,就会引起肠道炎症发生[25]。IL-6、IL-1β、TNF-α和IFN-γ可以作为炎症反应调节因子,在炎症中发挥中心作用,当免疫因子被激活时释放,机体中其含量增加,引起损伤。有研究表明T2DM高血糖可以促进TNFα浓度升高,过多加速胰岛细胞破坏;高脂喂养的小鼠中肠道中IL-6 分泌增加,TNF-α表达升高[26]。张晶[27]在探讨BMDM细胞中黄芪对其中炎症因子影响中,通过黄芪诱导,细胞中IL-6、TNF-α表达受到抑制。郑洋等[28]在急性胰腺炎大鼠中,经过黄芪注射液治疗后发现,大鼠肠道屏障功能得到保护,炎症因子IL-6、TNF-α分泌降低;朱丽坤[29]在db/db小鼠肾脏炎症因子中,同样发现黄芪对IL-1β、TNFα起到了抑制作用。本试验结果表示,黄芪剂量组能够显著降低IL-6、IL-1β、TNF-α和IFN-γ浓度(P<0.05),其可能原因为促炎因子受到胰岛素抵抗以后分泌速度加快,导致胰岛素细胞凋亡速度加快,因此能够证明,黄芪可降低相关炎症因子浓度,从而缓解炎症,进而缓解T2DM。
2.4.2 抗炎因子含量变化 如图3 所示,与正常对照组相比,模型组IL-4、IL-5、IL-10 和IL-13 均显著下降(P<0.05 或P<0.01);与模型组相比,黄芪剂量组IL-4、IL-5、IL-10 和IL-13 均显著降低(P<0.05 或P<0.01)。
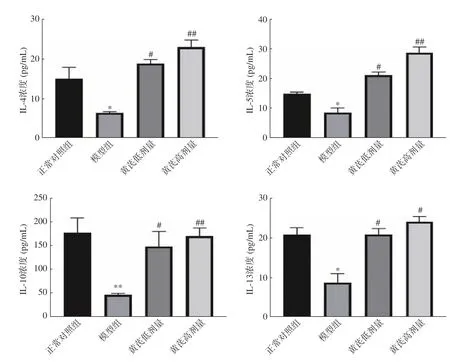
图3 黄芪对小鼠血清IL-4、IL-5、IL-10 和IL-13 浓度(,n=10)Fig.3 Effect of Astragalus on the concentration of IL-4,IL-5,IL-10 and IL-13 in mouse serum(,n=10)
IL-4 典型抗炎因子,在Th2 细胞中都具有代表性炎症因子,可以抑制炎症因子分泌,包括IL-6、TNF-α等,IL-5 同IL-4 一样在Th2 细胞中发挥重要作用,可以缓解由嗜酸性粒细胞诱导炎症效应,Th2 细胞属于抗炎细胞,起到重要抗炎作用,可以使Th1 介导炎症受阻[30];IL-10 是免疫调节因子,可以终止炎症发生;IL-10 属于抗炎因子,可以控制炎性反应发生,机体组织糖、脂肪代谢可以被IL-10 调节,起到T2DM发生预防作用。IL-13 可以使巨噬细胞活化受到抑制,减少炎症因子分泌,可以同时抑制炎症介质产生,又可以使B细胞增殖加快及分泌抗体,起到抗炎因子作用[31]。李金萍[32]探究在溃疡性结肠炎大鼠中,黄芪多糖对其血清因子影响,与模型组相比IL-4 和IL-13 升高显著,结果表明黄芪多糖升高了IL-4 和IL-13 含量,对IL-5 影响不明显;宋厚盼等[33]研究表明黄芪建中汤对十二指肠溃疡大鼠中血清IL-4、IL-10 含量升高,IL-13 含量下降明显。本次实验结果表明,与模型组相比,黄芪高剂量组中大鼠血清IL-4、IL-5、IL-10 浓度有极显著差异(P<0.01);黄芪高剂量组中IL-13 浓度出现差异显著(P<0.05),其可能原因是黄芪刺激抗炎因子,使其表达量增加,从而抑制促炎因子的表达量,并升高抗炎因子浓度,缓解炎症反应。
2.4.3 趋化因子含量变化 如图4 表示,与正常对照组相比,模型组KC/GRO浓度极显著升高(P<0.01);与模型组相比,黄芪剂量组KC/GRO浓度均极显著降低(P<0.01)。

图4 黄芪对小鼠血清KC/GRO浓度(,n=10)Fig.4 Effect of Astragalus affects the serum KC/GRO concentration of mice(,n=10)
KC/GRO是趋化因子中的一种,推测其表达与细胞生长有关,与受体结合后可促进炎症反应[34]。总体来说,由于摄入高脂肪食物会导致肠道中LPS的释放,破坏肠道粘膜从而刺激炎症因子的释放[35],然而,目前还没有对趋化因子的数据支撑。因此,本实验结果表明黄芪能够有效降低糖尿病小鼠血清中KC/GRO,进而降低血清中促炎因子。其可能的原因是黄芪降低LPS及炎症因子的浓度从而减少GRO的表达,进而有效改善T2DM。
3 结论
通过糖尿病模型大鼠实验研究发现,黄芪可以维持血糖稳定,提高肠道中IAP活力,有效降低LPS浓度。通过大鼠血清中抗炎因子、促炎因子及趋化因子水平进一步验证LPS可能引起的炎性反应。全面验证了IAP与炎症因子的关系,因此黄芪能够有效改善T2DM的炎症反应,其作用机制可能是通过调节肠道中IAP活力刺激LPS浓度的变化调控来实现的。有研究表明,IAP活性和相应的LPS去磷酸化能力在小鼠的粪便及肠道中存在,并且IAP在控制细菌成分引起的肠道炎症和细菌通过肠道粘膜方面的体内作用是互补的[24],因此未来需要进一步研究黄芪在肠道粘膜中IAP是如何调控参与改善机体炎症,缓解T2DM的发展。

